一种T细胞的富集方法与流程
一种t细胞的富集方法
技术领域
1.本发明涉及一种t细胞的富集方法,特别是一种从血液中分离富集t细胞的方法。
背景技术:
2.t淋巴细胞(t-lymphocyte)简称t细胞,其来源于骨髓,通过淋巴和血液循环分布到全身的免疫器官和组织,以发挥免疫功能。t细胞的功能和活化机制的研究一直是免疫学研究的热点。近年来随着car-t细胞免疫疗法的不断发展,t细胞在临床治疗肿瘤方面的应用前景及价值越来越受到人们的关注。car-t细胞免疫疗法,即嵌合抗原受体t细胞免疫疗法,它的基本原理就是利用患者自身的免疫细胞来清除癌细胞,从而达到患者治愈的效果,目前在血液癌患者中已经取得了举世瞩目的进展。而作为外周血单个核细胞(pbmc细胞)的重要组成部分,如何从pbmc细胞中获得纯度高活力好的t细胞用于后续的改造就成为了一个急需解决的问题。目前,免疫磁珠分离是分离t细胞应用最广,也是最有效的分离方式,但其成本昂贵,且磁珠会混合t细胞进入后续的培养,磁珠和细胞无法自主分离,磁珠对人体的危害暂时无法评估,会给患者带来潜在的治疗风险。
技术实现要素:
3.针对上述技术问题,本发明提供一种t细胞的富集方法,在不使用磁珠的前提下自血液中分离富集t细胞,且富集后的t细胞具有较高的活率。
4.为达到上述目的,本发明采用的技术方案如下:
5.一种t细胞的富集方法,包括如下步骤:
6.(1)提供清洁且干燥的网状基材,所述网状基材包括多个网线,所述网线相互交叉形成多个筛孔;
7.(2)在所述网状基体上孵育二抗获得富集芯片;
8.(3)获取来自外周血的pbmc细胞,制备为pbmc细胞悬液;
9.(4)向所述pbmc细胞悬液中加入一抗,并孵育,所述一抗包括cd14、cd19和cd20中的至少一种、及cd16和cd56中的至少一种;
10.(5)使孵育一抗后的pbmc细胞悬液流过所述富集芯片,非t细胞特异性结合至所述富集芯片,取剩余细胞液获得富集后的t细胞。
11.优选地,所述pbmc细胞已离心去除淋巴细胞。
12.在一些优选的实施例中,所述二抗为二抗羊抗鼠抗体。
13.更优选地,步骤(2)中,将二抗通过traut试剂连接至所述网状基体上。
14.进一步地,步骤(2)中,将二抗、traut试剂、pbs-edta溶液混合,孵育;将所述网状基体置于培养皿中,使二抗-traut混合液浸没所述网状基体,孵育;将所述网状基体转入bsa溶液中,孵育,制得包被有二抗的富集芯片。
15.具体地,步骤(2)的实施过程如下:在洁净pcr管中混合traut’s reagent溶液,二抗羊抗鼠抗体抗体(1mg/ml),pbs-edta溶液(ph 8.0),使用移液器小心混合后,置于室温孵
育1h;将网状基体置于无菌细胞培养皿中,将二抗羊抗鼠抗体-traut’s混合液滴在网状基体上,并确保网状基体完全被浸没,室温孵育1h;加入pbs-edta溶液,将网状基体转入2%bsa溶液,孵育20min;将抗体包被好的芯片置于pbs中备用。
16.在一些优选的实施例中,步骤(3)中,人外周血和淋巴细胞分离液混合,进行离心处理,获得pbmc层;洗涤;洗涤后加入红细胞裂解液,混匀裂解,离心且离心后弃上清;洗涤;洗涤后制备为pbmc细胞悬液。
17.更优选地,步骤(3)具体实施如下:将人外周血分离稀释后加入置有淋巴细胞分离液的离心管内,离心处理,血液样本自上至下依次分为血浆层、乳白色pbmc层、分离液层和红细胞层;弃去血浆层,吸取pbmc层并置于离心管中;加入pbs洗涤;加入红细胞裂解液,充分混匀室温裂解,离心;弃上清,加入pbs对pbmc洗涤,离心;弃上清,加入pbs重悬pbmc,获得所述pbmc细胞悬液。
18.具体地,步骤(3)包括:
19.1)取外周血置于肝素抗凝管中,并4℃保存备用(于24h内完成pbmc提取,注意血液不要溶血);
20.2)用巴氏管将血液从抗凝管中转移到离心管中,加入等体积pbs对血液进行稀释并充分混匀;
21.3)取淋巴细胞分离液于另一离心管中;
22.4)用巴氏管吸取步骤2)中稀释的血液于步骤3)的离心管中(在离分层液上方1cm处,离心管倾斜60
°
,沿离心管壁缓缓加入,使稀释血液重叠于分层液上,并与分离液形成明显界面);
23.5)室温,离心,要求离心机为水平转子,升降速度均调为1;
24.6)离心结束后,样本应分为四层,从上到下依次是血浆层、乳白色pbmc层、分离液层、红细胞层;
25.7)用巴氏管垂直小心吸弃血浆层,吸取过程尽量轻柔缓慢,避免过快破坏pbmc层;
26.8)小心吸取pbmc层细胞于另一离心管中,并加入5倍体积的pbs洗1次,室温,离心;
27.9)离心后加入红细胞裂解液,充分混匀室温裂解,室温,离心;
28.10)离心后,弃上清,加入pbs对pbmc进行洗涤,室温,离心;
29.11)弃上清,加入适量pbs重悬pbmc,形成pbmc细胞悬液。
30.在一些优选的实施例中,步骤(4)中,将步骤(3)的pbmc细胞混合液放于离心管中,加入cd14、cd19、cd20、cd16和cd56抗体,3~5℃孵育10~30min。
31.更优选地,步骤(4)具体如下:将步骤(3)的pbmc细胞混合液放于离心管中,加入cd14、cd19、cd20、cd16和cd56抗体,3~5℃孵育10~30min,离心后弃上清,洗涤,将pbmc重悬获得孵育一抗后的pbmc细胞悬液。
32.具体地,步骤(4)包括:将pbmc细胞放置于离心管中,加入cd14、cd19、cd20、cd16、cd56五种抗体4℃孵育20min,孵育总体积为1ml;孵育完成后,室温,离心,弃上清;加入pbs进行洗涤,室温rpm,5min,弃上清;加入pbs对pbmc细胞重悬备用。
33.在一些优选的实施例中,步骤(5)中,将所述富集芯片装入富集装置的富集腔中,该富集装置具有和所述富集腔连通的加样口和排液口,所述加样口和所述排液口分别位于所述富集芯片的相对两侧;自所述加样口中加入孵育一抗后的pbmc细胞悬液,孵育;对富集
腔内的进行抽吸,使pbmc细胞悬液流过富集芯片;自排液口将剩余细胞液排出,获得富集后的t细胞。
34.具体地,对富集腔内的液体抽吸,使其以30~100μl/min的流速流过富集芯片的筛孔。
35.在一些优选的实施例中,步骤(1)中,所述网线包括基底层及包被于所述基底层表面的惰性金属层。优选地,惰性金属层的材料为金或其它贵金属。更优选地,所述基底层为不锈钢制成的金属丝,惰性金属层由贵金属或其合金(如aupd)制成。进一步地,所述惰性金属层通过物理镀膜(如,磁控溅射)而成。
36.在一些优选的实施例中,所述筛孔的面积为10-50
×
10-50μm,所述网状基体的直径为10-100mmmm。更优选地,筛孔的面积为18
×
20μm,网状基体的直径为12.4mm。
37.在一些优选的实施例中,对所述网状基体清洁及干燥的具体过程为:a、将milliq水、氨水和双氧水混合并加热,对所述网状基体清洗;b、使用milliq水浸泡所述网状基体;c、使用氮气枪干燥所述网状基体;d、用乙醇浸泡所述网状基体;e、使用氮气枪干燥所述网状基体。
38.更优选地,底基层为不锈钢丝,惰性金属层为镀在不锈钢丝表面上的金层,金层上设有高分子层。
39.本发明采用以上方案,相比现有技术具有如下优点:
40.本发明的富集方法,采用包被抗体的富集芯片来对血液中的t细胞进行纯化富集,保证了t细胞的活率和程度的前提下,不引入磁珠,解决了磁珠与t细胞难以分离的问题,降低分离成本,且消除了磁珠对于患者治疗存在的潜在风险。
附图说明
41.为了更清楚地说明本发明的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
42.图1示出了本发明实施例的富集原理。
43.图2a和图2b为实施例1的样本纯化前的流式直方图和散点图。
44.图2c和图2d为实施例1的样本纯化后的流失直方图和散点图。
45.图3a和图3b为实施例2的样本纯化前的流式直方图和散点图。
46.图3c和图3d为实施例2的样本纯化后的流失直方图和散点图。
47.图4a和图4b为实施例3的样本纯化前的流式直方图和散点图。
48.图4c和图4d为实施例3的样本纯化后的流失直方图和散点图。
49.图5a和图5b为实施例4的样本纯化前的流式直方图和散点图。
50.图5c和图5d为实施例4的样本纯化后的流失直方图和散点图。
具体实施方式
51.下面结合附图对本发明的较佳实施例进行详细阐述,以使本发明的优点和特征能更易于被本领域的技术人员理解。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。
52.参照图1所示,本发明实施例提供一种从血液中富集t细胞的方法,采用包被有二抗的富集芯片对来自血液的pbmc细胞进行分选,获得富集纯化后的t细胞。pbmc细胞孵育有能够和上述二抗特异性结合的cd14、cd19、cd20、cd16和cd56五种抗体,其中,cd14抗体特异性连接至pbmc细胞中的单核细胞,cd19和cd20抗体特异性连接至pbmc细胞中的b细胞,cd16和cd56两种抗体特异性连接至pbmc细胞中的nk细胞。当孵育有上述抗体的pbmc细胞悬液流过富集芯片后,单核细胞上连接的cd14抗体、b细胞上连接的cd19和cd20抗体、及nk细胞上连接的cd16和cd56抗体均和富集芯片上的二抗特异性结合,从而pbmc细胞悬液中的单核细胞、b细胞和nk细胞被富集芯片捕获,t细胞则仍然留在细胞悬液中,且由于该细胞悬液中的非t细胞(单核细胞、b细胞、nk细胞)被截留在富集芯片上,从而剩余细胞悬液中细胞大多为t细胞,t细胞的纯度增大,达到富集分选t细胞的目的。
53.实施例1
54.芯片的网状基材预处理
55.芯片要求高度清洁,有机物污染会极大降低下游包被效果。因此,所有接触芯片的设备都要求无菌或使用氨水-双氧水提前处理,选用表面通过磁控溅射包被金的不锈钢筛网,筛孔的面积为18
×
20μm。使用手术镊时应尽量避免接触芯片中心部位,具体步骤如下:
56.1)使用手术镊和手术剪将芯片剪成12.4mm直径圆形小片;
57.2)在一干净玻璃25ml烧杯加入5:1:1比例的milliq水,25%氨水和30%双氧水,加热至75℃;
58.3)将手术镊与芯片相接处的部位置于步骤2)的混合液中,加热5min;
59.4)更换新的混合液,75℃,5min;
60.5)使用milliq水浸泡芯片1次,2min;
61.6)使用氮气枪干燥芯片直至完全干燥;
62.7)使用99%乙醇浸泡芯片1次,2min;
63.8)使用氮气枪干燥芯片,将芯片保存在无菌环境。
64.抗体包被芯片
65.1)使用电子秤称量2mg traut’s reagent粉末,并使用超纯水定容至1ml;
66.2)在洁净pcr管中混合23μl traut’s reagent溶液,二抗羊抗鼠抗体50μl抗体(1mg/ml),179μl pbs-edta溶液(ph 8.0),使用移液器小心混合后,置于室温孵育1h(抗体浓度需要确认1毫克/毫升);
67.3)将筛网置于35mm无菌细胞培养皿中,将二抗羊抗鼠抗体-traut’s混合液滴在筛网上,并确保筛网完全被浸没,室温孵育1h;
68.4)加入450μl pbs-edta溶液,将筛网转入500μl 2%bsa溶液,孵育20min;
69.5)将抗体包被好的筛网置于pbs中备用。
70.pbmc细胞提取
71.1)抽取人4ml外周血于肝素抗凝管中,并4℃保存备用(最好24h内完成pbmc提取,注意血液不要溶血);
72.2)用3ml巴氏管将4ml血液从抗凝管中转移到15ml离心管中,加入等体积pbs对血液进行稀释并充分混匀;
73.3)取4ml淋巴细胞分离液于15ml离心管中;
74.4)用3ml巴氏管吸取步骤2)中稀释的血液于步骤3)的离心管中(在离分层液上方1cm处,建议离心管倾斜60
°
,沿离心管壁缓缓加入,使稀释血液重叠于分层液上,并与分离液形成明显界面);
75.5)室温,2000rpm,离心25min,要求离心机为水平转子,升降速度均调为1;
76.6)离心结束后,样本应分为四层,从上到下依次是血浆层、乳白色pbmc层、分离液层、红细胞层;
77.7)用巴氏管垂直小心吸弃血浆层,吸取过程尽量轻柔缓慢,避免过快破坏pbmc层;
78.8)小心吸取pbmc层细胞于15ml离心管中,并加入5倍体积的pbs洗1次,室温1500rpm,离心5min;
79.9)离心后加入5ml红细胞裂解液,充分混匀室温裂解5min,室温1500rpm,离心5min;
80.10)离心后,弃上清,加入5ml pbs对pbmc进行洗涤,室温1500rpm,离心5min;
81.11)弃上清,根据要求加入适量pbs重悬pbmc,并进行细胞计数备用。
82.抗体对pbmc细胞孵育
83.1)计200w的pbmc细胞,于1.5ml离心管中;
84.2)加入cd14,cd19,cd20,cd16,cd56五种抗体4℃孵育20min,孵育总体积为1ml;
85.3)孵育完成后,室温1500rpm,离心5min,弃上清;
86.4)加入1ml pbs进行洗涤,室温1500rpm,离心5min,弃上清;
87.5)加入1ml pbs对pbmc细胞重悬备用。
88.t细胞纯化
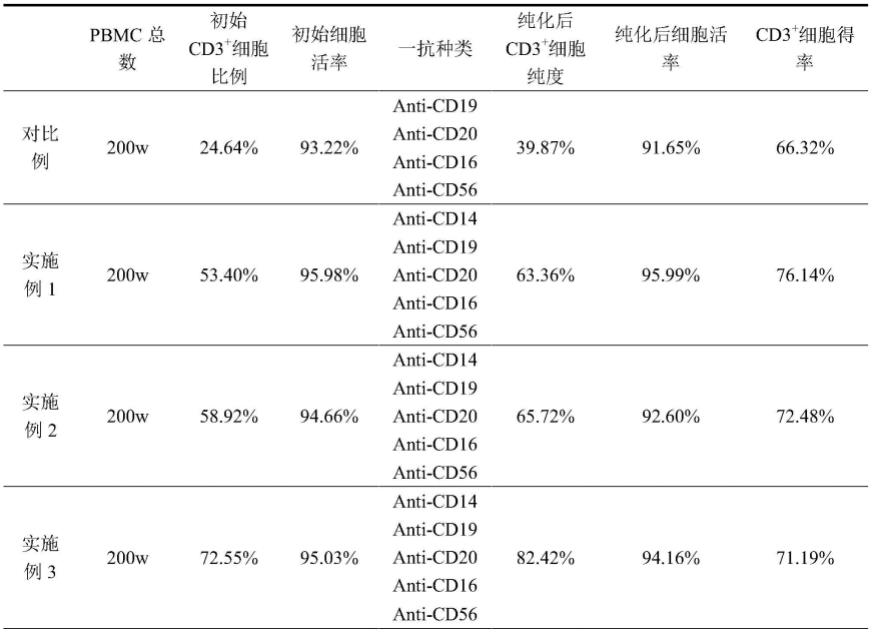
89.1)将步骤4.2中准备好的抗体芯片组装到富集装置中,并用150μl pbs浸润一次,检测是否漏液;
90.2)组装完毕之后,加入步骤4.3中准备好的1ml t细胞悬液,并孵育15min;
91.3)开启抽吸泵,设置抽取流速为50μl/min;
92.4)完成步骤3)后,将细胞取出。
93.其中,抗体芯片装入到富集装置的富集腔内,富集装置具有和富集腔连通的加样口和排液口,加样口和排液口分别位于芯片的上下两侧;自加样口中加入孵育一抗后的pbmc细胞悬液,孵育;使用抽吸泵对富集腔内的进行抽吸,使pbmc细胞悬液流过芯片;自排液口将剩余细胞液排出,获得富集后的t细胞。
94.验证:分别取纯化前的pbmc细胞和纯化后的细胞,分别对细胞进行anti-cd3-apc抗体染色,流式检测纯化前后的t细胞的浓度。纯化前的pbmc细胞悬液的流式检测结果参见图2a和图2b,纯化后的剩余细胞液的流式检测结果参见图2c和图2d。
95.实施例2
96.本实施例基本同实施例1,区别仅在于样本不同。
97.验证:分别取实施例2的纯化前的pbmc细胞和纯化后的细胞,分别对细胞进行anti-cd3-apc抗体染色,流式检测纯化前后的t细胞的浓度。实施例2纯化前的pbmc细胞悬液的流式检测结果参见图3a和图3b,纯化后的剩余细胞液的流式检测结果参见图3c和图3d。
98.实施例2的pbmc细胞悬液中t细胞纯化前的初始比例和活率分别为58.92%和
94.66%。
99.实施例3
100.本实施例基本同实施例1,区别仅在于样本不同。
101.验证:分别取实施例3的纯化前的pbmc细胞和纯化后的细胞,分别对细胞进行anti-cd3-apc抗体染色,流式检测纯化前后的t细胞的浓度。实施例3纯化前的pbmc细胞悬液的流式检测结果参见图4a和图4b,纯化后的剩余细胞液的流式检测结果参见图4c和图4d。
102.实施例3的pbmc细胞悬液中t细胞纯化前的初始比例和活率分别为72.55%和71.19%。
103.对比例
104.本对比例基本同实施例1,区别在于:(1)样本不同;(2)pbmc细胞孵育cd19,cd20,cd16,cd56四种抗体。
105.验证:分别取对比例的纯化前的pbmc细胞和纯化后的细胞,分别对细胞进行anti-cd3-apc抗体染色,流式检测纯化前后的t细胞的浓度。对比例纯化前的pbmc细胞悬液的流式检测结果参见图5a和图5b,纯化后的剩余细胞液的流式检测结果参见图5c和图5d。
106.对比例的pbmc细胞悬液中t细胞纯化前的初始比例和活率分别为53.40%和95.98%,而实施例1的pbmc细胞悬液中t细胞纯化前的初始比例和活率分别为24.64%和93.22%。
107.对比例和实施例1至实施例3的纯化前和传化后的t细胞占总pbmc细胞比例统计参见表1所示。其中,pbmc细胞中t细胞表面有cd3表达,其可和anti-cd3-apc抗体偶联,激发后发出对应颜色的荧光,cd3+细胞即为t细胞。
108.表1
109.110.结合图2a至图5d以及表1所示,纯化后的细胞液中的非t细胞的数量减少,t细胞的纯度增大,而且纯化后的细胞液基本为分选后的t细胞,仅包含部分非t细胞,不存在难以分离的磁珠,同时t细胞的活率和得率均较高。
111.如本说明书和权利要求书中所示,术语“包括”与“包含”仅提示包括已明确标识的步骤和元素,而这些步骤和元素不构成一个排它性的罗列,方法或者设备也可能包含其他的步骤或元素。
112.进一步可以理解的是,本说明书和权利要求书中“多个”是指两个或两个以上,其它量词与之类似。“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。
113.在本说明书和权利要求书中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
114.上述实施例只为说明本发明的技术构思及特点,是一种优选的实施例,其目的在于熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限定本发明的保护范围。凡根据本发明的原理所作的等效变换或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1