一种抑制破骨细胞分化的订书肽及其制备方法和应用
1.本发明涉及多肽药物领域,具体涉及一种抑制破骨细胞分化的订书肽及其制备方法和应用。
背景技术:
2.骨质疏松症是以骨量降低、骨组织显微结构发生改变,以骨脆性增加、骨强度下降、易骨折为特征的一种骨病,其病理生理学基础是骨吸收与骨形成的失衡,该平衡由促骨形成的成骨细胞和促骨吸收的破骨细胞进行调控。目前临床使用最广泛的抗骨质疏松药物主要包括抑制破骨细胞分化的双膦酸盐和促进骨形成的特立帕肽等小分子药物。为提高治疗药物的选择性,减少副作用,当前,通过外源性分子来调控成骨细胞和破骨细胞分化相关的重要信号通路已成为骨质疏松研究的热点方向之一。
3.本技术发明人在现有技术披露的众多信息中注意到,有研究表明糖原合成酶激酶3β(gsk3β)能够促进破骨细胞关键因子nfatc1从细胞核向细胞质的转移,从而抑制破骨细胞的分化;还有文献报道frattide与磷酸化的gsk3β能形成稳定的复合物晶体结构;而gsk3β与磷酸化gsk3β之间存在相互转化的关系,因此,本技术发明人推测特异性地靶向磷酸化gsk3β进而抑制磷酸化gsk3β可在一定程度上抑制gsk3β的表达,从而达到对破骨细胞的负向调控。
4.生物体内蛋白质之间的相互作用在生命过程中起着至关重要的作用。通过人工合成分子来调控蛋白-蛋白相互作用界面是一种有效的策略,其已经广泛地应用于药物化学中以进行疾病干预,其中人工合成多肽即为调控蛋白间相互作用的一种重要手段。但因存在稳定性低,透膜性差等问题,当前,多肽类药物在临床上的应用受到了较大的限制。应用全碳骨架形成侧链环合结构改造多肽来稳定α-螺旋肽的活性构象,即订书肽(stapledpeptide),成为克服这一缺陷的最直接最有效方法。
5.目前现有技术公开了一些具有抑制破骨细胞分化的活性的多肽。例如专利文献cn109111506a,公开了一种用于治疗骨质疏松的多肽,其氨基酸序列为:asp-ser-ser)6-(d-tyr)-asn-(d-trp)-asn-ser-phe-(azagly)-leu-arg(me)-phe-nh2((aspserser)6-kp-10,并证明了(aspserser)6-kp-10具有较好的骨靶向作用,可以有效地抑制破骨细胞分化,治疗由于卵巢切除导致的骨质疏松。又如专利文献cn109251242a,公开了一种多肽,该多肽不仅与天然的白细胞介素-3功能相同或类似,并且皮肤渗透度非常优秀,可以通过抑制核因子κb受体活化因子配体-核因子κb受体活化因子信号路径,抑制核因子κb的活化及核转录,并抑制由核因子κb受体活化因子配体及炎性细胞因子诱导的抗酒石酸盐酸性磷酸酶、组织蛋白酶k或1型或2型肿瘤坏死因子受体的表达,从而以浓度依赖性的方式抑制破骨细胞的分化。但目前未见frattide或其订书肽对破骨细胞分化的作用的研究。
技术实现要素:
6.本发明的目的是为了解决现有技术中的问题,提供一种抑制破骨细胞分化的订书
肽、提供所述订书肽的用途和提供所述订书肽的制备方法。
7.为了达到上述目的,本发明的技术方案是:
8.一种订书肽,所述订书肽以ac-dphrllqqlvlsgnlikeavrrlhsr-nh2为肽链模板,其中3h、7q、19a和23
l
被s5替换并分别环合两次。
9.为实现上述第二个目的,本发明采取的技术方案是:
10.将所述订书肽应用于制备治疗骨质疏松症的药物中。
11.将所述订书肽在应用于制备抑制破骨细胞分化的试剂中。
12.为实现上述第三个目的,本发明采取的技术方案是:
13.所述订书肽的制备方法,包括以下步骤:
14.(1)在缩合剂的作用下分别使c端首个氨基酸与固相载体偶联;
15.(2)使用脱保护试剂脱去氨基酸上的fmoc保护基;
16.(3)在缩合剂作用下连接下一个氨基酸;
17.(4)重复进行脱保护-耦合操作,依照氨基酸序列合成肽链;其中,环合位点以s5分别替代i和i+4位氨基酸;
18.(5)在环合剂作用下使i和i+4位s5氨基酸发生烯烃复分解反应,环合肽链;
19.(6)重复进行脱保护-耦合操作,依照氨基酸序列合成肽链;其中,环合位点以s5分别替代i和i+4位氨基酸;
20.(7)最后一个氨基酸脱保护后乙酰化;
21.(8)在环合剂作用下使i和i+4位s5氨基酸发生烯烃复分解反应,二次环合肽链;
22.(9)使用切割试剂将肽链从载体上切下,纯化后得相应订书肽。
23.作为本发明的一个优选例,步骤(9)采用的纯化方法为反向高效液相色谱法,条件如下:色谱柱:ymc-pack ods-aq柱;流动相:流动相a为0.1%tfa/水,流动相b为0.1%tfa/乙腈;梯度洗脱程序:40%b洗脱0~5min,40%b~60%b、5~60min;流速为15ml/min,进样量为5ml,检测波长214nm。
24.作为本发明的另一优选例,步骤(1)中采用的缩合剂为dic-oxyme缩合体系,活化剂为dic,以nmp为溶剂。
25.更优选地,步骤(1)中氨基酸、oxyme、dic的比例为1:1:1:6(mol/mol/mol/ml)或1:0.9:0.9:6(mol/mol/mol/ml)。
26.作为本发明的另一优选例,步骤(1)中固相合成时,树脂的载样量为0.3mmol/g。
27.作为本发明的另一优选例,步骤(1)中偶联反应的温度为50~60℃,更优选为55℃;偶联反应的时间为20-30min,更优选为20min。
28.作为本发明的另一优选例,步骤(2)中,所述脱保护试剂为oxyme、哌啶及dmf的混合溶液,比例为71:2:4(m/v/v)。
29.作为本发明的另一优选例,步骤(2)中,脱fmoc保护是采用保护试剂作用5min后,再次作用5min;脱除fmoc基团的反应温度为20~30℃,更优选为25℃。
30.作为本发明的另一优选例,s5后所接的第一个氨基酸反应时间为1h并按相同条件重复反应一次再进行下一步操作。
31.作为本发明的另一优选例,步骤(7)中,使用的乙酰化试剂为吡啶与醋酸酐的混合液,投料比为1:1(v/v)。
32.作为本发明的另一优选例,步骤(7)所述乙酰化是采用树脂在乙酰化试剂中反应20min;反应温度为20~30℃,更优选为25℃。
33.作为本发明的另一优选例,步骤(5)、(8)中所述环合剂为grubbsⅰ试剂的二氯乙烷的溶液,投料比为树脂载样量:grubbsⅰ试剂:二氯乙烷=0.3:58:6(mmol/mg/ml)。
34.作为本发明的另一优选例,步骤(5)、(8)中所述环合是树脂在环合试剂中震荡两次,每次2h;反应温度为20~30℃,更优选为25℃。
35.作为本发明的另一优选例,步骤(9)中,所述切割试剂为tips、h2o和tfa的混合溶液,体积比为2.5:2.5:95;所述切割试剂与直链肽的体积质量比为1:10ml/mg。
36.作为本发明的另一优选例,步骤(9)中,切割的温度为20~30℃,更优选为25℃;切割的时间为4h。
37.本发明的有益效果是:
38.1、本技术发明人基于丰富的研究经验,认识到frattide可能具有抑制破骨细胞分化的作用,进一步设计并合成了双订书肽,实验证实了其可显著抑制破骨细胞分化,在骨质疏松症等相关疾病治疗中具有潜在的应用价值。
39.2、本发明以氨基树脂树脂为载体,按照模板frattide:ac-dphrllqqlvlsgnlikeavrrlhsr-nh2氨基酸序列在dic-oxime缩合体系中,通过fmoc固相合成法,合成得到肽链,其间在保留关键氨基酸残基的基础上,于特定位置以s5代替原有氨基酸,连接在树脂上直链肽在grubbsⅰ试剂的二氯乙烷溶液中进行烯烃复分解反应环合后从树脂上切下得到目标订书肽,所得化合物经纯化后,采用hplc及ms等光谱进行表征分析。该方法简便易行,所得订书肽纯度大于98%,产率高。
附图说明
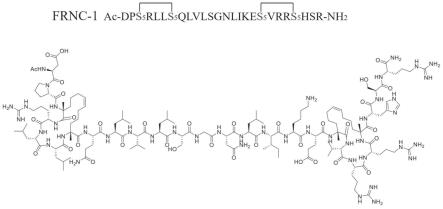
40.图1为本发明订书肽的示意图;
41.图2为本发明订书肽的合成路线图;
42.图3为纯化后的目标化合物高效液相色谱图和质谱图;
43.图4为实施例3中细胞实验的测试结果图;
44.图5为实施例3中动物实验(皮下注射给药)的测试结果图;
45.图6为实施例3中动物实验(口服给药)的测试结果图。
具体实施方式
46.为了使本技术领域的人员更好地理解本发明方案,下面结合附图和实施方式对本发明创造作进一步的详细说明。
47.本发明按照模板frattide:ac-dphrllqqlvlsgnlikeavrrlhsr-nh2(seq id no:1)氨基酸序列设计并合成1条订书肽。订书肽具体如图1所示。
48.以下实施例,涉及的缩略词解释如下:
49.fmoc:芴甲氧羰基
50.dcm:二氯甲烷
51.dce:二氯乙烷
52.dmf:n,n-二甲基甲酰胺
53.oxyme:ethyl cyanoglyoxylate-2-oxime
54.dic:n,n-二异丙基碳二亚胺
55.nmp:n-甲基吡咯烷酮
56.s5:2-amino-2-methylhept-6-enoic acid
57.tfa:三氟乙酸
58.tips:三异丙基硅烷
59.grubbsⅰ:苯基亚甲基双(三环已基磷)二氯化钌
60.涉及的实验材料来源如下:
61.氨基酸、氨基树脂购自上海吉尔生化有限公司;n-甲基吡咯烷酮(nmp)、n,n-二异丙基碳二亚胺(dic)、ethyl cyanoglyoxylate-2-oxime、三氟乙酸(tfa)、乙腈(色谱纯)购自北京百灵威科技有限公司;n,n-二甲基甲酰胺(dmf)、无水乙醚、二氯甲烷(dcm)、二氯乙烷(dce)、哌啶、苯酚均为分析纯,购自国药集团化学试剂北京有限公司。
62.实施例1.抑制破骨细胞分化的订书肽的制备
63.1、订书肽的合成
64.如图2所示:
65.(1)化合物1的制备
66.取氨基树脂500mg(载样量为0.30mmol
·
g-1
)加入到固相合成反应管中,用dcm浸泡20min使树脂充分溶胀,抽干待用。
67.加20%哌啶-dmf溶液(0.1m oxyme)至树脂完全淹没,25℃下振荡5min
×
2脱去树脂上的fmoc,依次用dcm、dmf洗涤树脂各3次。
68.(2)化合物2的制备
69.将序列中首个氨基酸(1mmol)、oxyme(142mg,1mmol)和dic(155.0μl,1mmol)混溶于6ml nmp中,加入到树脂中60℃下振荡20min(s5后的一个氨基酸反应1h,重复反应1次),依次用dcm、dmf洗涤树脂各3次。
70.(3)化合物3的制备
71.重复(1)、(2)步骤的做法,根据多肽序列依次将fmoc氨基酸(1mmol)、oxyme(142mg)和dic(155μl)混溶于6ml nmp,加入到树脂中,于60℃下振荡20min,重复脱保护
→
缩合
→
脱保护,在连接完前两个s5特殊氨基酸后,加入grubbsⅰ(58mg)试剂的二氯乙烷溶液(6ml),25℃下震荡反应两次,每次2h,反应完成后依次用dcm、dmf洗涤三次,完成第一次环合。
72.(4)化合物4的制备
73.重复脱保护
→
缩合
→
脱保护,最后一个氨基酸脱保护后,加入吡啶:乙酸酐(1:1)混合液6ml在25℃下震荡20min,依次用dcm、dmf、无水乙醚洗涤树脂各3次后,抽真空干燥树脂。
74.(5)化合物5的制备
75.待树脂完全干燥后,加入grubbsⅰ(58mg)试剂的二氯乙烷溶液(6ml),25℃下震荡反应两次,每次2h,完成二次环合,反应完成后依次用dcm、dmf、无水乙醚洗涤树脂各3次,抽真空干燥树脂。
76.(6)目标化合物的制备
77.将树脂洗净抽干,加入tips:h2o:tfa=2.5:2.5:95(v/v/v)15ml,常温下振荡4h,过滤,用少许tfa洗涤树脂,收集滤液。氩气鼓泡吹走多余tfa,倒入冰乙醚沉淀离心后,弃掉上清液,继续用冰乙醚反复洗涤离心三次,氩气吹干得订书肽粗品。
78.2、目标订书肽的纯化
79.将粗肽用乙腈和水溶解,通过制备型rp-hplc纯化。分离条件如下:
80.仪器:pre-hplc sd-1varian高效液相色谱仪;
81.色谱柱:ymc-pack ods-aq(250
×
20mml.d,s-5μm,12nm);
82.流动相:流动相a为体积分数为0.1%tfa的水溶液,流动相b为体积分数为0.1%tfa的乙腈溶液;
83.步骤与参数:40%b洗脱0~5min,40%b~60%b、5~60min;流速为15ml/min,进样量为5ml,检测波长214nm。
84.实施例2.产物的鉴别与结构分析
85.将上述步骤2所得产物通过hplc进行鉴别以及hr-q-tof-ms(高分辨基质辅助激光解析电离飞行时间质谱)进行结构分析,色谱流动相为乙腈和水。流动相a为体积分数为0.1%tfa的水溶液,流动相b为体积分数为0.1%tfa的乙腈溶液,梯度洗脱(0~5min,流动相b:5%;5-30min,流动相b:5%~90%);流速15.0ml
·
min-1
;检测波长214nm和254nm,进样量20μl。经测定与粗品主峰出峰时间一致,且本法所制备订书肽纯度》98%(图3)。通过hr-esi-ms质谱仪分析结果如图3所示。
86.实施例3.订书肽抑制破骨细胞活性实验
87.一、实验方法:
88.(一)细胞实验
89.1.细胞毒性试验,采用cck-8试验方法。将bmm细胞以5x 103个/孔的密度接种于96孔板,每孔100μl完全培养基。37℃,5%co2条件下培养24h,frt0和frnc-1按0.31,0.62,1.25,5,10和20μm浓度梯度给药。培养48h,每孔加入cck-8溶液10μl,37℃孵育1小时。使用酶标仪检测450nm处的吸光度值。
90.2.trap染色,将从股骨胫骨骨髓中分离的细胞,在加有m-csf和rankl诱导培养基(10%fbs、1%青霉素/链霉素、30ng/ml m-csf,50ng/ml rankl)中培养。然后将bmm接种到96孔板中,密度为每孔8x 103个细胞,换含有不同浓度的frt0和frnc-1(0,0.625、1.25和2.5μm)的诱导培养基,进行trap染色。
91.3.骨吸收的测定,在羟基磷灰石的骨板中每孔加入8x 103个破骨细胞,每孔培养基。分为无rankl,rankl(50ng/ml),rankl(50ng/ml)分别加1.25μm,2.5μm的frnc-1,rankl(50ng/ml)分别加1.25μm,2.5μm的frt0。
92.4.f-actin染色,细胞培养24h至密度达到50%,用37℃的pbs洗2次,使用溶于pbs的4%的多聚甲醛溶液固定10min,pbs洗2-3次,每次10min。丙酮脱水5min,pbs洗2-3次,每次10min。每孔加入配置好的tritc标记的鬼笔环肽工作液,室温孵育30min。pbs洗3次,每次5min。加入含有dapi的抗荧光淬灭剂。使用荧光显微镜进行观察,拍照。
93.5.蛋白质的提取以及westernblot,仍然进行3中的六组实验,对p-gsk表达变化进行测定。
94.bmm细胞被接种含有10%fbs、1%青霉素/链霉素培养基的6孔板中,密度为5x105
个细胞/孔。细胞培养24h至密度达到80%,在其中5孔加入rankl(50ng/ml)刺激细胞1小时。为了确定frnc-1对p-gsk的影响,在rankl基础上,分别加1.25μm,2.5μm的frnc-1和1.25μm,2.5μm的frt0共同孵育1天。使用裂解缓冲液从培养的细胞中提取总蛋白。裂解物以12,000g离心15分钟,收集上清液。蛋白质在10%sds-page凝胶上分离并转移到pvdf膜(bio-rad,hercules,ca,usa)。将膜在封闭液中室温封闭15分钟,然后与一抗在4℃下孵育过夜,再常温下与二抗孵育2小时。使用las-4000科学成像系统(fujiflm,东京,日本)可视化蛋白质条带。
95.(二)动物实验
96.动物实验共分两部分:皮下注射给药实验、口服给药实验
97.皮下注射给药实验
98.1.实验动物造模,7-8周龄的雌性c57bl/6小鼠,购自常州卡文斯实验动物有限公司。分组情况:将51只c57bl/6小鼠随机分6组,分别为:假手术组(6只)、去卵巢组(13只)、frnc-1干预组(分为10mg组7只、2mg组9只)、frt0对照肽组(分为10mg组7只、2mg组9只)。
99.去卵巢组:采用外科手术摘除小鼠双侧卵巢。
100.假手术组:除不切除小鼠卵巢外其余操作与去卵巢组相同。
101.frnc-1干预组:切除小鼠双侧卵巢后,给予小鼠隔日一次皮下注射10mg/2mg的frnc-1。
102.frt0对照肽组:切除小鼠双侧卵巢后,给予小鼠隔日一次皮下注射10mg/2mg的frt0。
103.2、样本处理
104.饲养8周后处死小鼠,取小鼠的双侧后肢股骨和内脏组织(心、肝脏、脾脏、肺、肾)。
105.(1)小鼠左后肢股骨使用4%多聚甲醛溶液进行固定、edta脱钙后,石蜡包埋切片(4mm),进行苏木精-伊红(he staining)染色,显微镜下观察小鼠股骨远端干骺端并拍照。
106.(2)小鼠右后肢股骨使用4%多聚甲醛溶液进行固定,将固定的小鼠股骨行micro-ct检查,采用skyscan 1176微型ct机对小鼠股骨远端进行扫描,构建小鼠股骨远端干骺端二维及三维图像,并使用ct机自带软件对股骨骨小梁数量(tb.n)、骨表面积和组织体积之比(bs/tv)、相对骨体积(bv/tv)进行分析,获得定量结果。
107.(3)将固定好的内脏组织,用石蜡包埋切片(4mm),进行苏木精-伊红(he staining)染色,显微镜下观察小鼠内脏并拍照。
108.口服给药实验
109.1.实验动物造模,7-8周龄的雌性c57bl/6小鼠,购自第二军医大学实验动物中心。分组情况:将43只c57bl/6小鼠随机分6组,分别为:假手术组、去卵巢组、frnc-1干预组、frt0对照肽组,干预组及对照肽组包含高剂量组(10mg)、低剂量组(2mg),其中control组为8只,其余组别均为7只。
110.去卵巢组:采用外科手术摘除小鼠双侧卵巢。
111.假手术组:除不切除小鼠卵巢外其余操作与去卵巢组相同。
112.frnc-1干预组:切除小鼠双侧卵巢后,给予小鼠隔日一次口服(灌胃)一次10mg/2mg的frnc-1。
113.frt0对照肽组:切除小鼠双侧卵巢后,给予小鼠隔日一次口服(灌胃)一次10mg/
2mg的frt0。
114.2、饲养8周后处死小鼠,取小鼠的双侧后肢股骨和内脏组织(心、肝脏、脾脏、肺、肾)。
115.(1)小鼠股骨使用多聚甲醛溶液进行固定、edta脱钙后,石蜡包埋切片(4mm),进行苏木精-伊红(he staining)染色,显微镜下观察小鼠股骨远端干骺端并拍照。
116.(2)小鼠股骨使用多聚甲醛溶液进行固定,将固定的小鼠股骨行micro-ct检查,采用skyscan 1176微型ct机对小鼠股骨远端行micro-ct扫描,构建小鼠股骨远端干骺端二维及三维图像,并使用ct机自带软件对股骨骨小梁数量、骨表面积和组织体积之比、相对骨体积、骨矿物密度、骨小梁连接数进行分析,获得定量结果。
117.(3)将固定好的内脏组织,用石蜡包埋切片(4mm),进行苏木精-伊红(he staining)染色,显微镜下观察小鼠内脏并拍照。
118.二、实验结果
119.图4a为cck-8实验的结果。结果显示,当frnc-1的浓度为小于等于2.5μm时,对细胞无毒性,所以后续实验最高选择2.5μm为最高干预剂量。图4b为trap染色的结果,结果表明frnc-1在1.25μm以及2.5μm情况下对于破骨细胞的形成具有明显的抑制作用,而其直肽链frt0作用并不明显。图4c为骨吸收情况,与无药物添加和frt0相比,frnc-1对于骨吸收具有明显的抑制作用,而且存在剂量依赖的关系。图4d为f-actin,dapi的免疫荧光图像结果,肌动蛋白环被认为是破骨细胞吸收过程中重要表征,可以发现在2.5μm frnc-1与无药物添加和frt0相比,能够明显减少肌动蛋白带的形成。图4e frnc-1显著抑制了gsk的磷酸化,而gsk是akt-gsk3β-nfatc1信号传导相关蛋白,随着frnc-1浓度增加,pgsk表达受到了抑制。
120.图5为小鼠frnc-1皮下注射给药实验结果。图5a为8周后小鼠股骨远端干骺端切片he染色。结果显示去卵巢组小鼠骨小梁数目较假手术组明显减少,骨小梁间距增大,表现为骨质疏松;给予frnc-1干预后,小鼠股骨远端干骺端骨小梁数目明显多于卵巢切除组。图5b骨小梁面积统计结果也显示去卵巢后骨质流失,给予frnc-1干预后,骨质流失缓解,而高剂量组好于低剂量组。图5c为8周后小鼠股骨远端micro-ct二维和三维结构。图片显示去卵巢组小鼠骨小梁数目较正常组明显减少,给予frnc-1干预后,小鼠股骨远端骨小梁数目明显多于卵巢切除组。同样的,给予frt0干预后,骨小梁数目也显示多于去卵巢组。图5d为对股骨远端使用计算机软件分析,统计骨小梁数量(tb.n)、骨表面积和组织体积之比(bs/tv)、相对骨体积或骨体积分数(bv/tv),发现frnc-1组小鼠显著优于去卵巢组和对照组,但不及假手术组,且差异具有统计学意义(p《0.05)。
121.图6为小鼠frnc-1为口服给药实验结果。图6a为8周后小鼠股骨远端干骺端切片he染色,图片显示去卵巢组小鼠骨小梁数目较假手术组组明显减少,骨小梁间距增大,表现为骨质疏松;给予frnc-1后,小鼠股骨远端干骺端骨小梁数目明显多于卵巢切除组;而对照肽frt0组小鼠股骨远端干骺端骨小梁数目相较于去卵巢组无明显增加。图6b骨小梁面积统计结果也显示去卵巢后骨质流失,给予frnc-1干预后,骨质流失缓解。图6c为8周后小鼠股骨远端micro-ct二维和三维结构。图片显示去卵巢组小鼠骨小梁数目较假手术组明显减少,给予frnc-1干预后,小鼠股骨远端骨小梁数目明显多于卵巢切除组和对照肽组(frt0组)。图6d为对股骨远端使用计算机软件分析,统计骨小梁数量(tb.n)、骨表面积和组织体积之比(bs/tv)、相对骨体积或骨体积分数(bv/tv),发现frnc-1组小鼠显著优于去卵巢组和对
照组,但不及假手术组,且差异具有统计学意义(p《0.05)。
122.三、结果讨论
123.女性绝经后骨质疏松症属于原发性骨质疏松症,与雌激素水平降低后破骨细胞分化增多、成骨减少有关。去卵巢小鼠模型模拟人类绝经,在去卵巢8周后表现出显著的骨质疏松表现,主要表现为骨小梁数量明显减少、骨小梁面积减少。目前研究表明,骨质疏松症的发生与骨骼的慢性炎症有关。慢性炎症使得破骨细胞过度激活,造成骨质显著丢失。
124.肌动蛋白环被认为是破骨细胞吸收过程中重要表征,其中akt-gsk3β-nfatc1信号传导相关蛋白gsk与破骨细胞的过度激活有密切关联。作为一种gsk激活的抑制剂,frnc-1显著减少了去卵巢后小鼠骨量的丢失,表现为骨小梁数目、骨表面积和组织体积之比和相对骨体积或骨体积分数的增加。
125.以上实施例表明,本发明成功制备得到基于frattide的双订书肽,且证明了该订书肽可以显著抑制破骨细胞的分化,具有良好的应用前景。
126.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1