一种用于检测人APOE基因分型的引物探针组及其应用的制作方法
一种用于检测人apoe基因分型的引物探针组及其应用
技术领域
1.本发明涉及基因多态性检测技术领域,具体涉及一种用于检测人apoe基因分型的引物探针组及其应用。
背景技术:
2.高脂血症是临床最常见的心血管疾病之一,每年发病率呈逐年上升趋势,安全、有效地降低或控制血脂水平是临床高脂血症治疗所关注的重点。目前,临床针对高脂血症的治疗以降脂药摄入为主,饮食干预为辅。他汀类药物,作为羟甲基戊二酸单酰辅酶a还原酶(hmg-coa)抑制剂,是临床使用最广泛的降脂药,是治疗心脑血管疾病的基础用药。临床应用过程中观察到不同患者对他汀类药物反应不同,有些患者使用他汀类药物会有不同程度的副作用,如横纹肌溶解、肌肉疼痛等。
3.研究发现,相关基因的多态性决定了他汀类药物降血脂的疗效和副作用产生的几率,其中apoe基因多态性与汀类药物的疗效有关。人类aope基因定位于19号染色体上,作为apoe受体和ldl-c受体的配体,可通过多种途径参脂质代谢调节,对脂蛋白的代谢调节起重要作用,是影响血浆血脂水平的重要内在因素。apoe基因主要有两种单核苷酸多态性,526c》t和388t》c,可以形成3种单倍型分别是e3(388t-526c)、e2(388t-526t)、e4(388c-526c),可形成6个apoe基因型(e2/e2,e2/e3,e2/e4,e3/e3,e3/e4和e4/e4),并以三种蛋白形式表现:e2(e2/e2,e2/e3)、e3(e2/e4,e3/e3)、e4(e3/e4和e4/e4)。文献报道,apoe4携带者患冠心病的风险要高40%,并且他汀类药物对apoe4携带者疗效往往不佳或无疗效。
4.目前常用的检测基因多态性的方法有dna直接测序法、限制性片段长度多态性分析法(pcr-pflp)、高分辨率溶解曲线(hrm)、基因芯片、液相芯片法、荧光定量pcr法等。测序技术是公认的检测基因突变的金标准,但其设备成本高、检测周期长、检测通量低、检测灵敏度低、对实验人员的技术操作要求高、结果判定步骤繁琐等原因,较难形成商业化的诊断产品;限制性片段长度多态性分析法检测灵敏度同样不高、操作步骤繁琐,检测的结果仍需要进行一代测序法的再次验证,尤其当样本量多时极易造成pcr产物的交叉污染且容易出现酶切不充分或酶切过度而出现假阴性或假阳性结果,因此也无法应用到临床上。芯片检测因其检测结果的准确性和重复性较差,实验周期长等缺点,也不适于开发临床检测试剂盒。荧光定量pcr的检测方法拥有成本低、灵敏度高、特异性强,结果的重复性好等优点,是检测snp的非常好的一种检测手段,但是常规的taqman探针法探针订购成本太高,多个位点同时检测时很难保证所有引物探针在同一扩增条件下均达到非常好的扩增效果。连接酶链反应(ldr)是近年来开发出的一种基于高温连接酶检测基因分型的新方法。高温连接酶一旦检测到dna与互补的2条寡聚核苷酸接头对应处存在着基因点突变类型的碱基错配,则连接反应就不能进行,反之则可以进行连接反应。cristian等人建立pcr-ldr-qpcr方法检测癌症突变相关位点。这种检测方法具有高灵敏度、特异性强等优点。但该过程较为繁琐。另外,临床常用的pcr-荧光探针法检测限为200copies/μl,且对样本要求较高,因此,如何解决检测apoe基因分型过程中存在的问题,推行一种灵敏度高、实验操作简单的检测方法,成
rpa-正向引物(10μm)、apoe 388-rpa-反向引物(10μm)各2μl,所述模板为提取的患者dna。
35.在一些实施方案中,步骤(1)rpa反应程序为:添加2.5μl浓度为280mm的乙酸镁启动反应,并在37℃孵育30min。
36.在一些实施方案中,步骤(2)ldr反应体系包含以下组分:apoe 388-ldr-t(30nm)或apoe 388-ldr-c(30nm)各1μl,apoe 388-ldr-m(30nm)1μl,10
×
taq dna ligase buffer 1μl,taq dna ligase(30u/μl)0.25μl,rpa扩增产物1μl,超纯水5.75μl,接着在60℃连接5min。
37.在一些实施方案中,步骤(2)ldr反应程序为:混合反应物瞬时离心后,先在95℃变性3min,接着在60℃连接5min。
38.在一些实施方案中,步骤(3)qpcr反应体系包括以下组分,monamp
tm
chemohs qpcr mix 10μl,qpcr-正向引物0.4μl,qpcr-反向引物0.4μl,模板1μl,超纯水8.2μl。
39.在一些实施方案中,步骤(3)qpcr反应程序为:在95℃预变性10min,在95℃预变性10s,在60℃下退火和延伸30s,40个循环。
40.本发明提供一种用于检测人apoe 526位点基因分型的方法,包括以下步骤:
41.(1)利用扩增引物apoe 526-rpa-正向引物和apoe 526-rpa-反向引物,使用rpa反应体系扩增apoe 526位点基因片段;
42.(2)利用探针apoe 526-ldr-t、apoe 526-ldr-c和apoe 526-ldr-m,使用ldr反应体系对步骤(1)扩增产物进行处理;
43.(3)利用qpcr扩增引物qpcr-正向引物和qpcr-反向引物,使用qpcr反应体系对步骤(2)的反应产物判别基因分型结果。
44.在一些实施方案中,步骤(1)rpa反应体系中包含以下组分,2μl模板,apoe 526-rpa-正向引物(10μm)、apoe 526-rpa-反向引物(10μm)各2μl,所述模板为提取的患者dna。
45.在一些实施方案中,步骤(1)rpa反应程序为:添加2.5μl浓度为280mm的乙酸镁启动反应,并在37℃孵育30min。
46.在一些实施方案中,步骤(2)ldr反应体系包含以下组分,apoe 526-ldr-c(30nm)或apoe 526-ldr-t(30nm)1μl,apoe 526-ldr-m(30nm)1μl,10
×
taq dna ligase buffer 1μl,taq dna ligase(30u/μl)0.25μl,rpa扩增产物1μl。
47.一些实施方案中,步骤(2)ldr反应程序为:混合反应物瞬时离心后,先在95℃变性3min,接着在60℃连接5min。
48.在一些实施方案中,步骤(3)qpcr反应体系包括以下组分,monamp
tm
chemohs qpcr mix 10μl,qpcr-正向引物0.4μl,qpcr-反向引物0.4μl,模板1μl,超纯水8.2μl。
49.在一些实施方案中,步骤(3)qpcr反应程序为:在95℃预变性10min,在95℃预变性10s,在60℃下退火和延伸30s,40个循环。
50.本发明的具体原理是:利用rpa反应对样品dna进行扩增,利用ldr反应对特定dna序列进行连接,从而产生不同dna间量的差异,利用qpcr反应进一步放大该量的差异并进行定量定性分析,从而得出基因分型结论。
51.本发明的有益效果:本发明提供了检测人apoe基因分型的引物组及检测方法。提供的引物组可对apoe基因388t》c、apoe 526c》t位点的多态性进行检测,确定apoe基因进分型,,不涉及昂贵的ngs设备,整个过程可以在临床实验室中常见的仪器上进行。此外,该方
法具有高灵敏度、特异性强等优点。
52.相关定义
53.rpa:重组酶聚合酶等温核酸扩增技术
54.ldr:连接酶技术
55.qpcr:实时荧光定量pcr
附图说明
56.图1 rpa-ldr-qpcr方法的可行性,对apoe 526c》t三种不同基因型进行分型检测,其中cc为野生纯合型;tt为突变型,ct为突变纯合型。
57.图2 rpa-ldr-qpcr方法的可行性对apoe 388t》c三种不同基因型进行分型检测,其中tt为野生纯合型;cc为突变型,tc为突变纯合型。
58.图3 rpa-ldr-qpcr对apoe 526c》t三种不同基因型进行分型检测灵敏度
59.图4 rpa-ldr-qpcr对apoe 388t》c三种不同基因型进行分型检测灵敏度
具体实施方案
60.下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好的理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
61.样本来源
62.临床样本基因组dna,由江苏省中医院医院提供,-20℃保存。
63.试剂和仪器
64.twistamp basic kit购自英国twistdx inc公司;pce2载体购自诺唯赞;taq dna连接酶购自生工生物工程(上海)股份有限公司;monamp
tm
green qpcr mix、taq-hs pcr master mix购自莫纳生物科技有限公司;lightcycler480ii实时荧光定量pcr仪购入罗氏。
65.引物与探针的设计
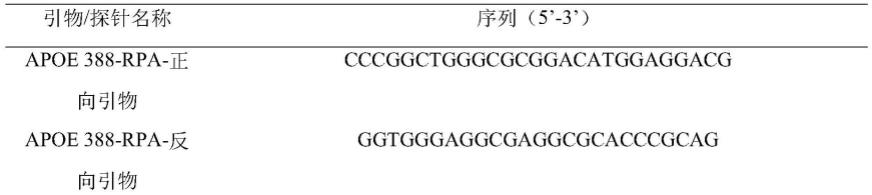
66.根据snp位点的序列利用geneious软件设计引物和探针,引物和探针由通用生物系统(安徽)有限公司合成,序列见表1。
67.表1引物和探针序列
68.mix 10μl,qpcr-正向引物0.4μl,qpcr-反向引物0.4μl,超纯水8.2μl,轻微涡旋混匀后短暂离心,即刻将反应管放入罗氏lightcycler480ii实时荧光定量pcr仪按照qpcr两步法进行反应。反应程序为:预变性95℃10min;变性95℃10s,退火和延伸60℃30s,40个循环,实时检测荧光强度。
79.实施例3 apoe 526位点的基因分型检测
80.rpa反应体系
81.rpa扩增部分根据rpa核酸扩增试剂盒说明书进行,向装有反应干粉的检测单元管中加入41.5μl a buffer、apoe 526-rpa-正向引物(10μm)、apoe 526-rpa-反向引物(10μm)各2μl,模板dna 2μl。接着,向检测单元管盖上加入2.5μl乙酸镁(280mm)启动反应,混匀离心后在37℃下孵育30min。a buffer为杭州众测生物科技有限公司的该试剂盒提供。该反应的模板为提取的患者dna。
82.ldr反应体系
83.连接酶检测反应技术,采用taq dna链接酶,反应总体系为10μl。在两个200μl管子中按顺序分别加入超纯水5.75μl,探针apoe 526-ldr-m(30nm)1μl,10
×
taq dna ligase buffer 1μl,taq dna ligase(40u/μl)0.25μl,rpa扩增产物1μl;然后,一管中加入探针apoe 526-ldr-c(30nm)1μl,另一管中加入探针apoe 526-ldr-t(30nm)1μl。混合反应物瞬时离心后,先在95℃变性3min后,接着在60℃连接5min。
84.qpcr反应体系
85.qpcr反应根据莫纳生物monamp
tm
chemohs qpcr mix的说明书进行,总体系为20μl。在八连排管子中依次加入下列各组分:以ldr反应产物1μl为模板,monamp
tm
chemohs qpcr mix 10μl,qpcr-正向引物0.4μl,qpcr-反向引物0.4μl,超纯水8.2μl,轻微涡旋混匀后短暂离心,即刻将反应管放入罗氏lightcycler480ii实时荧光定量pcr仪按照qpcr两步法进行反应。反应程序为:预变性95℃10min;变性95℃10s,退火和延伸60℃30s,40个循环,实时检测荧光强度。
86.实施例4 rpa-ldr-qpcr方法验证
87.为了评估开发区分snp方法的可行性,将构建的野生型和突变型标准质粒作为靶标模板。apoe 388t》c位点,野生型质粒代表野生纯合型模板(tt型),突变型质粒代表突变纯合型模板(cc型),野生型质粒与突变型质粒1:1混合代表突变杂合型模板(tc型)。每种模版分为两管,同时向一管加入野生型探针即apoe 388-ldr-a,另一管加入突变型探针即apoe388-ldr-g。按照实施例1-3的方法进行反应。结果显示,野生纯合型模板与完全匹配的野生型探针率先出现荧光信号,与不匹配的突变型探针后出现荧光信号,突变纯合型模板则出现相反情况,突变杂合型模板则是两种类型探针同时出现荧光信号(图2)。结果表明,建立的方法可对apoe基因388t》c进行分型。apoe基因526c》t也观察到相似的情况(图1)。
88.实施例5 rpa-ldr-qpcr方法的灵敏度
89.由于临床样本中目标序列的含量较低,需评价所建立检测方法的灵敏度。应用建立的方法条件,通过检测10倍连续稀释102~1
×
100copies/μl的含有apoe 388t》c、apoe 526c》t基因序列的构建3种类型质粒来评估方法的敏感性。结果表明(图3和图4),建立的rpa-ldr-qpcr方法最低检测限为10copies/μl。
90.实施例6应用rpa-ldr-qpcr检测临床样本
91.我们对江苏省中医院提供的9份临床样本进行了检测,并与医院常用的pcr-荧光探针法进行比较,并进行三次独立重复性实验,结果显示,这两种方法的实际检测结果是完全一致的(表2)。
92.表2 9份临床样本进行pcr-荧光探针和rpa-ldr-qpcr方法的检测结果
93.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1