一种经典树突状细胞亚群的体外诱导方法及其应用
本发明涉及细胞治疗、肿瘤防治、自身免疫病防治和疫苗开发领域,尤其涉及一种经典树突状细胞亚群的体外诱导方法及其应用。
背景技术:
1、树突状细胞(dendritic cell,dc)作为一类重要的抗原呈递细胞,在机体抗肿瘤及自身免疫病发病过程中起重要作用。dc分为不同的亚群,包括单核来源的树突状细胞(monocyte derived dc,modc),浆细胞样树突状细胞(plasmacytoid dc,pdcs)以及经典树突状细胞(conventional dc,cdc)。经典树突状细胞又可以分为cdc1和cdc2。不同亚群有不同的来源及不同的功能。modc来源于外周血的单个核细胞,而pdc和cdc则由骨髓和脐血的dc前体细胞分化而来。modc和cdc2功能类似,可以高效呈递抗原给t细胞,同时产生大量的il-23等促炎因子,诱导th17免疫细胞应答。cdc1则具有独特的交叉呈递能力,同时可以产生il-12诱导th1细胞免疫应答。modc、cdc1以及cdc2在机体抗肿瘤免疫和自身免疫疾病中均起着重要作用。
2、鉴于各种dc亚群的关键作用,dc也被开发用于治疗各种疾病,特别是dc疫苗被用于抗肿瘤的临床试验。截止目前已有dc疫苗“provenge”于2010年被美国fda获批用于抗肿瘤治疗。截止2020年3月,在美国国立卫生研究院管理的“clinical trail”临床数据登记平台显示,以“dendritic cells”为关键词共有1071项dc细胞治疗临床试验登记,包括56项临床ⅲ期产品试验登记。在适应症方面,dc细胞治疗的主要适应症为黑色素瘤、肾癌、乳腺癌,白血病和hiv感染等。因此,这些均显示了dc在抗肿瘤和自身免疫病方向的巨大应用前景。
3、目前绝大部分的临床试验dc来源均是外周血pbmc来源的单核细胞。病人自体来源或者异体来源的外周单个核细胞pbmc或者经过分选的外周血单核细胞monocyte,经过gm-csf细胞因子等的诱导分化,再经过抗原或天然免疫刺激剂刺激成熟而得到modc。也有很少部分临床实验使用诱导多能干细胞ipsc来获得modc。这些活化的modc被回输到病人体内达到增强免疫、抗肿瘤的目的。然而,越来越多的研究表明,机体抗肿瘤免疫中更为关键的dc亚群是cdc,包括cdc1和cdc2。与modc相比,cdc具有更强的肿瘤迁移能力、更强的抗原呈递能力和特殊的交叉呈递功能。这些功能对于能更有效的克服肿瘤免疫耐受环境、激活t细胞免疫至关重要。虽然cdc功能更为强大,但是由于缺乏有效的体外诱导方法,难以高效大量获得cdc用于临床研究。cdc只占到外周血pbmc的0.2-0.4%,比例极低。而目前已报道的一些体外诱导方法效率非常低下。从脐血干细胞可以达到最好的诱导效率。而最高的诱导效率也仅有3-5%左右,还无法大量获得。一份100ml脐血仅能得到104次方级别的cdc细胞亚群。考虑到dc疫苗治疗至少要达到5-10×106/dose的细胞数量,现有的技术条件限制了cdc这一强大细胞工具的使用。
4、现有技术存在的问题为体外无法大量获得人的原代经典树突状细胞亚群。因此,本领域的技术人员致力于开发一种体外方便、高效、低成本获得大量的经典树突状亚群并应于于经典树突状细胞肿瘤疫苗和药物。
技术实现思路
1、有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是开发一种体外方便、高效、低成本获得大量的经典树突状亚群并应于于经典树突状细胞肿瘤疫苗和药物。
2、为实现上述目的,本发明提供了一种经典树突状细胞亚群的体外诱导方法,包括以下步骤:
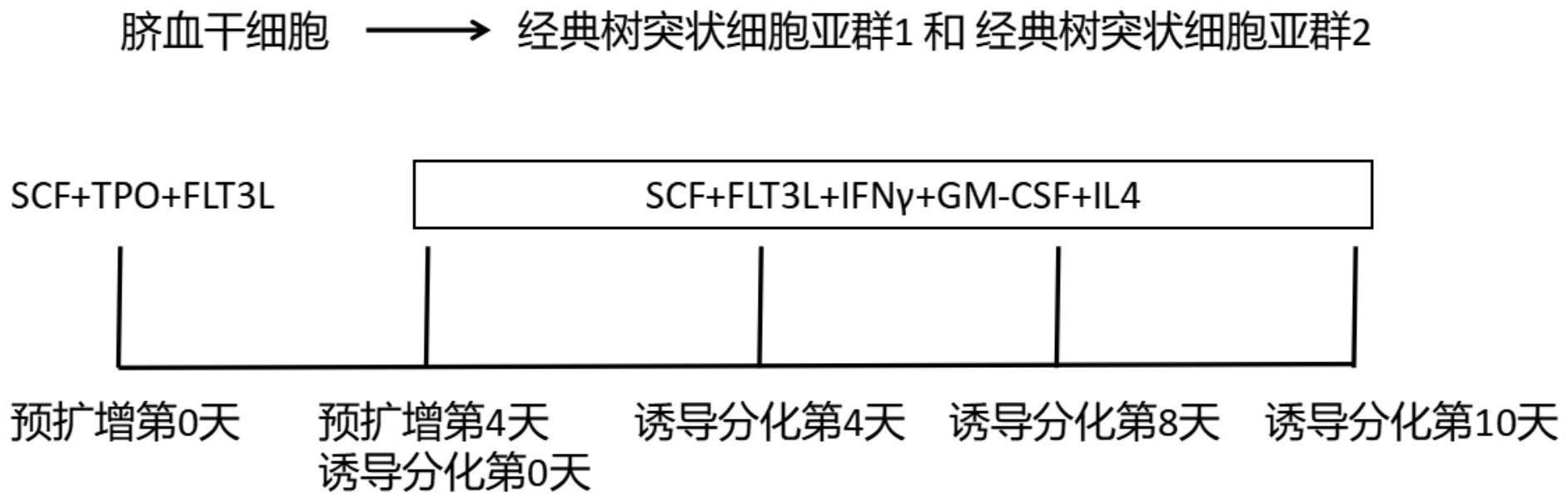
3、步骤1、获取脐血干细胞,对脐带血进行密度梯度离心获得单个核细胞,随后分离得到cd34+的脐血干细胞;
4、步骤2、将步骤1得到的cd34+的脐血干细胞预扩增:将干细胞以低密度铺板,以基础培养基,并添加青霉素/链霉素的第一细胞因子组合,培养4天后收集细胞,得到扩增后的脐血干细胞;
5、步骤3、将步骤2得到的扩增后的脐血干细胞诱导经典树突状细胞:以低密度铺板,以基础培养基,并添加青霉素/链霉素的第二细胞因子组合,最终在分化第10天收集并冻存经典树突状细胞;
6、步骤4、对步骤3得到的经典树突状细胞利用流式抗体检测分化情况,并对其中的cdc1和cdc2亚群进行流式分选。
7、进一步地,步骤1中还包括使用淋巴细胞分离液对脐带血进行密度梯度离心。
8、进一步地,步骤1中还包括使用cd34阳选kit(miltenyi biotec)分离得到cd34+的脐血干细胞。
9、进一步地,步骤2中第一细胞因子组合为人的scf、flt3l和tpo细胞因子,人的scf、flt3l和tpo细胞因子在第一细胞因子组合中的浓度分别为100ng/ml。
10、进一步地,低密度为1x105/ml,基础培养基为stemcell technologies公司的sfemii。
11、进一步地,步骤3中第二细胞因子组合为人的scf细胞因子、人的flt3l细胞因子、人的gm-csf细胞因子、人的il4细胞因子;第二细胞因子组合还可以添加5ng/ml人的ifnγ细胞因子。
12、进一步地,步骤3中第二细胞因子组合中人的scf细胞因子的浓度为100ng/ml、人的flt3l细胞因子的浓度为100ng/ml、人的gm-csf细胞因子的浓度为2.5ng/ml、人的il4细胞因子的浓度为2.5ng/ml。
13、进一步地,步骤4中流式抗体包括由cd14,cd16,cd3,cd19,nk1.1,cd20抗体混合而成的标识谱系分化的抗体组合,hla-dr,cd141,cd1c,cd11c,xcr1。
14、本发明还提供了一种经典树突状细胞亚群的体外诱导方法在制备经典树突状细胞肿瘤疫苗中的应用。
15、本发明还提供了一种经典树突状细胞亚群的体外诱导方法在制备经典树突状细胞抗肿瘤药物中的应用。
16、进一步地,步骤2中低扩增密度有利于干细胞干性的维持。
17、进一步地,步骤2中4天的预扩增可以在不损失干细胞活性的前提下,获得最大量的前体细胞,时间过短则扩增不够,时间过长则影响后续的分化诱导。
18、进一步地,步骤3中低密度培养可以保持dc前体在分化的同时还能继续扩增,有利于获得最大量的经典树突状细胞亚群。
19、进一步地,步骤3中scf+flt3l+gmcsf+il4+ifnγ的细胞因子优化组合,可以最大限度诱导调控cdc分化的关键转录因子pu.1和irf8的表达,从而高效得到cdc1和cdc2细胞亚群。
20、进一步地,步骤3中gm-csf和il4细胞因子组合可以诱导人的脐血干细胞分化到cdc1和cdc2亚群,得到的cdc1细胞亚群为hla-dr+lineage-cd141+xcr1+;得到的cdc2细胞亚群为hla-dr+lineage-cd141-cd1c+,而添加ifnγ细胞因子,则可以进一步大幅度提高cdc1和cdc2的比例。
21、在本发明的较佳实施方式中,详细说明了经典树突状细胞的诱导过程。
22、本发明有益的技术效果如下:
23、本发明涉及一种高效体外诱导人的cdc亚群的方法。利用一人份的脐血干细胞(100ml),在体外诱导可以很容易达到108级别的cdc细胞亚群,达到了现有报道的最高诱导效率的10000倍。通过流式细胞技术和功能检测证实cdc功能的特异性。因此,本发明为cdc亚群在抗肿瘤和自身免疫病等方面的应用铺平了道路。
24、以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
- 还没有人留言评论。精彩留言会获得点赞!