一种7α-羟基类固醇脱氢酶的制备方法及其催化转化应用
一种7
α-羟基类固醇脱氢酶的制备方法及其催化转化应用
技术领域
1.本发明涉及一种7α-羟基类固醇脱氢酶的制备方法及其催化转化应用,属于生物催化转化领域。
背景技术:
2.根据来源可以将胆汁酸分为两大类:初级胆汁酸和次级胆汁酸。在肝脏中,直接以胆固醇合成的胆汁酸如鹅去氧胆酸(cdca)、牛磺鹅去氧胆酸(tcdca)、胆酸(ca)、牛磺胆酸(tca)等均属于初级胆汁酸。初级胆汁酸分泌到肠道,由肠道细菌酶催化,经过7α脱羟作用形成次级胆汁酸,包括熊去氧胆酸(udca)、石胆酸(lca)、牛磺石胆酸(tlca)等。哺乳动物肠道微生物可调节次级胆汁酸的合成,进一步影响机体内的信号传递,从而满足正常机体运作。
3.熊去氧胆酸(ursodeoxycholicacid)简称udca,商品名优思弗,临床上用于治疗胆结石、脂肪肝及各型肝炎等常见疾病,是美国fda唯一批准用于原发性胆汁性肝硬化(primary biliary cirrhosis,pbc)的药物。udca一般来源于熊胆或使用化学方法合成。基于动物保护,活熊取胆来源受到严格限制,环境友好型生物转化udca的需求愈来愈迫切。
4.在鹅去氧胆酸(cdca)经7酮-石胆酸(7k-lca)再到熊去氧胆酸(udca)的生物转化途径中,羟基类固醇脱氢酶起到十分关键的作用。7α-羟基类固醇脱氢酶(7α-hsdh,分子量为26kda)和7β-羟基类固醇脱氢酶(7β-hsdh,分子量为30kda)是一种氧化/还原型辅酶(nadh/nadph)依赖性短链脱氢酶,在nad
+
/nadp
+
的作用下,cdca的7位羟基氧化成酮羰基,形成7k-lca;在nadh/nadph的作用下,7位酮羰基还原成β-羟基,形成udca,实现udca的两步转化。本发明主要针对于环境友好型酶法转化7k-lca进行探究,相较于全细胞转化等其他方法,酶法转化在提高了转化率的同时可以大大缩短转化时间,进一步为udca的高效转化及利用提供可能。
技术实现要素:
5.基于上述现有技术所存在的不足之处,本发明提供一种7α-羟基类固醇脱氢酶(7α-hsdh)的制备方法,所得7α-hsdh可在保证转化率的同时短时间内催化cdca或者cdca包合物转化为7-酮石胆酸7k-lca,实现了两步酶法转化udca中的关键一步。
6.本发明为实现目的,采用如下技术方案:
7.一种7α-羟基类固醇脱氢酶的制备方法,其特点在于:通过对含7α-羟基类固醇脱氢酶的菌种进行超声破碎,从而获得,具体包括如下步骤:
8.(1)配制ph 7.0-11.0的磷酸盐缓冲液;
9.(2)配制600ml营养肉汤培养基,接种含7α-羟基类固醇脱氢酶的菌种后,置于30℃、120rpm的摇床中培养;
10.(3)将步骤(2)中生长至对数期的菌液在0-20℃、9000-12000rpm转速下离心5-15min,去除上清液,将菌体用无菌水进行重悬、离心洗涤2-3次;
11.(4)将步骤(3)所得菌体用ph 7.0-11.0的磷酸盐缓冲液重悬,0-4℃冰浴下在超声波细胞破碎仪中进行超声破碎,获得破碎液;
12.(5)将步骤(4)所得破碎液在0-20℃、9000-12000rpm转速下离心3-10min,所得上清液即为7α-羟基类固醇脱氢酶的粗酶液。
13.进一步地,所述含7α-羟基类固醇脱氢酶的菌种为瘤胃球菌、嗜麦芽黄单胞菌、梭状芽胞杆菌、大肠杆菌、铜绿假单胞菌和双歧杆菌中的至少一种。
14.进一步地,步骤(4)中,超声波细胞破碎仪工作2s停2s,共超声35-60min,直至菌液澄清。
15.进一步地,所述磷酸盐缓冲液的浓度为0.01mol/l。
16.本发明所制得的7α-羟基类固醇脱氢酶可用于催化cdca或者cdca包合物转化为7-酮石胆酸(7k-lca),具体方法为:在所述7α-羟基类固醇脱氢酶的粗酶液中加入甲醇,然后投入作为底物的cdca或者cdca包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:cdca在转化体系中的浓度为0.5mg/ml-3mg/ml,甲醇在转化体系中的体积浓度为10-35vol%,nad
+
在转化体系中的浓度为0.5-2.5mg/ml;将转化体系置于25-55℃、120rpm摇床中进行转化,转化时间10-60h,转化结束后水浴煮沸终止反应。
17.本发明的有益效果体现在:
18.本发明利用野生菌制得7α-羟基类固醇脱氢酶,并利用该酶催化cdca或者cdca包合物转化为7k-lca,相较于其它转化方法可以大大缩短转化时间、提高转化效率,且该步反应是鹅去氧胆酸到熊去氧胆酸两步酶法转化中的关键步骤,为酶法两步转化熊去氧胆酸奠定了基础。本发明的转化方法安全易操作无污染,是一种环境友好型转化方式。
附图说明
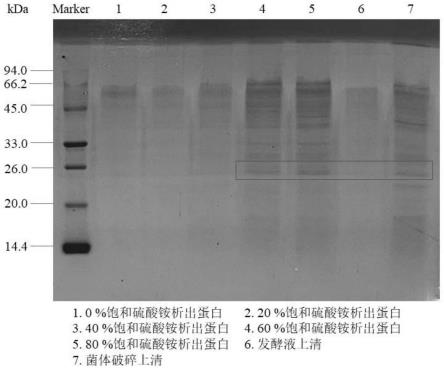
19.图1为实施例1利用嗜麦芽黄单胞菌制备所得粗酶液的sds-page图,从图1可以看出,7α-羟基类固醇脱氢酶的分子量为26kda。
20.图2为nadh的标准曲线图。
21.图3为实施例1中温度对酶活力的影响。
22.图4为实施例1中ph值对酶活力的影响。
23.图5为实施例1中不同有机试剂对酶活力的影响。
24.图6为实施例1中不同浓度甲醇对酶活力的影响。
25.图7为实施例1中三个标准品udca、7k-lca、cdca的高效液相色谱图。从图7可以看出,三者出峰时间分别为5.425min、6.886min、9.615min。
26.图8为实施例1利用嗜麦芽黄单胞菌中分离出的粗酶进行生物转化所得产物的高效液相色谱图,从图8可以看出,在保留时间6.886min时有出峰,可判定为转化产物7k-lca。
具体实施方式
27.为了能更全面的更清楚地理解本发明的技术内容,结合附图举以下实施例进行详细说明。
28.下述实施例所用cdca/β-环糊精包合物的制备方法为:
29.按照cdca与β-cd的摩尔比为1:1,准确称取1.178g的cdca,溶解于无水乙醇,待用。
再准确称取3.405g的β-cd溶解于水中,形成β-cd饱和水溶液。边搅拌边滴加上述配制的cdca的乙醇溶液,无水乙醇与水体积比为1∶3,45℃水浴搅拌4h。加热除去无水乙醇,0.45μm滤头过膜,除去未包合的cdca,滤液即为cdca/β-cd包合物水溶液,冷冻后真空干燥。
30.实施例1
31.本实例按照如下步骤进行制备和转化:
32.(1)配制ph 7.0的磷酸盐缓冲液;
33.(2)配制600ml营养肉汤培养基,接种嗜麦芽黄单胞菌后,置于30℃、120rpm的摇床中培养;
34.(3)将步骤(2)中生长至对数期的菌液在4℃、9000rpm转速下离心10min,去除上清液,将菌体用无菌水进行重悬、离心洗涤3次;
35.(4)将步骤(3)所得菌体用ph 7.0的磷酸盐缓冲液重悬,0℃冰浴下在超声波细胞破碎仪中进行超声破碎,获得破碎液;
36.(5)将步骤(4)所得破碎液在4℃、10000rpm转速下离心10min,所得上清液即为7α-羟基类固醇脱氢酶的粗酶液。
37.(6)将步骤(5)所得粗酶液进行sds-page电泳,确定7α-羟基类固醇脱氢酶的分子量为26kda。
38.(7)在步骤(5)所得粗酶液中投入作为底物的cdca/β-环糊精包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:cdca在转化体系中的浓度为1mg/ml,nad
+
在转化体系中的浓度为1mg/ml;将转化体系置于25-55℃、120rpm摇床中进行转化。检测结果如图3所示,利用图2计算nadh的变化量,测得酶活,由图3可以看出7α-羟基类固醇脱氢酶的最适温度为35℃和40℃。
39.(8)将制备粗酶液时所用磷酸盐缓冲液ph值设定为7.0-11.0,投入作为底物的cdca/β-环糊精包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:cdca在转化体系中的浓度为1mg/ml,nad
+
在转化体系中的浓度为1mg/ml;将转化体系置于30℃、120rpm摇床中进行转化。检测结果如图4所示,利用图2计算nadh的变化量,测得酶活,由图4可以看出7α-羟基类固醇脱氢酶的最适ph值为10.0。
40.(9)将制备粗酶液时所用磷酸盐缓冲液ph值设定为7.0,加入二甲基亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、甲醇、冰乙酸和乙腈,然后投入作为底物的cdca/β-环糊精包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:cdca在转化体系中的浓度为1mg/ml,有机试剂在转化体系中的体积浓度为30vol%,nad
+
在转化体系中的浓度为1mg/ml;将转化体系置于30℃、120rpm摇床中进行转化。检测结果如图5所示,由图可以看出甲醇对7α-羟基类固醇脱氢酶的酶活具有提升作用。
41.(10)将制备粗酶液时所用磷酸盐缓冲液ph值设为7.0,加入不同体积浓度的甲醇,然后投入作为底物的cdca包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:cdca在转化体系中的浓度为1mg/ml,有机试剂在转化体系中体积浓度为10-35vol%,nad
+
在转化体系中的浓度为1mg/ml;将转化体系置于30℃、120rpm摇床中进行转化。检测结果如图6所示,由图可以看出体积浓度为30vol%的甲醇对7α-羟基类固醇脱氢酶的酶活具有显著提升作用。
42.(11)将制备粗酶液时所用磷酸盐缓冲液ph值设为10.0,加入甲醇,投入作为底物
的cdca/β-环糊精包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:甲醇在转化体系中的体积浓度为30vol%,cdca在转化体系中的浓度为1mg/ml,nad
+
在转化体系中的浓度为1mg/ml;将转化体系置于35℃、120rpm摇床中进行转化,转化时间10h,转化结束后水浴煮沸终止反应。
43.(12)将步骤(11)所得转化液离心后上清过0.45μm滤膜,进行hplc-elsd测定,流动相为:乙腈/甲酸水溶液(ph 3.0)=60/40,柱温30℃,流速1ml/min。检测结果如图8所示,对比图7中三个标准品udca、7k-lca、cdca的高效液相色谱图,确定7k-lca的出峰时间,经计算转化产物7k-lca的率为30.37%
±
0.07。
44.实施例2
45.本实例按照如下步骤进行制备和转化:
46.(1)配制ph 10.0的磷酸盐缓冲液;
47.(2)配制600ml营养肉汤培养基,接种梭状芽胞杆菌后,置于30℃、120rpm的摇床中培养;
48.(3)将步骤(2)中生长至对数期的菌液在0℃、12000rpm转速下离心15min,去除上清液,将菌体用无菌水进行重悬、离心洗涤3次;
49.(4)将步骤(3)所得菌体用ph 10.0的磷酸盐缓冲液重悬,0℃冰浴下在超声波细胞破碎仪中进行超声破碎,获得破碎液;
50.(5)将步骤(4)所得破碎液在5℃、9000rpm转速下离心10min,所得上清液即为7α-羟基类固醇脱氢酶的粗酶液。
51.(6)向步骤(5)制备所得粗酶液中加入甲醇,投入作为底物的cdca/β-环糊精包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:甲醇在转化体系中的体积浓度为25vol%,cdca在转化体系中的浓度为1.5mg/ml,nad
+
在转化体系中的浓度为1.5mg/ml;将转化体系置于35℃、120rpm摇床中进行转化,转化时间20h,转化结束后水浴煮沸终止反应。
52.(7)将步骤(6)所得转化液离心后上清过0.45μm滤膜,进行hplc-elsd测定,流动相为:乙腈/甲酸水溶液(ph 3.0)=60/40,柱温30℃,流速1ml/min。
53.按照实施例1相同方法进行hplc-elsd检测,本实施例所得转化产物7k-lca的得率为10.59%
±
0.08。
54.实施例3
55.本实例按照如下步骤进行制备和转化:
56.(1)配制ph 8.0的磷酸盐缓冲液;
57.(2)配制600ml营养肉汤培养基,接种大肠杆菌后,置于30℃、120rpm的摇床中培养;
58.(3)将步骤(2)中生长至对数期的菌液在0℃、10000rpm转速下离心5min,去除上清液,将菌体用无菌水进行重悬、离心洗涤3次;
59.(4)将步骤(3)所得菌体用ph 8.0的磷酸盐缓冲液重悬,0℃冰浴下在超声波细胞破碎仪中进行超声破碎,获得破碎液;
60.(5)将步骤(4)所得破碎液在15℃、9000rpm转速下离心5min,所得上清液即为7α-羟基类固醇脱氢酶的粗酶液。
61.(6)向步骤(5)制备所得粗酶液中加入甲醇,投入作为底物的cdca/β-环糊精包合物,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:甲醇在转化体系中的体积浓度为35vol%,cdca在转化体系中的浓度为2mg/ml,nad
+
在转化体系中的浓度为2mg/ml;将转化体系置于40℃、120rpm摇床中进行转化,转化时间15h,转化结束后水浴煮沸终止反应。
62.(7)将步骤(6)所得转化液离心后上清过0.45μm滤膜,进行hplc-elsd测定,流动相为:乙腈/甲酸水溶液(ph 3.0)=60/40,柱温30℃,流速1ml/min。
63.按照实施例1相同方法进行hplc-elsd检测,本实施例所得转化产物7k-lca的得率为13.64%
±
0.05。
64.实施例4
65.本实例按照如下步骤进行制备和转化:
66.(1)配制ph 9.0的磷酸盐缓冲液;
67.(2)配制600ml营养肉汤培养基,接种铜绿假单胞菌后,置于30℃、120rpm的摇床中培养;
68.(3)将步骤(2)中生长至对数期的菌液在20℃、12000rpm转速下离心15min,去除上清液,将菌体用无菌水进行重悬、离心洗涤3次;
69.(4)将步骤(3)所得菌体用ph 9.0的磷酸盐缓冲液重悬,4℃冰浴下在超声波细胞破碎仪中进行超声破碎,获得破碎液;
70.(5)将步骤(4)所得破碎液在20℃、9000rpm转速下离心3min,所得上清液即为7α-羟基类固醇脱氢酶的粗酶液。
71.(6)向步骤(5)制备所得粗酶液中加入甲醇,投入作为底物的cdca,再加入烟酰胺腺嘌呤二核苷酸nad
+
,获得转化体系,其中:甲醇在转化体系中的体积浓度为20vol%,cdca在转化体系中的浓度为1.5mg/ml,nad
+
在转化体系中的浓度为2.5mg/ml;将转化体系置于40℃、120rpm摇床中进行转化,转化时间30h,转化结束后水浴煮沸终止反应。
72.(7)将步骤(6)所得转化液离心后上清过0.45μm滤膜,进行hplc-elsd测定,流动相为:乙腈/甲酸水溶液(ph 3.0)=60/40,柱温30℃,流速1ml/min。
73.按照实施例1相同方法进行hplc-elsd检测,本实施例所得转化产物7k-lca的得率为18.42%
±
0.12。
74.实施例5
75.本实例按照如下步骤进行制备和转化:
76.(1)配制ph 11.0的磷酸盐缓冲液;
77.(2)配制600ml营养肉汤培养基,接种双歧杆菌后,置于30℃、120rpm的摇床中培养;
78.(3)将步骤(2)中生长至对数期的菌液在10℃、12000rpm转速下离心15min,去除上清液,将菌体用无菌水进行重悬、离心洗涤2-3次;
79.(4)将步骤(3)所得菌体用ph 11.0的磷酸盐缓冲液重悬,0℃冰浴下在超声波细胞破碎仪中进行超声破碎,获得破碎液;
80.(5)将步骤(4)所得破碎液在10℃、11000rpm转速下离心10min,所得上清液即为7α-羟基类固醇脱氢酶的粗酶液。
81.(6)向步骤(5)制备所得粗酶液中加入甲醇,投入作为底物的cdca,再加入烟酰胺
腺嘌呤二核苷酸nad
+
,获得转化体系,其中:甲醇在转化体系中的体积浓度为30vol%,cdca在转化体系中的浓度为3mg/ml,nad
+
在转化体系中的浓度为3mg/ml;将转化体系置于45℃、120rpm摇床中进行转化,转化时间40h,转化结束后水浴煮沸终止反应。
82.(7)将步骤(6)所得转化液离心后上清过0.45μm滤膜,进行hplc-elsd测定,流动相为:乙腈/甲酸水溶液(ph 3.0)=60/40,柱温30℃,流速1ml/min。
83.按照实施例1相同方法进行hplc-elsd检测,本实施例所得转化产物7k-lca的得率为21.56%
±
0.07。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1