用于多交叉恒温扩增结合纳米生物传感检测肺炎支原体的引物组合和检测肺炎支原体的方法
用于多交叉恒温扩增结合纳米生物传感检测肺炎支原体的引物组合和检测肺炎支原体的方法
1.本技术是申请日为2019年03月19日、申请号为201910209767.8、发明名称为《多交叉恒温扩增结合纳米生物传感检测肺炎支原体的方法》的分案申请。
技术领域
2.本发明属于分子生物学技术领域,公开了一种用于多交叉恒温扩增结合纳米生物传感检测肺炎支原体的引物组合和检测肺炎支原体的方法。
背景技术:
3.肺炎支原体(mycoplasma pneumoniae,mp)是人类呼吸道感染性疾病最常见的病原体之一,也是社区获得性肺炎的主要病原体。在mp流行时期,由mp引起的社区获得性肺炎在一般人群中约占20%-40%,而在封闭人群中可高达70%。mp感染可发生在各年龄段人群中,其中以学龄期儿童和青少年最为常见。mp感染引起的临床症状多种多样,轻者临床表现与其他病原体感染引起的非特异性症状类似,如发热、咳嗽、流涕等;重者可表现为重症肺炎、呼吸衰竭等严重的呼吸系统疾病,甚至累及中枢系统、消化系统等。β-内酰胺类药物作用于细胞壁,是呼吸道感染性疾病经验性治疗常选药物,然而mp缺乏细胞壁,因此对作用于细胞壁的药物天然耐药。因此研发一个可用于诊断mp感染的简单、快速、敏感性和特异性较高的mp检测方法,对合理应用抗生素,有效治疗mp至关重要。
4.目前用于mp感染诊断的mp检测方法主要有:培养法、血清学检测、分子生物学检测。培养法是mp检测的金标准,但是该种方法并不推荐用于mp 检测,因为mp对生长条件要求苛刻、实验室要求比较高、技术人员要求比较严格,并且mp生长缓慢,需2~4周才可以获得培养结果。血清学检测因其便利性、敏感性和特异性较好而广泛用于实验室检测,但是血清学检测受采样时间,患者年龄、机体免疫状态等因素的影响,同时血清学检测结果的可靠性依赖急性期和恢复期双份血清的获取,由于恢复期血清难以获取,因此限制了血清学检测在临床上的应用。随着分子生物学技术的发展,以pcr 为基础的核酸检测技术开始广泛用于mp检测,其中real-time pcr是目前临床常用的mp快速检测技术。但是该检测方法依赖精密复杂的仪器,昂贵的探针,对实验室条件和技术人员要求比较高,因此该检测方法不适用于基层医院。
5.近年来为了克服pcr检测的不足,以恒温扩增技术为基础的核酸检测技术迅速发展。恒温扩增技术较pcr技术而言,不依赖于热循环扩增设备,仅需要水浴锅或简单的pcr仪即可,并且恒温扩增核酸检测技术具有特异性和敏感性高、操作简单、反应迅速的优点,因此恒温扩增技术可广泛用于各医疗机构。迄今为止,恒温扩增技术已有10余种,目前应用较为广泛的有滚环扩增(rca)、链置换扩增(sda)、解旋酶依赖的恒温扩增(hda)、环介导恒温扩增(lamp)、交叉扩增(cpa)等。然而,这些恒温扩增技术依赖多种酶同时工作,试剂昂贵、操作复杂,在欠发达地区及快速检测技术领域不适合推广应用。为克服pcr技术和现有的恒温扩增技术的劣势,实现简单、快速、灵敏、特异的核酸检测,发明人近期新建了一种核酸扩
增技术,命名为多交叉置换扩增(multiple cross displacement amplication,mcda),相关内容公开于cn104946744a,该专利文件作为现有技术文件构成本技术说明书的一个部分。
6.mcda在恒温条件下仅使用一种恒温置换酶实现核酸扩增,反应迅速,灵敏性和特异性高。为了使该技术更经济并且在生物、医药及卫生领域推广应用,发明人以mcda为基础,将mcda技术与纳米生物检测技术相结合,开发了依赖mcda技术、实现快速,敏感检测的纳米生物传感技术,该技术被命名为多交叉恒温扩增结合纳米生物传感的核酸检测技术(multiple crossdisplacement amplification label-based nanoparticles lateralflowbiosensor,mcda-lfb),相关内容公开于cn201610872509.4、cn201610942289.8和cn201610982015.1,这些专利文件作为现有技术文件构成本技术说明书的一个部分。如何将mcda-lfb应用于mp的检测,针对 mp的特异基因p1设计mcda扩增引物,快速、敏感、特异的检测mp,仍是本行业需要重点解决的问题。
技术实现要素:
7.本发明的目的在于将mcda-lfb应用于mp的检测,针对mp的特异基因p1设计mcda扩增引物,建立针对mp的快速、敏感、特异的mcda-lfb 检测体系。
8.基于上述目的,本发明首先提供了一种多交叉恒温扩增结合纳米生物传感检测目的基因的方法,所述方法包括以下步骤:
9.(1)提取待检测样品的基因组;
10.(2)提供序列如seq id no:1所示的置换引物f1和序列如seq id no:2 所示的置换引物f2,提供序列如seq id no:3所示的交叉引物cp1和序列如 seq id no:4所示的交叉引物cp2;序列如seq id no:5所示的扩增引物c1 和序列如seq id no:6所示的扩增引物c2,序列如seq id no:7所示的扩增引物d1和序列如seq id no:8所示的扩增引物d2,序列如seq id no:9所示的扩增引物r1和序列如seq id no:10所示的扩增引物r2;其中在引物 c1或者c2的5’端标记半抗原,在引物d1或者d2的5’端标记生物素;本步骤中所设计的上述引物是针对肺炎支原体的特异性基因p1设计的;
11.(3)在链移位型聚合酶、解链温度调节剂、引物存在下,使用待检测样品的基因组核酸作为模板恒温扩增dna;本步骤中所述的扩增是以肺炎支原体的特异性基因p1的核酸序列为模板进行的;
12.(4)使用纳米生物传感器检测步骤(3)的扩增产物。
13.在一个优选的技术方案中,所述在5’端标记半抗原的引物为c1,标记半抗原后的引物定义为c1*,在5’端标记生物素的引物为d1,标记生物素后的引物定为d1*。
14.在一个更为优选的技术方案中,在所述扩增引物c1*的5’端所标记的半抗原为荧光素(fitc)。
15.更为优选地,所述纳米生物传感器包括一背板,在所述背板上依次设置装有样品垫、结合垫、硝酸纤维素膜及吸水垫,在所述硝酸纤维素膜上依次设置检测线及控制线,在结合垫、检测线及控制线区域依次包被有有色基团修饰的亲和素化的高分子纳米粒子、羊抗fitc抗体及生物素偶联的牛血清蛋白。
16.在另一个优选的技术方案中,所述恒温扩增是在64-66℃的环境中进行的。
17.更为优选地,所述恒温扩增是在65℃的环境中进行的。
18.在又一个优选的技术方案中,所述恒温扩增的时间为30分钟。
19.其次,本发明还提供了一组用于恒温扩增肺炎支原体的p1基因的引物,所述引物包括:序列如seq id no:1所示的置换引物f1和序列如seq idno:2所示的置换引物f2,序列如seq id no:3所示的交叉引物cp1和序列如seq id no:4所示的交叉引物cp2;序列如seq id no:5所示的扩增引物 c1和序列如seq id no:6所示的扩增引物c2,序列如seq id no:7所示的扩增引物d1和序列如seq id no:8所示的扩增引物d2,序列如seq id no:9 所示的扩增引物r1和序列如seq id no:10所示的扩增引物r2;其中在引物 c1或者c2的5’端标记半抗原,在引物d1或者d2的5’端标记生物素。
20.在一个优选的技术方案中,所述在5’端标记半抗原的引物为c1,标记半抗原后的引物定义为c1*,在5’端标记生物素的引物为d1,标记生物素后的引物定为d1*。
21.在一个更为优选的技术方案中,在所述扩增引物c1*的5’端所标记的半抗原为荧光素(fitc)。
22.本发明公开的多交叉置换扩增方法可以在30分钟内完成整个mcda扩增,在其对肺炎支原体的特异性基因p1的检测中,检测下限可以低至10fg,具有非常高的灵敏度。另外,本发明提供的扩增方法具有很高的扩增特异性。在对常见的致病菌、条件致病菌及非肺炎支原体dna的检测中,均为阴性扩增,只有肺炎支原体呈特异性扩增,说明所建立的方法具有极高的特异性,能准确地鉴定肺炎支原体,无假阳性及假阴性结果产生。
附图说明
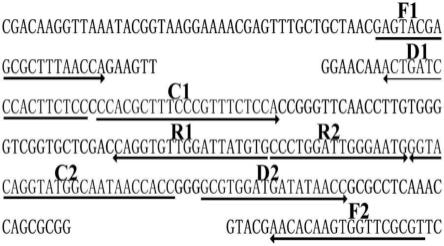
23.图1为mcda-lfb引物设计的位置和方向示意图;
24.图2为mcda引物验证及mcda-lfb检测结果图谱;
25.图3-1和图3-2为标准mcda-lfb最佳反应温度测试结果图谱;
26.图4为mcda-lfb检测肺炎支原体的灵敏度结果图谱;
27.图5为mcda-lfb技术的特异性检测评价图谱;
28.图6为mcda-lfb技术的最佳反应时间测试结果图谱。
具体实施方式
29.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的保护范围构成任何限制。
30.材料和方法
31.1.本发明中所涉及的试剂:
32.抗荧光素抗体(anti-fitc)及生物素偶联的牛血清蛋白(b-bsa)购于 abcam公司。高分子纳米粒子偶联的链霉素亲和素(sa-np)购于北京海泰正元科技有限公司。背板,样品垫,结合垫,吸水垫及纤维膜购于上海杰一公司。恒温扩增试剂盒(amplication kit)及恒温扩增可视染料(visualreagent,vr)购于购于天津捷易特生物科技有限公司。dna提取试剂盒 (qiaamp dna minikits;qiagen,hilden,germany)购于德国qiagen公司。其余试剂均为市售分型纯产品。
33.本发明实验中使用的主要仪器:恒温实时浊度仪la-320c(eiken chemicalco.,
ltd,japan)购于日本荣研公司。pcr仪为东胜龙edc-810,北京东胜创新生物科技有限公司。
34.基因组提取:细菌基因组的提取使用qiagen公司的dna提取试剂盒 (qiaamp dnaminikits;qiagen,hilden,germany),按照说明书进行操作。提取的基因组dna均少量分装,-20℃保存备用。
35.2.引物设计
36.为了验证、评价mcda-lfb技术及建立针对mp的快速、敏感和特异的 mcda-lfb检测体系。本发明针对mp的特异基因p1设计一套mcda扩增引物,旨在验证mcda-lfb技术的可行性、敏感性、特异性及可靠性。p1基因存在于所有的mp中,因其保守性好和特异性高,可以区分mp与其他菌种。利用引物设计软件primerexplorer v4(eiken chemical) (http://primerexplorer.jp/e/)和引物设计软件primer premier 5.0设计mcda引物,并将设计的mp特异性引物在ncbi数据库 (http://blast.ncbi.nlm.nih.gov/blast.cgi)中进行序列比对,从而排除引物与其他物种序列可能存在的非特异性匹配,最终获得优化后的mcda扩增引物。引物设计示意图见图1。引物序列及修饰见表1。
37.表1引物序列及修饰
[0038][0039][0040]
c1*为5’端标记了fitc(荧光素)的引物,该引物用于mcda-lfb检测体系);
[0041]
d1*为5’端标记了biotin(生物素)的引物,该引物用于mcda-lfb检测体系)。
[0042]
3.生物传感检测器(lfb)
[0043]
lfb的检测原理:将mp-mcda扩增产物直接滴加到lfb的样品垫区域,然后将80μl的检测缓冲液加到样品垫区域,mcda产物在虹吸作用下,从下往上运动(从样品垫向吸水垫方向运动)。当mcda产物达到结合垫后,双标产物的一端(即生物素标记端)与sa-np(纳米粒子偶联的链霉素亲和素) 反应。当产物继续运动,双标产物的另一端(即荧光素标记端)与检测线区域的抗体结合,将双标产物固定在检测线区域。随着产物在检测线区域的积累,通过另一端的sa-np进行显色反应,从而对mcda产物进行可视化检测。此外,过剩的sa-np可与cl
(质控线)区域的b-bsa(生物素偶联的牛血清蛋白),进行直接显色反应,判断lfb的功能是否正常。
[0044]
lfb结果读取(图2):阳性结果(图2中的b1)表现为cl(质控线)区域及tl(检测线)区域均出现红色条带;阴性结果(图2中的b2-4)表现为仅 cl区域出现红色条带;当lfb试纸条没有出现红色条带时,表示lfb检测无效;当仅tl区域出现红色条带,而cl区域没有出现红色条带时,表示检测结果不可靠,需要重新进行检测。
[0045]
实施例1.mcda引物的可行性验证
[0046]
mcda扩增(详见专利cn201610982015.1)
[0047]
mcda反应体系:0.4μm置换引物f1和f2,0.8μm扩增引物c1*和c2, 1.2μm扩增引物d1*、d2、r1、r2,2.4μm交叉引物cp1和cp2。10mm的betain, 6mm的mgso4,1mm的dntp,12.5μl的10
×
bstdna聚合酶缓冲液,10u的链置换dna聚合酶,1μl的模板,1μlvr染料,补加去离子水至25μl。 mcda的反应条件都为恒温65℃,反应时间为40min。
[0048]
mcda扩增之后,有两种可用于mcda扩增产物判别的检测方法,一种是通过在反应混合物中加入可视染料(vr),阳性反应管的颜色为绿色(图2 中的a1),阴性反应为无色(图2中的a2-4)。另一种最为简单直接的方法就是通过lfb对产物进行检测,阳性结果表现为cl和tl区域均出现红色条带(图 2中的b1),阴性结果仅表现为cl区域出现红色条带(图2中的b2-4)。
[0049]
实施例2.mcda技术的最佳反应温度测定
[0050]
在标准的mcda反应体系条件下,加入mpdna模板及所设计的mcda 引物,mp模板浓度为1ng/μl。反应在恒温条件下进行(61-68℃),运用实时浊度仪检测结果,在不同的温度下得到不同的动态曲线图,见图3-1和图3-2。 64-66℃被推荐作为mcda引物的的最佳反应温度。本发明中的后续验证选择 65℃作为恒温条件进行mcda扩增。图3-1和图3-2表示针对p1基因序列设计的检测mp的mcda引物筛选温度的动态曲线图。
[0051]
实施例3.mp-mcda检测mp的灵敏度
[0052]
将mp标准株基因组dna(1ng/μl)连续倍比稀释后进行标准的mcda 扩增,mcda的扩增产物运用lfb进行检测,结果显示:mcda-lfb检测mp 基因组dna浓度范围是1ng-10fg,lfb在cl和tl区域均出现红色条带,为阳性结果(图4中的b1-b6)。当mp基因组dna的浓度降为10fg以下时,lfb仅在cl区域出现红色条带,为阴性结果(图4中的b7-b8)。图4中的b1-b7, mp模板浓度依次为1ng、100pg、10pg、1pg、100fg、10fg、1fg,图4中的b8,为空白对照。为了进一步验证mcda-lfb检测mp的敏感性,在标准的反应体系中加入可视染料(vr),mp阳性反应管表现为绿色,mp阴性反应管则由绿色变为无色。可视染料(vr)检测结果显示:mp-mcda的检测范围为 1ng~10fg,阳性扩增管为绿色(图4中的a1-a6),当反应体系中mp基因组dna 量降低至10fg以下时,反应管的颜色由绿色变为无色,表示阴性结果(图4中的a7-a8)。图4中的a1-a7,mp模板浓度依次为1ng、100pg、10pg、1pg、 100fg、10fg、1fg,图4a8,为空白对照。
[0053]
实施例4.mcda-lfb技术检测mp的特异性
[0054]
本发明以常见的致病菌dna(肺炎链球菌、金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、肺炎克雷伯杆菌、铜绿假单胞杆菌、空肠弯曲菌、大肠杆菌、类志贺单胞菌、沙门氏菌、福氏志贺菌、鲍氏志贺菌、单增李斯特菌、蜡样芽胞杆菌、阪崎肠杆菌、嗜水气单胞菌、副
溶血性弧菌、创伤弧菌、稀氏肠球菌、粪肠球菌、屎肠球菌)为模板评价mp-mcda-lfb技术的特异性(菌株信息详见表2),该技术能够准确的鉴别mp与其他病原体,具有良好的特异性,见图5。图5中,lfb1-6:mpdna模板;lfb7-27:其他病原 dna模板;lfb28:空白对照。结果表明,mp-mcda-lfb技术能够准确的检测mp靶序列。
[0055]
表2菌株及特异性检测结果
[0056][0057][0058]
bch,beijing children’s hospital(北京儿童医院);cdc,chinese centerfordisease control and prevention(中国疾病预防控制中心).p,positive (mp-mcda-lfb检测阳性);n,negative(mp-mcda-lfb检测阴性).表2 中检测结果说明,只有属于m.pneumoniae的成员,经mp-mcda-lfb检测产生阳性结果,说明所建立的方法准确的鉴定m.pneumonia,无假阳性及假阴性结果产生。
[0059]
实施例5.mp-mcda-lfb技术最佳反应时间测定
[0060]
在标准的mcda扩增反应条件下,加入mp基因组dna模板及针对p1基因所设计的对应的mcda引物。反应在65℃恒温条件下进行,恒温时间依次为 10分钟,20分钟,30分钟和40
分钟。lfb检测结果显示:mcda-lfb技术应用于mp检测时,最佳反应时间为30分钟(图6)。当mcda恒温扩增时间控制为30分钟时,检测线水平的模板均能够被检出(图6中的c)。图6的c中, lfb检测范围为1pg~10fg,lfb在tl和cl区域均出现红色条带(图6中的 c1-c3)。当反应体系中基因组模板量降低至10fg以下时,lfb仅在cl区域出现红色线,表示阴性结果(图6中的c4)。图6运用lfb读取mcda体系从10 分钟到40分钟的扩增结果;c1到c4表示mp的模板量为1pg,100fg,10fg,1fg,c5 和c6分别为阴性对照(肺炎链球菌模板1pg)和空白对照(1μl双蒸水)。
[0061]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1