一种脐带来源间充质干细胞外泌体的制备方法、制备的外泌体及应用与流程
1.本技术涉及生物医药技术领域,尤其是涉及一种脐带来源间充质干细胞外泌体的制备方法、制备的外泌体及应用。
背景技术:
2.间充质干细胞(mscs)是中胚层发育而来的成体干细胞,具有高度自我更新能力和三个谱系(脂肪细胞、骨细胞、软骨细胞)分化能力,一些研究也证明,mscs还能分化成外胚层系,如上皮细胞、神经细胞等细胞。目前,mscs已成功地从其他成体组织如脂肪组织,牙髓,胎盘,羊水,脐带血,脐带的华通氏胶及他的血管周围区域中分离出来。由于mscs容易获得、低免疫原性、分泌的营养因子能够抑制免疫反应和营养周边细胞等优点,已经被广泛应用于临床研究各种疾病和修复组织损伤。
3.外泌体是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构。现有研究表明,mscs来源的外泌体通过核内体途径产生,能够起到与干细胞相似的生理作用,能够保护肾脏损伤、减少心肌缺血和再灌注损伤、保护内毒素诱导的肺损伤、调节免疫系统功能等。目前,对于msc来源的外泌体针对急性缺血性脑中风、难治性黄斑孔裂、1型糖尿病和阿尔茨海默症等疾病的治疗已经取得了突破。此外,目前msc来源的外泌体在组织修复领域也有诸多的研究成果。
4.mscs来源的外泌体通过核内体途径产生,不同细胞来源外泌体有相似的合成路径。该过程始于细胞膜表面的内吞作用形成的早期内吞体,早期内吞体再成熟为晚期内吞体,晚期内吞体膜通过内向出芽作用,包裹特异分选的蛋白、核酸等物质形成多个管腔囊泡,这种管腔囊泡即为外泌体的前体。目前对于mscs来源的外泌体的制备通常采用的方法是先培养mscs,促其分泌外泌体,然后对外泌体进行分离提取。而分离方法主要有离心法、沉淀法和超滤法三种。不同的培养方法,细胞分泌的外泌体性状不同,会直接影响外泌体在临床应用时的效果。而分离方法中,离心法回收率不高,且超高速离心会破坏外泌体结构;沉淀法会沉淀非外泌体的疏水性物质,蛋白纯度不高;超滤法滤膜易损耗和变形,易造成堵塞(外泌体易附着于膜上),纯度也较低。
5.糖尿病慢性创口是一种糖尿病患者的常见并发症。由于糖尿病患者肢端毛细血管易栓塞,导致创口处缺少血供,因此糖尿病慢性创口易感染,且创口难以愈合。由于其带来的长期痛苦,严重影响患者的生活质量,加重家庭和医护体系的负担。目前,已有部分医疗机构正在进行mscs来源的外泌体修复糖尿病慢性创口的研究。但是,外泌体的制备质量不稳定,严重困扰了其在糖尿病慢性创口临床领域的应用。因此,对mscs来源的外泌体的培养方法、相关参数和分离方法进行优化,对其蛋白质和核酸进行严格分析均是其应用于临床的基础。
技术实现要素:
6.为了解决上述至少一种技术问题,开发出一种培养过程简单、易于控制,分离过程易于操控,分离出的外泌体纯度相对较高,能够符合糖尿病慢性创口修复要求的mscs来源的外泌体的制备方法,本技术提供一种脐带来源间充质干细胞外泌体的制备方法、制备的外泌体及应用。
7.一方面,本技术提供的一种脐带来源间充质干细胞外泌体的制备方法,包括以下步骤:s1、细胞选择:选取在对数生长期的五代以内,脐带来源的间充质干细胞;s2、细胞培养:选择高糖培养基和血小板裂解物制备成细胞培养基,高糖培养基的质量分数在95%以上,将步骤s1选取的间充质干细胞置于细胞培养基中培养,直至细胞融合度达到90%以上;s3、外泌体促分泌:将步骤s2得到的含间充质干细胞的培养基,吸除上层培养基,并清洗,而后补充加入高糖培养基,放入二氧化碳培养箱中培养;s4、外泌体分离:将步骤s3得到的含间充质干细胞的培养基,吸除培养基后,用微孔水系过滤膜滤除细胞及其它杂质,取上清液封装,制得脐带来源的间充质干细胞外泌体。
8.通过采用上述技术方案,本技术选取特定的脐带来源的间充质干细胞,并采用特定的培养基和血小板裂解物混合制成的混合培养基和培养方法,能够促进间充质干细胞的稳定增殖,有效保证增殖的干细胞的质量;本技术在培养间充质干细胞后,采用特定的培养基,在二氧化碳培养箱中培养,能够有效促进外泌体的大量分泌,并且能够有效保证外泌体的生物特性,确保其能够适用于糖尿病慢性创口的修复;本技术的外泌体分离,采用微孔滤膜滤除细胞和杂质的方式,能够有效将间充质干细胞、细菌和杂质滤除,而且这种分离方式能够有效避免对外泌体的破坏,确保制得的外泌体具有较高的纯度和质量。
9.可选的,所述步骤s2中,所述细胞培养基中,高糖培养基的质量分数在97%,血小板裂解物的质量分数在3%。
10.进一步可选的,所述步骤s2中,所述高糖培养基选择gibco dmem高糖培养基,货号c11995500bt、90013或12100,所述血小板裂解物选择bi血小板裂解物,货号pltgold500r。
11.通过采用上述技术方案,本技术选择特定的混合培养基,能够进一步保证增殖的间充质干细胞的质量,为制备适用于糖尿病慢性创口治疗的外泌体,提供了极佳的细胞基础。
12.可选的,所述步骤s3中,所述清洗采用pbs缓冲液清洗,清洗两次以上。
13.可选的,所述步骤s3中,所述高糖培养基选择gibco dmem高糖培养基,货号31053036、90013或12100。
14.进一步可选的,所述步骤s3中,所述高糖培养基的加入量不低于20ml,所述二氧化碳培养箱中培养的时间控制在5天。
15.通过采用上述技术方案,本技术采用特定的高汤培养基和培养方法,能够进一步有效促进间充质干细胞能够大量分泌特定的、适用于糖尿病慢性创口治疗的外泌体。
16.可选的,所述步骤s4中,所述微孔水系过滤膜采用0.2微米的过滤膜。
17.可选的,所述步骤s4中,取上清液封装前需进行无菌检测。
18.通过采用上述技术方案,本技术采用特定孔径的微孔滤膜,滤除细胞和杂质,能够
有效将间充质干细胞、细菌和杂质滤除,除了有效避免对外泌体的破坏外,还能确保制备出的外泌体产品无菌,进一步提高了制备出的产品的质量。
19.另一方面,本技术还提供了上述制备方法制备的脐带来源间充质干细胞外泌体。
20.第三方面,本技术还提供了上述脐带来源间充质干细胞外泌体在糖尿病慢性创口修复产品和/或美容产品领域的应用。
21.通过采用上述技术方案,本技术提供了能够适用于治疗糖尿病慢性创口的外泌体,能够促进糖尿病慢性创口的修复,有效解决了糖尿病慢性创口治疗的医学难题。
22.综上所述,本发明包括以下至少一种有益技术效果:1、本技术选取特定的脐带来源的间充质干细胞,并采用特定的培养基和血小板裂解物混合制成的混合培养基和培养方法,能够促进间充质干细胞的稳定增殖,有效保证增殖的干细胞的质量。
23.2、本技术在培养间充质干细胞后,采用特定的培养基,在二氧化碳培养箱中培养,能够有效促进外泌体的大量分泌,并且能够有效保证外泌体的生物特性,确保其能够适用于糖尿病慢性创口的修复。
24.3、本技术的外泌体分离,采用微孔滤膜滤除细胞和杂质的方式,能够有效将间充质干细胞、细菌和杂质滤除,而且这种分离方式能够有效避免对外泌体的破坏,确保制得的外泌体具有较高的纯度和质量。
25.4、本技术提供了能够适用于治疗糖尿病慢性创口的外泌体,能够促进糖尿病慢性创口的修复,有效解决了糖尿病慢性创口治疗的医学难题。
附图说明
26.图1是本技术同型对照品的检测图;图2是本技术的实施例2的样品的检测图。
具体实施方式
27.以下结合实施例和附图对本技术作进一步详细说明。
28.本技术设计的一种脐带来源间充质干细胞外泌体的制备方法,包括以下步骤:s1、细胞选择:选取在对数生长期的五代以内,脐带来源的间充质干细胞;s2、细胞培养:选择高糖培养基和血小板裂解物制备成细胞培养基,高糖培养基的质量分数在95%以上,将步骤s1选取的间充质干细胞置于细胞培养基中培养,直至细胞融合度达到90%以上;s3、外泌体促分泌:将步骤s2得到的含间充质干细胞的培养基,吸除上层培养基,并清洗,而后补充加入高糖培养基,放入二氧化碳培养箱中培养;s4、外泌体分离:将步骤s3得到的含间充质干细胞的培养基,吸除培养基后,用微孔水系过滤膜滤除细胞及其它杂质,取上清液封装,制得脐带来源的间充质干细胞外泌体。
29.本技术制备出的脐带来源的间充质干细胞外泌体清液,需在4℃条件下冷藏保存。
30.在本技术前,间充质干细胞外泌体用于糖尿病慢性创口的治疗还处于研究阶段。不同的外泌体培养方法、相关参数和分离方法,制备出的外泌体的生物特性存在差异,导致了目前市面上能够获取的间充质干细胞外泌体性状不稳定,并不能满足糖尿病慢性创口治
疗的临床要求。
31.而本技术的发明人,通过对外泌体培养方法、相关参数和分离方法等进行优化,设计了本技术的脐带来源间充质干细胞外泌体的制备方法,能够稳定的制备出满足糖尿病慢性创口治疗的临床要求的外泌体。
32.本技术较为优选的实施方式中,可选的,所述步骤s2中,所述细胞培养基中,高糖培养基的质量分数在97%,血小板裂解物的质量分数在3%。
33.进一步可选的,所述步骤s2中,所述高糖培养基选择gibco dmem高糖培养基,货号c11995500bt,所述血小板裂解物选择bi血小板裂解物,货号pltgold500r。
34.本技术较为优选的实施方式中,可选的,所述步骤s3中,所述清洗采用pbs缓冲液清洗,清洗两次以上。
35.可选的,所述步骤s3中,所述高糖培养基选择gibco dmem高糖培养基,货号31053036。
36.进一步可选的,所述步骤s3中,所述高糖培养基的加入量不低于20ml,所述二氧化碳培养箱中培养的时间控制在5天。
37.本技术较为优选的实施方式中,可选的,所述步骤s4中,所述微孔水系过滤膜采用0.2微米的过滤膜。
38.采用上述进一步优化的培养参数和培养基后,本技术制备出的脐带来源间充质干细胞外泌体性状更为稳定,也更适于糖尿病慢性创口治疗的临床要求。
39.以下为本技术的实施例。
40.实施例1本实施例的脐带来源间充质干细胞外泌体的制备方法,包括以下步骤:s1、细胞选择:选取在对数生长期的五代以内,人源性的脐带来源的间充质干细胞。
41.s2、细胞培养:选择gibco dmem高糖培养基和bi血小板裂解物制备成细胞培养基,高糖培养基的质量分数在95%,血小板裂解物的质量分数在5%。将步骤s1选取的间充质干细胞置于100mm培养皿,在细胞培养基中,室温条件下培养,直至细胞融合度达到90%以上。
42.s3、外泌体促分泌:将步骤s2得到的含间充质干细胞的培养基,吸除上层培养基,用pbs缓冲液清洗细胞2次。而后补充加入gibco dmem高糖培养基30ml,放入二氧化碳培养箱中培养7天。
43.s4、外泌体分离:将步骤s3得到的含间充质干细胞的培养基,吸除培养基后,用0.22微米的微孔水系过滤膜滤除细胞及其它杂质。取少量上清液依据《中国药典》记载的方法,分别加入到硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中,放入恒温箱中培养,检测其是否无菌。
44.s5、确定无菌后,取上清液分装在西林瓶中封装,制得脐带来源的间充质干细胞外泌体。若有菌,则重复制备,直至制备出无菌产品。
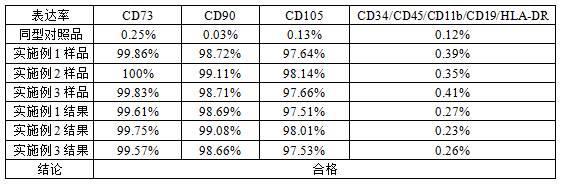
45.实施例2本实施例的脐带来源间充质干细胞外泌体的制备方法,包括以下步骤:s1、细胞选择:选取在对数生长期的五代以内,人源性的脐带来源的间充质干细胞。
46.s2、细胞培养:选择货号c11995500bt的gibco dmem高糖培养基和货号pltgold500r的bi血小板裂解物制备成细胞培养基,高糖培养基的质量分数在97%,血小板裂解物的质量分数在3%。将步骤s1选取的间充质干细胞置于100mm培养皿,在细胞培养基中,室温条件下培养,直至细胞融合度达到90%以上。
47.s3、外泌体促分泌:将步骤s2得到的含间充质干细胞的培养基,吸除上层培养基,用pbs缓冲液清洗细胞3次。而后补充加入货号31053036的gibco dmem高糖培养基20ml,放入二氧化碳培养箱中培养5天。
48.s4、外泌体分离:将步骤s3得到的含间充质干细胞的培养基,吸除培养基后,用0.2微米的微孔水系过滤膜滤除细胞及其它杂质。取少量上清液依据《中国药典》记载的方法,分别加入到硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中,放入恒温箱中培养,检测其是否无菌。
49.s5、确定无菌后,取上清液分装在西林瓶中封装,制得脐带来源的间充质干细胞外泌体。若有菌,则重复制备,直至制备出无菌产品。
50.实施例3与实施例2的区别在于,步骤s2选择货号12100的gibco dmem高糖培养基;步骤s3选择货号90013的gibco dmem高糖培养基。
51.将本技术实施例1~3制备的脐带来源的间充质干细胞外泌体进行cd73、cd90和cd105的表达率检测;同时,对其进行cd34/cd45/cd11b/cd19/hla-dr的表达率检测。具体结果见表1。
52.表1 实施例1~3的检测结果列表由表1的数据可以看出,本技术实施例1~3制备出的外泌体cd73、cd90和cd105高表达,而cd34/cd45/cd11b/cd19/hla-dr几乎不表达,完全符合外泌体的特性。
53.如图1、图2所示,图1是本技术的同型对照品的检测图,图2是本技术实施例2的制备方法制备出的外泌体的检测图。从图1和图2可以很直观的反映,本技术实施例2以人源性脐带来源间充质干细胞,制备出的外泌体,经检测,完全符合外泌体的特性,纯度也较高。
54.本技术的制备方法制备出的脐带来源间充质干细胞外泌体适用于糖尿病慢性创口的治疗。同时,还可以在美容领域有较好的应用。本技术的具体使用方法如下。
55.1)糖尿病慢性创口的治疗:将破损皮肤周围清洗干净,并保持干燥清洁后,将本技术制备的外泌体产品均匀涂抹至患处再用无菌纱布将其覆盖,一天两次,直至患处伤口愈合。
56.2)美容:
使用水光针将本技术制备的外泌体产品导入至表皮,通过外泌体的作用可以促进皮下成纤维细胞的生长,增加皮肤的弹性,减少皱纹。
57.验证实验本技术以实施例2制备的脐带来源间充质干细胞外泌体为样品,对其治疗糖尿病慢性创口进行有效性验证。
58.实验动物:雄性sd大鼠。
59.模型构建方法:通过对sd大鼠尾静脉注射链脲佐菌素,注射剂量80mg/kg,每天注射两次,连续注射三天,诱导sd大鼠糖尿病的发生。然后在完成糖尿病模型构建的sd大鼠的腰背两侧皮肤上,开一个深入到浅筋膜的切口,形成缺损性创面,每日用50%冰醋酸涂创面一次,连续涂一周后,完成糖尿病慢性创口模型的构建。
60.分组:取完成糖尿病慢性创口模型构建的雄性sd大鼠48只,分为两组,每组24只。
61.实验方法:将两组sd大鼠一组作为实验组,另一组作为对照组,实验期间正常喂养。实验组清创后,注射甘精胰岛素进行控糖治疗,并在创口涂抹本技术实施例2制备的外泌体清液,每日涂抹两次,涂抹后用无菌纱布封闭创口,治疗周期28天。对照组清创后,用无菌敷料封闭创口,注射甘精胰岛素进行控糖治疗,并同时注射扩血管药物、抗凝血药物和抗生素治疗,治疗周期同样为28天。
62.具体实验:取80只雄性sd大鼠,按照模型构建方法构建糖尿病慢性创口模型。共计获得53只完成糖尿病慢性创口模型构建的sd大鼠。
63.取48只完成糖尿病慢性创口模型构建的sd大鼠,分为对照组和实验组,每组24只,按照实验方法进行喂养和治疗,待治疗周期结束后统计治愈的sd大鼠的数量,计算治愈率,并检查未治愈sd大鼠的创口情况,判断创口是否得到了修复治疗,具体结果见表2。
64.表2 动物实验数据结果列表组别治愈率未治愈创口情况对照组62.5%略有好转实验组75%明显好转通过表2的数据可以看出,本技术制备出的脐带来源间充质干细胞外泌体,采用外用方式,对糖尿病慢性创口具有治疗效果,且治疗效果优于目前传统的药物注射治疗。
65.以上均为本技术的较佳实施例,并非依此限制本技术的保护范围,故:凡依本技术的结构、形状、原理所做的等效变化,均应涵盖于本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1