一锅法合成3-四取代吲哚啉-2-酮类化合物的方法
1.本发明属于有机化工医药领域,涉及金属铑盐、金属钯盐和膦配体催化的苯胺衍生物、3-重氮吲哚啉-2-酮衍生物和烯丙基碳酸酯三组分串联反应合成3-四取代吲哚啉-2-酮化合物的方法。
背景技术:
2.吲哚啉酮化合物是天然产物、药物分子以及农药分子中常见的结构。它们具有广泛的生物活性,如抗菌、抗惊厥、抗肿瘤、抗抑郁和抗艾滋病毒(hu,w.,et al.org.lett.2019,21,9878;banerjee,a.,et al.acc.chem.res.2007,40,151)。
3.鉴于其特殊的结构和应用,其合成吸引了越来越多人的关注。传统的合成吲哚啉酮的方法主要有通过吲哚的氧化来合成吲哚啉酮(schmid,w.,et al.monatsh.chem.2009,140,509)。由于其底物适用性方面的限制,所以该方法还存在着局限性。另一种方法是通过吲哚醌的还原来合成吲哚啉酮化合物(lin,w.,et al.tetrahedron lett.2014,55,2238)。3-吲哚啉-2-酮三位引入螺环结构的季碳中心(hu,w.,et al.adv.synth.catal.,2017,359,58)。
4.本发明充分利用卡宾前体3-重氮吲哚啉-2-酮衍生物在rh盐催化下可以形成rh卡宾,对苯胺衍生物的对位进行c-h键插入,再和第三组分原料烯丙基碳酸酯通过pd和配体协同接力催化烯丙基化。这样通过双金属接力催化实现了苯胺衍生物、3-重氮吲哚啉-2-酮衍生物和烯丙基碳酸酯的三组分一锅串联反应生成了在吲哚啉-2-酮的4位同时引入对氨基苯基和烯丙基这两类活性基团,构建了新的季碳中心。原料易得,方法操作简单,原子经济性较高,环境友好,极大地丰富了吲哚啉酮衍生物的合成方法和种类。
技术实现要素:
5.本发明属于有机化工医药领域,涉及金属铑盐、金属钯盐和膦配体催化的苯胺衍生物、3-重氮吲哚啉-2-酮衍生物和烯丙基碳酸酯三组分串联反应合成3-四取代吲哚啉-2-酮类化合物的方法。
6.本发明以一锅法合成3-四取代吲哚啉-2-酮类化合物,反应首先加入铑催化剂、钯催化、膦配体,再加入适量的溶剂并在氩气保护下,加入苯胺衍生物、3-重氮吲哚啉-2-酮衍生物、烯丙基碳酸酯衍生物,在室温附近搅拌反应一定时间,待反应结束后减压蒸去溶剂,以硅胶吸附,通过柱层析或混合溶剂重结晶分离得到目标产物;反应后用柱色谱分离方法提纯,以石油醚与乙酸乙酯的混合溶剂为洗脱剂或者以乙酸乙酯/石油醚体系为重结晶溶剂,对产物进行提纯以得到纯净的3-四取代吲哚啉-2-酮化合物。
7.3-四取代吲哚啉-2-酮化合物合成方法为:
[0008][0009]
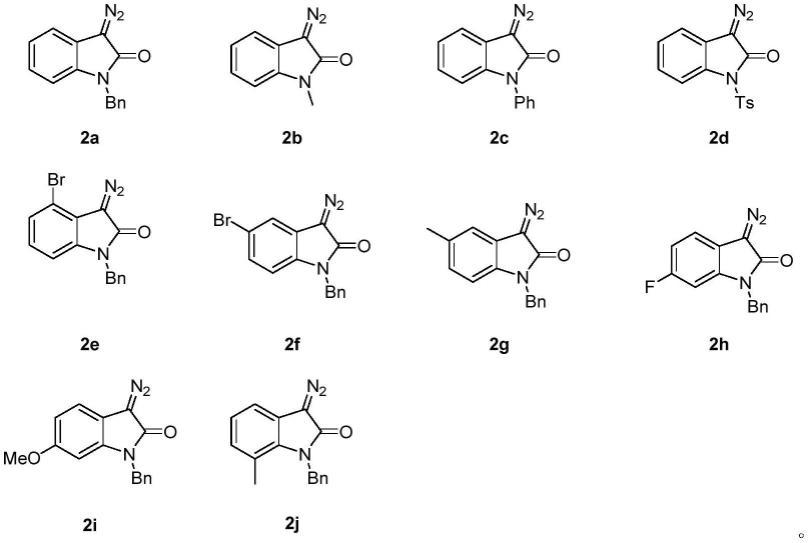
r1为苄基、甲基、苯基、对甲苯磺酰基;r2为氢、4-溴、5-溴、5-甲基、6-氟、6-甲氧基、7-甲基;(r3)2为双苄基、1,4-丁叉基、双(2-甲氧基乙基);r4为氢、3-甲基、3-甲氧基、3-甲氧羰基、2-甲基;r5为氢、苯基、4-甲氧基苯基、4-氯苯基、3-甲基苯基、3-氯苯基、2-甲基苯基、胡椒环-4-基。
[0010]
苯胺衍生物为下述结构:
[0011][0012]
3-重氮吲哚啉-2-酮下述结构:
[0013][0014]
烯丙基碳酸酯衍生物为下述结构:
[0015][0016]
所用的铑催化剂为rh2(oac)4、rh2(pttl)4、rh2(oct)4、rh2(esp)2、rh2(opiv)4;钯催化剂为pd(oac)2、pd(phcn)2cl2、pd(tfa)2、pd2(dba)3、pd[(allyl)cl]2;膦配体为xantphos、xphos、davephos、binap、sphos、当量比[rh]:[pd]:[配体]:苯胺衍生物为1~2%:1~5%:3~12%。
[0017]
苯胺衍生物:3-重氮吲哚啉-2-酮:烯丙基碳酸酯衍生物的当量比为:1:1~2:1~2。
[0018]
先加入铑催化剂、钯催化剂以及膦配体,再加入适量的溶剂并用氩气保护,在通氩气条件下,加入苯胺衍生物、3-重氮吲哚啉酮衍生物、烯丙基碳酸酯衍生物,在室温附近搅拌反应3-36小时,待反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到产物,或者用乙酸乙酯/石油醚体系进行重结晶提纯。
[0019]
所述反应溶剂为有机溶剂。具体的有机溶剂为甲苯、二甲苯、乙腈、四氢呋喃、三氯
甲烷、二氯甲烷中的一种。
[0020]
优选为:铑催化剂为rh2(pttl)4;钯催化剂为pd2(dba)3;配体为xphos;溶剂为dcm;rh2(pttl)4:pd2(dba)3和xphos配体的优选摩尔比例为1:2.5:6。
[0021]
苯胺衍生物在溶剂中的浓度为0.05~0.2mol/l。
[0022]
本发明合成了3-四取代吲哚啉-2-酮化合物。
[0023]
本发明实现了以苯胺衍生物、3-重氮吲哚啉-2-酮衍生物、烯丙基碳酸酯衍生物为原料,通过双金属接力催化以及条件的筛选,在简单的一锅投料法下在吲哚啉-2-酮衍生物的三位同时引入了取代的对氨基苯基和取代的烯丙基,构造了新的季碳中心,从而合成了新型的吲哚啉-2-酮衍生物。所有产物其结构经1h nmr、
13
c nmr、hrms和熔点等确证。该反应投料的方式简便,底物适应性较广。
[0024]
有益效果:
[0025]
1).反应原料易得,市售或者容易制备。
[0026]
2).反应操作较为简单,中间产物无需分离即可进行下一步反应,可以实现三组分串联反应。
[0027]
3).反应条件较为温和,室温附近即可实现,绝大多数底物反应时间较短,效率较高。
[0028]
4).原子经济性较高,副产物仅为氮气和取代碳酸盐,环境友好,较符合绿色化学的要求。
[0029]
5).底物适应性广,产率优良,在吲哚啉-2-酮衍生物的3-位构造了新的季碳中心,特别是当使用市售的手性膦配体的时候,具有中等的对映选择性,大大丰富吲哚啉-2-酮衍生物的结构。并且3-同时引入的对氨基苯基和烯丙基,这些高活性基团可以方便的进行衍生反应,得到更为丰富的吲哚啉-2-酮衍生物,有益于后继高效药物筛选提供分子库。
附图说明
[0030]
图1为实施例1得到的4aaa的1h-nmr(核磁氢谱);
[0031]
图2为实施例1得到的4aaa的
13
c-nmr(核磁碳谱);
[0032]
图3为实施例1得到的4aaa的hrms(高分辨质谱)。
具体实施方式
[0033]
下面结合实施例对本发明做进一步描述,但不限于此。
[0034]
实施例1
[0035][0036]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd(oac)
2 2.2mg
(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 86.5mg,收率81%。m.p.121-123℃;1h nmr(400mhz,cdcl3)δ7.32-7.29(m,4h),7.2-7.21(m,12h),7.16-7.12(m,3h),7.04-7.00(m,1h),6.70-6.65(m,3h),5.46-5.35(m,1h),5.07-5.03(m,1h),4.98(d,j=15.6hz,1h),4.92-4.89(m,1h),4.75(d,j=15.6hz,1h),4.66-4.57(m,4h),3.12-3.07(m,1h),3.01-2.96(m,1h).
13
c nmr(75mhz,cdcl3)δ178.8,148.4,143.0,138.6,136.0,133.0,132.2,128.7,128.7,127.9,127.9,127.5,127.5,127.4,127.0,126.7,125.1,122.4,119.1,112.4,109.2,55.8,54.3,43.9,41.9.hrms(esi)m/z:[m+h]
+
calcd for c
38h35
n2o 535.2744;found 535.2742.
[0037]
实施例2
[0038]
向反应管中依次加入催化剂rh2(oct)
4 2.3mg(0.002mmol),pd(oac)
2 2.2mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 80.1mg,收率75%。
[0039]
实施例3
[0040]
向反应管中依次加入催化剂rh2(opiv)
4 2.3mg(0.002mmol),pd(oac)
2 2.2mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 76.9mg,收率72%。
[0041]
实施例4
[0042]
向反应管中依次加入催化剂rh2(esp)
2 1.5mg(0.002mmol),pd(oac)
2 2.2mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 66.2mg,收率62%。
[0043]
实施例5
[0044]
向反应管中依次加入催化剂rh2(oac)
4 0.88mg(0.002mmol),pd(oac)
2 2.2mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 60.8mg,收率57%。
[0045]
实施例6
[0046]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd(phcn)2cl22.2mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 42.7mg,收率40%。
[0047]
实施例7
[0048]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd(tfa)
2 2.2mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 46.0mg,收率43%。
[0049]
实施例8
[0050]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 89.7mg,收率84%。
[0051]
实施例9
[0052]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),[pd(allyl)cl]22.3mg(0.01mmol),xantphos 7mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 71.6mg,收率67%。
[0053]
实施例10
[0054]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 89.7mg,收率84%。
[0055]
实施例11
[0056]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),davephos 5.6mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg
(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 78.0mg,收率73%。
[0057]
实施例12
[0058]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),binap 5.6mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 64.1mg,收率60%。
[0059]
实施例13
[0060]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),sphos 5.6mg(0.012mmol)2ml甲苯,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 83.3mg,收率78%。
[0061]
实施例14
[0062]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 102.6mg,收率96%。
[0063]
实施例14-1
[0064]
放大反应:向100ml反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.02mmol),pd2(dba)
3 46mg(0.05mmol),xphos 56mg(0.12mmol)20ml dcm,再加入苯胺衍生物1a 0.55g(2mmol),3-重氮吲哚啉酮衍生物2a 0.80g(3.2mmol),烯丙基碳酸酯衍生物3a 0.63g(4mmol)和20ml dcm。密封充氩气反应。反应在30℃下反应3h,硅藻土过滤,乙酸乙酯洗涤,收集母液后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa1.01g,收率96%。或先用硅藻土过滤,用乙酸乙酯洗涤,收集母液后减压蒸去溶剂,使用石油醚/乙酸乙酯(4/1)重结晶,获得产物0.908g,收率85%。
[0065]
实施例15
[0066]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml二甲苯,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸脂衍生物3a 63.2mg(0.4mmol)和2ml二甲苯。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 97.2mg,收率91%。
[0067]
实施例16
[0068]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml四氢呋喃,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸脂衍生物3a 63.2mg(0.4mmol)和2ml四氢呋喃。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 32.0mg,收率30%。
[0069]
实施例17
[0070]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml乙腈,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml乙腈。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 56.6mg,收率53%。
[0071]
实施例18
[0072]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml三氯甲烷,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml三氯甲烷。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 37.4mg,收率35%。
[0073]
实施例19
[0074]
向反应管中依次加入催化剂pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,无产物。
[0075]
实施例20
[0076]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,无产物。
[0077]
实施例21
[0078]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,无产物。
[0079]
实施例22
[0080]
向反应管中依次加入催化剂rh2(pttl)
4 1.2mg(0.001mmol),pd2(dba)
3 4.6mg(0.0025mmol),xphos 5.6mg(0.006mmol)2ml dcm,再加入苯胺衍生物1a54.6mg(0.2mmol),
3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应6h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 96.1mg,收率90%。
[0081]
实施例23
[0082]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 59.8mg(0.24mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 96.1mg,收率90%。
[0083]
实施例24
[0084]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)1ml dcm,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和1ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 98.3mg,收率92%。
[0085]
实施例25
[0086]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在25℃下反应5h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaa 97.2mg,收率91%。
[0087]
实施例26
[0088][0089]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2b 55.4mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aba 80.7mg,收率88%;1h nmr(400mhz,cdcl3)δ7.30-7.19(m,12h),7.15-7.12(m,2h),7.07-7.03(m,1h),
6.83-6.81(m,1h),6.64-6.62(m,1h),5.43-5.32(m,1h),5.00-4.97(m,1h),4.89-4.86(m,1h),4.63-4.54(m,4h),3.14(s,3h),2.99-2.92(m,2h).
13
c nmr(100mhz,cdcl3)δ178.6,148.3,143.9,138.6,132.9,132.1,128.7,128.0,127.9,127.3,127.0,126.7,125.2,122.3,118.9,112.4,108.1,55.7,54.3,42.0,26.3.hrms(esi)m/z:[m+h]
+
calcd for c
32h31
n2o 459.2431;found 459.2432.
[0090]
实施例27
[0091][0092]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2c 75.2mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aca 89.5mg,收率86%;1h nmr(400mhz,cdcl3)δ7.48-7.44(m,2h),7.36-7.27(m,8h),7.25-7.17(m,9h),7.10-7.07(m,1h),6.82-6.80(m,1h),6.68-6.66(m,2h),5.52-5.42(m,1h),5.10-5.06(m,1h),4.98-4.95(m,1h),δ4.66-4.57(m,4h),3.16-3.10(m,1h),3.02-2.97(m,1h).
13
c nmr(100mhz,cdcl3)δ178.1,148.4,143.9,138.6,134.8,132.8,132.0,129.,128.7,128.0,127.9,127.9,127.4,127.0,126.8,126.7,125.4,122.8,119.2,112.4,109.4,55.8,54.3,42.4.hrms(esi)m/z:[m+h]
+
calcd for c
37h33
n2o 521.2587;found 521.2587.
[0093]
实施例28
[0094][0095]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2d 100.0mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4ada 83.5mg,收率70%;1h nmr(400mhz,cdcl3)δ7.97-7.95(m,1h),7.91-7.89(m,2h),7.32-7.15(m,15h),6.92-6.90(m,2h),6.57-6.55(m,2h),4.98-4.88(m,1h),4.73-4.69(m,1h),4.64-4.55(m,
4h),4.50-4.47(m,1h),3.00-2.95(m,1h),2.77-2.72(m,1h),2.35(s,3h).
13
c nmr(100mhz,cdcl3)δ177.0,148.7,145.5,139.3,138.4,135.4,131.6,131.2,129.6,128.8,128.7,128.1,127.8,127.1,126.6,126.3,125.4,124.9,119.5,113.8,112.4,56.2,54.3,42.2,21.8.hrms(esi)m/z:[m+h]
+
calcd for c
38h35
n2o3s 599.2363;found 599.2358.
[0096]
实施例29
[0097][0098]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2e 105.0mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aea 100.4mg,收率82%;1h nmr(400mhz,cdcl3)δ7.30-7.27(m,4h),7.23-7.18(m,11h),7.12-7.10(m,1h),7.01-6.96(m,3h),6.67-6.61(m,3h),5.39-5.29(m,1h),5.18-5.13(m,1h),4.95(d,j=15.6hz,1h),4.89-4.86(m,1h),4.71(d,j=15.6hz,1h),4.64-4.55(m,4h),3.50-3.45(m,1h),3.30-3.25(m,1h).
13
c nmr(100mhz,cdcl3)δ178.2,148.6,145.3,138.6,135.6,132.6,130.7,129.6,128.7,128.7,127.7,127.7,127.4,127.0,126.8,126.8,125.5,120.4,119.1,112.5,108.1,58.1,54.2,44.1,37.5.hrms(esi)m/z:[m+h]
+
calcd for c
38h34
brn2o 613.1849;found 613.1847.
[0099]
实施例30
[0100][0101]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2f 105.0mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4afa 110.2mg,收率90%;1h nmr(400mhz,cdcl3)δ7.33-7.29(m,5h),7.26-7.21(m,12h),7.12-7.10(m,2h),6.78-6.66(m,2h),6.56-6.53(m,1h),5.45-5.34(m,1h),5.09-5.05(m,1h),4.97-4.93(m,
2h),4.75-4.70(m,1h),4.67-4.58(m,4h),3.10-3.05(m,1h),2.98-2.93(m,1h).
13
c nmr(100mhz,cdcl3)δ178.2,148.6,142.1,138.5,135.6,134.6,132.4,130.8,128.8,128.8,128.1,127.8,127.7,127.4,127.0,126.8,126.7,119.7,115.3,112.5,110.7,56.0,54.3,44.0,41.7.hrms(esi)m/z:[m+h]
+
calcd for c
38h34
brn2o613.1849;found 613.1846.
[0102]
实施例31
[0103][0104]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2g 84.2mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aga 93.2mg,收率85%,mp:148-150℃;1h nmr(300mhz,cdcl3)δ7.32-7.14(m,17h),7.03(s,1h),6.94-6.91(m,1h),6.67-6.64(m,2h),6.58-6.55(m,1h),5.47-5.34(m,1h),5.10-5.04(m,1h),4.98-4.89(m,2h),4.75-4.70(m,1h),4.66-4.55(m,4h),3.13-3.06(m,1h),3.00-2.93(m,1h),2.27(s,3h).
13
c nmr(75mhz,cdcl3)δ178.7,148.4,140.6,138.6,136.2,133.1,132.4,131.9,128.7,128.7,128.2,127.9,127.8,127.5,127.4,127.0,126.7,125.8,119.1,112.4,109.0,55.9,54.3,43.9,41.8,21.3.hrms(esi)m/z:[m+h]
+
calcd for c
39h37
n2o 549.2900;found 549.2898.
[0105]
实施例32
[0106][0107]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2h 85.5mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aha 103.8mg,收率94%;1h nmr(400mhz,cdcl3)δ7.31-7.20(m,15h),7.15-7.12(m,3h),6.71-6.65(m,3h),
6.44-6.41(m,1h),5.45-5.34(m,1h),5.02-5.02(m,1h),4.96-4.90(m,2h),4.72-4.68(m,1h),4.65-4.56(m,4h),3.09-3.04(m,1h),2.98-2.93(m,1h).
13
c nmr(100mhz,cdcl3)δ179.0,162.7(d,j=243.1hz),148.5,144.5(d,j=11.3hz),138.5,135.5,132.7,128.8,128.7,127.8,127.7,127.5(d,j=2.9hz),127.4,127.2,127.0,126.7,126.1(d,j=9.5hz),119.4,112.5,108.6(d,j=22.0hz),98.0(d,j=27.2hz),55.4,54.3,44.1,42.0.
19
f nmr(282mhz,cdcl3)δ-112.3.hrms(esi)m/z:[m+h]
+
calcd for c
38h34
fn2o 553.2650;found 553.2648.
[0108]
实施例33
[0109][0110]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2i 89.4mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aia 103.8mg,收率92%;1h nmr(400mhz,cdcl3)δ7.31-7.27(m,4h),7.24-7.18(m,11h),7.17-7.15(m,2h),7.12-7.10(m,1h),6.66-6.64(m,2h),6.53-6.51(m,1h),6.29-6.29(m,1h),5.47-5.37(m,1h),5.07-5.03(m,1h),4.96-4.89(m,2h),4.72-4.68(m,1h),4.64-4.56(m,4h),3.68(s,3h),3.08-3.03(m,1h),2.98-2.98(m,1h).
13
c nmr(100mhz,cdcl3)δ179.3,159.8,148.4,144.3,138.6,136.1,133.2,128.7,127.9,127.6,127.5,127.0,126.7,125.7,124.1,119.1,112.4,106.2,97.3,55.4,55.3,54.3,44.0,42.2.hrms(esi)m/z:[m+h]
+
calcd for c
39h37
n2o
2 565.2850;found 565.2849.
[0111]
实施例34
[0112][0113]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 54.6mg(0.2mmol),3-重氮吲哚啉酮衍生物2j 84.2mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶
柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aja 102.0mg,收率93%;1h nmr(400mhz,cdcl3)δ7.30-7.26(m,4h),7.23-7.14(m,11h),7.11-7.08(m,3h),6.96-6.89(m,2h),6.66-6.64(m,2h),5.53-5.42(m,1h),5.19-5.15(m,1h),5.09-5.05(m,2h),4.97-4.94(m,1h),4.64-4.55(m,4h),3.17-3.11(m,1h),3.00-2.94(m,1h),2.23(s,3h).
13
c nmr(100mhz,cdcl3)δ179.7,148.3,141.2,138.6,138.0,133.3,132.9,131.9,128.7,128.7,128.1,127.9,127.0,127.0,126.7,125.9,123.2,122.5,119.7,119.1,112.4,55.1,54.3,45.1,42.1,19.0.hrms(esi)m/z:[m+h]
+
calcd for c
39h37
n2o 549.2900;found 549.2898.
[0114]
实施例35
[0115][0116]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1b 29.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4baa 62.1mg,收率76%;1h nmr(400mhz,cdcl3)δ7.27-7.21(m,8h),7.18-7.14(m,1h),7.06-7.02(m,1h),6.73-6.71(m,1h),6.52-6.50(m,2h),5.49-5.39(m,1h),5.19-5.05(m,1h),4.97-4.91(m,2h),4.83-4.79(m,1h),3.26-3.22(m,4h),3.13-3.07(m,1h),3.04-3.0(m,1h),1.97-1.94(m,4h).
13
c nmr(100mhz,cdcl3)δ178.8,147.2,143.1,136.2,133.1,132.5,128.7,127.9,127.5,127.4,125.2,122.4,119.1,111.8,109.2,55.8,47.7,43.9,42.0,25.6.hrms(esi)m/z:[m+h]
+
calcd for c
28h29
n2o 409.2274;found 409.2273.
[0117]
实施例36
[0118][0119]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg
(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1c 36.2mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4caa 89.4mg,收率95%;1h nmr(400mhz,cdcl3)δ7.29-7.14(m,9h),7.06-7.02(m,1h),6.73-6.73(m,1h),6.65-6.63(m,2h),5.48-5.38(m,1h),5.09-5.05(m,1h),4.97(d,j=15.6hz,1h),4.94-4.91(m,1h),4.79(d,j=15.6hz,1h),3.53-3.51(m,8h),3.33(s,6h),3.13-3.08(m,1h),3.03-2.98(m,1h).
13
c nmr(100mhz,cdcl3)δ178.7,147.0,143.1,136.1,133.0,132.3,128.7,128.0,127.9,127.5,127.4,126.8,125.2,122.4,119.2,111.7,109.2,70.1,59.1,55.7,50.9,43.9,42.0.hrms(esi)m/z:[m+h]
+
calcd for c
30h35
n2o3471.2642;found 471.2643.
[0120]
实施例37
[0121][0122]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1d 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4daa 98.7mg,收率90%;1h nmr(400mhz,cdcl3)δ7.43-7.40(m,3h),7.31-7.29(m,6h),7.25-7.21(m,7h),7.15-7.1(m,1h),6.96-6.91(m,2h),6.78-6.76(m,1h),6.62-6.59(m,1h),6.44-6.43(m,1h),5.38-5.28(m,1h),5.08(d,j=15.2hz,1h),5.02-4.98(m,1h),4.88-4.86(m,1h),4.74(d,j=15.2hz,1h),4.63-4.54(m,4h),3.08-3.03(m,1h),3.00-2.96(m,1h),1.49(s,3h).
13
c nmr(100mhz,cdcl3)δ179.1,148.6,143.2,138.7,138.0,136.2,133.5,132.3,128.7,128.7,128.5,128.2,127.7,127.6,127.0,126.8,126.0,123.6,122.8,119.4,115.8,109.6,108.7,55.6,53.9,44.4,42.9,20.4.hrms(esi)m/z:[m+h]
+
calcd for c
39h37
n2o 549.2900;found 549.2899.
[0123]
实施例38
[0124][0125]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1e 60.7mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4eaa 82.4mg,收率73%;1h nmr(400mhz,cdcl3)δ7.44-7.42(m,2h),7.34-7.27(m,7h),7.24-7.20(m,7h),7.08-7.04(m,1h),6.91-6.85(m,2h),6.70-6.68(m,1h),6.39-6.36(m,1h),6.12-6.11(m,1h),5.41-5.31(m,1h),5.03-4.94(m,2h),4.90-4.84(m,2h),4.64-4.55(m,4h),3.02(s,3h),2.97-2.96(m,2h).
13
c nmr(100mhz,cdcl3)δ179.8,158.1,150.0,143.5,138.7,136.8,134.2,132.4,128.7,128.5,128.1,128.1,127.4,127.1,127.0,126.7,122.7,122.0,119.1,117.7,108.1,104.7,97.7,55.4,54.5,53.3,44.1,41.0.hrms(esi)m/z:[m+h]
+
calcd for c
39h37
n2o
2 565.2850;found 565.2848.
[0126]
实施例39
[0127][0128]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1f 66.3mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4faa 82.9mg,收率70%;1h nmr(400mhz,cdcl3)δ7.61-7.59(m,1h),7.44-7.42(m,2h),7.34-7.20(m,14h),7.14-7.10(m,1h),6.98-6.92(m,2h),6.86-6.80(m,2h),6.73-6.71(m,1h),5.43-5.32(m,1h),5.26-5.23(m,1h),4.99-4.95(m,1h),4.90-4.87(m,1h),4.69-4.55(m,5h),3.00-2.90(m,5h).
13
c nmr(100mhz,cdcl3)δ179.6,169.8,148.1,144.1,137.9,136.6,134.2,133.0,132.3,130.5,128.9,128.6,128.0,127.9,127.5,127.2,126.8,124.0,123.9,122.1,119.5,114.1,112.7,108.6,55.0,53.7,51.8,44.7,43.6.hrms(esi)m/z:[m+h]
+
calcd for c
40h37
n2o
3 593.2799;found 593.2796.
[0129]
实施例40
[0130][0131]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1g 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4gaa 62.5mg,收率57%;1h nmr(400mhz,cdcl3)δ7.28-7.15(m,18h),7.06-6.01(m,2h),6.87-6.85(m,1h),6.74-6.72(m,1h),5.43-5.33(m,1h),5.08-5.04(m,1h),4.96(d,j=15.8hz,1h),4.93-4.90(m,1h),4.82(d,j=15.8hz,1h),4.07-3.99(m,4h),3.13-3.08(m,1h),3.03-2.98(m,1h),2.42(s,3h).
13
c nmr(100mhz,cdcl3)δ178.5,149.4,143.0,138.6,136.1,134.4,133.6,132.8,132.1,129.8,128.8,128.7,128.3,128.0,127.6,127.5,127.0,125.3,124.7,122.5,122.1,119.3,109.3,56.7,56.1,44.0,42.1,19.1.hrms(esi)m/z:[m+h]
+
calcd for c
39h37
n2o 549.2900;found 549.2898.
[0132]
实施例41
[0133][0134]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3b 76.8mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡红色油4aab 100.4mg,收率82%;1h nmr(400mhz,cdcl3)δ7.32-7.01(m,23h),6.91-6.88(m,2h),6.68-6.60(m,3h),6.45-6.41(m,1h),5.80-5.72(m,1h),5.13(d,j=15.8hz,1h),4.66-4.57(m,4h),4.52(d,j=15.8hz,1h),3.32-3.27(m,1h),3.15-3.10(m,1h).
13
c nmr(100mhz,cdcl3)δ178.7,148.5,143.0,138.6,137.2,135.7,134.2,132.1,128.8,128.7,128.5,128.1,127.9,127.7,127.3,127.1,127.0,126.7,126.4,125.1,124.5,122.5,112.5,109.5,56.3,54.3,
44.0,41.4.hrms(esi)m/z:[m+h]
+
calcd for c
44h39
n2o 611.3057;found 611.3057.
[0135]
实施例42
[0136][0137]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3c 88.8mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡红色油4aac 112.7mg,收率88%;1h nmr(400mhz,cdcl3)δ7.33-7.19(m,13h),7.14-7.08(m,4h),7.05-7.01(m,3h),6.96-6.92(m,2h),6.76-6.74(m,2h),6.69-6.66(m,2h),6.63-6.60(m,1h),6.40-6.36(m,1h),5.66-5.57(m,1h),5.13(d,j=15.8hz,1h),4.67-4.58(m,4h),4.54(d,j=15.8hz,1h),3.76(s,3h),3.30-3.24(m,1h),3.14-3.08(m,1h).
13
c nmr(100mhz,cdcl3)δ178.7,159.0,148.5,143.1,138.6,135.8,133.6,132.2,130.1,128.8,128.7,128.0,128.0,127.7,127.5,127.3,127.1,127.0,126.7,125.1,122.5,122.2,113.9,112.5,109.4,56.4,55.4,54.3,44.0,41.5.hrms(esi)m/z:[m+h]
+
calcd for c
45h41
n2o2641.3163;found 641.3163.
[0138]
实施例43
[0139][0140]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3d 90.4mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡红色油4aad 92.8mg,收率72%;1h nmr(400mhz,cdcl3)δ7.32-6.92(m,24h),6.69-6.63(m,3h),6.38-6.34(m,1h),5.75-5.67(m,1h),5.13-5.09(m,1h),4.66-4.51(m,5h),3.31-3.25(m,1h),3.12-3.07(m,1h).
13
c nmr(100mhz,cdcl3)δ178.6,148.5,143.0,138.5,135.7,135.7,132.9,132.8,132.0,128.7,128.7,128.6,128.1,127.9,127.5,127.5,127.4,127.2,127.0,126.7,
125.2,125.1,122.5,112.5,109.4,56.2,54.3,44.0,41.3.hrms(esi)m/z:[m+h]
+
calcd for c
44h38
cln2o 645.2667;found 645.2665.
[0141]
实施例44
[0142][0143]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3e 82.4mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aae 108.8mg,收率87%,mp:113-114℃;1h nmr(400mhz,cdcl3)δ7.32-7.18(m,13h),7.13-6.97(m,7h),6.94-6.89(m,4h),6.90-6.66(m,2h),6.63-6.60(m,1h),6.43-6.38(m,1h),5.81-5.72(m,1h),5.1-5.10(m,1h),4.66-4.52(m,5h),3.32-3.25(m,1h),3.16-3.09(m,1h),2.24(s,3h).
13
c nmr(100mhz,cdcl3)δ178.7,148.5,143.0,138.6,138.0,137.1,135.7,134.4,132.1,128.7,128.7,128.4,128.1,128.0,127.9,127.7,127.3,127.2,127.1,127.0,126.7,125.1,124.2,123.4,122.5,112.5,109.4,56.3,54.3,43.9,41.4,21.4.hrms(esi)m/z:[m+h]
+
calcd for c
45h41
n2o 625.3213;found 625.3213.
[0144]
实施例45
[0145][0146]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3f 90.4mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到白色固体4aaf 96.6mg,收率75%,mp:139-140℃;1h nmr(400mhz,cdcl3)δ7.33-7.18(m,13h),7.16-7.02(m,8h),6.98-6.93(m,3h),6.69-6.64(m,3h),6.37-6.33(m,1h),5.81-5.73(m,1h),5.12(d,j=15.8hz,1h),4.67-4.58(m,4h),4.55(d,j=15.8hz,1h),3.31-3.25(m,1h),3.14-3.09(m,1h).
13
c nmr(100mhz,cdcl3)δ178.5,148.5,143.0,139.0,138.6,135.7,134.4,133.0,131.9,
129.7,128.8,128.7,128.2,127.9,127.5,127.3,127.1,127.0,126.7,126.2,126.2,125.1,124.6,122.6,112.5,109.5,56.1,54.3,44.0,41.3.hrms(esi)m/z:[m+h]
+
calcd for c
44h38
cln2o 645.2667;found 645.2667.
[0147]
实施例46
[0148][0149]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3g 82.4mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡红色固体4aag 88.7mg,收率71%,mp:145-146℃;1h nmr(400mhz,cdcl3)δ7.34-7.20(m,13h),7.14-7.0(m,9h),6.92-6.8(m,2h),6.69-6.67(m,2h),6.63-6.61(m,1h),6.57-6.53(m,1h),5.72-5.65(m,1h),5.12-5.08(m,1h),4.67-4.5(m,5h),3.32-3.27(m,1h),3.16-3.10(m,1h),2.07(s,3h).
13
c nmr(100mhz,cdcl3)δ178.7,148.5,143.1,138.6,136.5,135.7,135.5,132.6,132.2,130.2,128.8,128.7,128.1,128.0,127.6,127.3,127.2,127.0,126.8,126.0,125.9,125.9,125.2,122.5,112.5,109.5,56.4,54.4,43.9,41.7,19.7.hrms(esi)m/z:[m+h]
+
calcd for c
45h41
n2o 625.3213;found 625.3213.
[0150]
实施例47
[0151][0152]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3h 94.4mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/10]纯化得到淡黄色油4aah 113.8mg,收率87%;1h nmr(400mhz,cdcl3)δ7.33-7.29(m,4h),7.27-7.18(m,9h),7.15-7.10(m,4h),7.05-6.98(m,3h),6.68-6.62(m,4h),6.60-6.55(m,2h),6.34-6.30(m,1h),5.89(s,2h),5.61-5.54(m,1h),5.13-5.09(m,1h),4.67-4.54(m,5h),3.27-3.22(m,1h),3.12-3.07(m,
1h).
13
c nmr(100mhz,cdcl3)δ178.7,148.5,147.9,147.0,143.0,138.6,135.8,133.7,132.1,131.8,128.8,128.7,128.1,127.9,127.6,127.4,127.2,127.0,126.7,125.1,122.7,122.5,121.0,112.5,109.4,108.3,105.7,101.0,56.3,54.3,44.0,41.3.hrms(esi)m/z:[m+h]
+
calcd for c
45h39
n2o
3 655.2955;found 655.2954.
[0153]
实施例48
[0154][0155]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),(r,r)-l 8.2mg(0.012mmol),ms(100mg),cs2co3(130mg,0.4mmol)2ml dce,再加入苯胺衍生物1a 57.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2b 55.4mg(0.32mmol),烯丙基碳酸酯衍生物3b 76.8mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应3h,反应结束后减压蒸去溶剂,产物经硅胶柱层析[洗脱剂:v(乙酸乙酯)/v(石油醚)=1/7]纯化得到白色固体4abb 61.2mg,收率57%,对映选择性68%ee;1h nmr(400mhz,cdcl3)δ7.31-7.03(m,20h),6.81-6.79(m,1h),6.67-6.64(m,2h),6.34-6.30(m,1h),5.81-5.74(m,1h),4.65-4.56(m,4h),3.15-3.03(m,5h).
13
c nmr(100mhz,cdcl3)δ178.6,148.4,143.9,138.6,137.4,133.8,128.7,128.5,128.1,128.0,127.2,127.2,127.0,126.7,126.2,125.4,124.6,122.4,112.4,108.2,56.1,54.3,41.3,26.4.hplc(ia,i-proh/n-hexane=30/70,流速=1.0ml/min,i=215nm)tr=8.69min(major),12.02min(minor),68%ee.[α]
d25
:59.4
°
(c:0.1,chcl3).
[0156]
对比例1
[0157]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入n,n-二苄基-2-氯苯胺61.4mg(0.2mmol),3-重氮吲哚啉酮衍生物2a 79.7mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,一当量n,n-二苄基-2-氯苯胺转化了30%,目标产物产率小于5%。
[0158]
对比例2
[0159]
向反应管中依次加入催化剂rh2(pttl)
4 2.5mg(0.002mmol),pd2(dba)
3 4.6mg(0.005mmol),xphos 5.6mg(0.012mmol)2ml dcm,再加入n,n-二苄基苯胺54.6mg(0.2mmol),1-苄基-3-重氮-7-硝基吲哚-2-酮94.2mg(0.32mmol),烯丙基碳酸酯衍生物3a 63.2mg(0.4mmol)和2ml dcm。密封充氩气反应。反应在30℃下反应24h,一当量n,n-二苄基-2-氯苯胺转化了40%,目标产物产率小于20%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1