外源ARGs转移至块根或块茎类农作物内生菌中的评估方法
外源args转移至块根或块茎类农作物内生菌中的评估方法
技术领域
1.本发明属于农作物安全技术领域,尤其涉及一种外源args转移至块根或块茎类农作物内生菌中的评估方法。
背景技术:
2.畜禽粪便(类)有机肥料越来越多地施用于各种设施蔬菜农田,由于其富含抗生素和抗生素抗性基因(args),相应地粪源抗生素和args也被带入到农田土壤中。研究表明,与不施用畜禽粪肥农田相比,块根或块茎类农作物胡萝卜、水萝卜、马铃薯、山药、牛蒡以及红薯在施用有机粪肥的田块中检测到了更高多样性以及丰度的args。这些携带args的农作物一旦随食物链进入人体,就会对人体身体健康产生直接威胁。
3.因此,args在土壤—农作物链中的传播规律引起社会的普遍关注。由于植物本身可以吸收富集土壤中的抗生素,从而产生抗生素胁迫诱使农作物内生菌产生相应的抗性。但是目前无法判断块根(茎)类农作物内生菌抗性的产生是否也有土壤中外源args水平转移的贡献。因此,要想明确和解决此类问题,亟需开发一种能够定性和定量评估土壤中外源args转移至农作物块根(茎)类内生菌中水平的方法。
技术实现要素:
4.本发明的目的在于提供一种外源args转移至块根或块茎类农作物内生菌中的评估方法,旨在解决目前科学研究中不能定性和定量评估块根(茎)类农作物胡萝卜、水萝卜、马铃薯、山药、牛蒡以及红薯抗性内生菌是否能够获取土壤中外源args问题。
5.本发明是这样实现的,一种外源args转移至块根或块茎类农作物内生菌中的评估方法,该方法包括以下步骤:
6.(1)从块根茎类农作物种植土壤中分离土壤微生物保存、备用;
7.(2)将p.putidakt2442供体菌、以及步骤(1)保存的土壤微生物淋入栽培基质中,将农作物的块根茎类种子或种块播种在该栽培基质中培养;
8.(3)在农作物成熟期后,取其块根或块茎进行内生菌分离,做显微切片,通过激光共聚焦显微镜观察,有绿色荧光信号判断土壤中args成功转移进入农作物内生菌;对分离之后的菌群进行dna提取,pcr扩增绿色荧光蛋白基因gfp,对gfp的拷贝数进行定量以判断args转移入农作物内生菌的水平。
9.优选地,在步骤(1)中,所述土壤微生物的分离过程为:将100g土壤加入到200ml、ph7.2磷酸缓冲液中,在室温、200r/min转速下震荡12h,静置2h,取上清液过0.45μm滤膜。
10.优选地,在步骤(2)中,所述p.putidakt2442供体菌具有氨苄青霉素、卡那霉素以及四环素抗性,其抗性基因与绿色荧光蛋白gfp基因在同一广宿主型接合质粒载体rp4上;该供体菌在其染色质上被标记了红色蛋白dsred基因。在供体菌中红色荧光蛋白基因dsred能够正常表达,在激光共聚焦显微镜下(激发光561nm,发射光600~680nm)能够观察到红色荧光信号。绿色荧光蛋白基因gfp的表达在供体菌中受到抑制,但是当携带有gfp的广宿主
型接合质粒rp4转移进入其它微生物细胞中,gfp表达将不受抑制,即侵染细胞在激光共聚焦显微镜下(激发光488nm,发射光500~550nm)能够观察到绿色荧光信号。
11.优选地,所述农作物选自胡萝卜、水萝卜、马铃薯、山药、牛蒡以及红薯中的任意一种。
12.优选地,在步骤(2)中,所述栽培基质的成分为按质量比20:20:50:10的草炭、蛭石、炉渣、珍珠岩混合而成,混合后进行高温高压灭菌。
13.本发明克服现有技术的不足,提供一种土壤中外源args转移至块根或块茎类农作物内生菌中水平的评估方法。在本发明中,未添加供体菌p.putida kt2442盆栽实验,不能定性和定量表征块根(茎)类农作物胡萝卜、水萝卜、马铃薯、山药、牛蒡以及红薯等根块(茎)类抗性内生菌是否能够获取土壤中args。添加供体菌p.putidakt2442后,在盆栽实验结束,取块根(茎)样品,制作显微切片,在激光共聚焦显微镜下观察,检测到有绿色荧光信号可判断外源args成功转移进入了农产品内生菌中;分离农产品组织内微生物样品,提取内生菌dna,使用实时荧光定量pcr技术手段,对gfp基因进行定量克隆扩增,可定量判断块根(茎)样品内生菌被外源抗生素抗性基因污染的水平。
14.相比于现有技术的缺点和不足,本发明具有以下有益效果:本发明填补了目前科学研究中不能定性和定量表征胡萝卜、水萝卜、马铃薯、山药、牛蒡以及红薯等块根(茎)类农产品内生菌是否能够获取土壤中外源args的技术空白,该方法既能定性评估,又能定量评估,结果准确可靠。
附图说明
15.图1是外源args转移至农作物块茎根及块茎类农作物内生菌中水平的定性评估结果;其中,a中所示绿色荧光斑点表明外源args成功侵染红薯内生菌;b中所示绿色荧光斑点表明外源args成功侵染马铃薯内生菌;
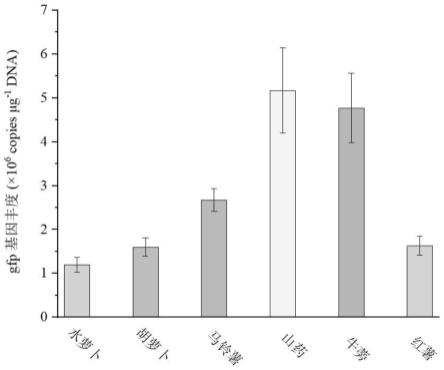
16.图2是外源args转移至块根或块茎类农作物内生菌中水平的定量评估结果。
具体实施方式
17.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
18.1、材料
19.(1)菌株
20.本发明中用到供体菌株为p.putida kt2442供体菌具有氨苄青霉素、卡那霉素以及四环素抗性,其抗性基因与绿色荧光蛋白gfp基因在同一广宿主型接合质粒载体rp4上;该供体菌在其染色质上被标记了红色蛋白dsred基因。在供体菌中红色荧光蛋白基因dsred能够正常表达,在激光共聚焦显微镜下(激发光561nm,发射光600~680nm)能够观察到红色荧光信号。绿色荧光蛋白基因gfp的表达在供体菌中受到抑制,但是当携带有gfp的广宿主型质粒rp4转移进入其它微生物细胞中,gfp表达将不受抑制,即侵染细胞在激光共聚焦显微镜下(激发光488nm,发射光500~550nm)能够观察到绿色荧光信号。
21.(2)土壤微生物准备
22.分离细菌土壤取自胡萝卜、水萝卜、马铃薯、山药、牛蒡以及红薯等根块(茎)类农作物种植土壤。取土壤100g,加磷酸缓冲液(ph 7.2)200ml,置于摇床中,转速200r/min,震荡12h,取出后静置2h,上清液7000r/min离心,离心之后的微生物群体贮存于4℃冰箱待用。
23.(3)培养基质
24.培养基质成分为草炭、蛭石、炉渣、珍珠岩按照20:20:50:10的比例混合,混合后进行高温高压灭菌,备存。
25.(4)种子或种薯块
26.挑选健康的种子或种薯块。
27.2、栽培
28.将2kg栽培基质装入花盆中,取出滤膜,将上面准备好的土壤微生物淋入进入基质中,将p.putida kt2442淋入基质中;种子或种块播种,在人工气候箱内进行培养。
29.3、内生菌分离及dna提取
30.农作物进入成熟期后,取根(茎)进行显微切片制作和内生菌分离,显微切片制作过程为:用手术刀轻轻刮取农产品块根和块茎组织,厚度在0.1mm以下。内生菌提取过程为:将50g重量左右的块根块茎先用灭菌蒸馏水进行冲刷,洗去表面的泥土。然后将块茎块茎置于超声波清洗机中,超声功率60w,水温35℃,超声清洗10分钟。取出,用灭菌蒸馏水进行冲洗3遍。清洗之后的块根或块茎放入70%酒精中浸泡3分钟,然后用次氯酸钠溶液进行清洗(cl-1
有效浓度为2.5%)。之后用灭菌的磷酸盐缓冲液(ph7.2,0.05mol/l)进行冲洗,然后置于70%酒精中浸泡3分钟,此步骤重复3次。然后用匀浆机进行匀浆,匀浆用100ml的磷酸盐缓冲液进行悬浮,然后室温下180rpm离心1h。用40μm,20μm,and 5μm孔径的纤维素膜进行梯度过滤。收集滤液,10000g离心15min,收集菌体,进行dna提取。dna提取按照市售细菌dna提取试剂盒操作说明书进行。
31.4、定性和定向评估
32.定性评估步骤为:用手术刀轻轻刮取农产品块根或块茎组织,厚度在0.1mm以下,然后置于荧光显微镜下,激发光波长488nm,发射光波长500~550nm。检测到有绿色荧光信号,证明外源args成功转移进入了农产品内生菌中。
33.定量评估步骤为:qpcr反应总体系为20μl,包括10μl 2
×
sybrpremix extaq ii(takara,japan),0.4μl引物(引物浓度10μmol/l),1μl dna模板以及8.2μl去核酸酶灭菌水。反应条件为94℃熔解30s,然后接40个循环的一下步骤:94℃熔解5s,60℃退火15s,72℃延伸15s。按照以上扩增条件,同时扩增16s rrna和gfp基因,根据16s rrna标准品拷贝数和ct计算线性回归方程。根据线性回归方程和gfp的ct值计算gfp的拷贝数,以此来定量评估外源args成功转移进入农产品内生菌中的水平。
34.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1