一种固定化转氨酶及其在西他列汀制备中的应用的制作方法
1.本发明涉及转氨酶技术领域,具体涉及一种固定化转氨酶及其在西他列汀制备中的应用。
背景技术:
2.西他列汀(sitagliptin,见以下结构)是fda批准的第一个二肽基肽酶-4(dpp-4)抑制剂,用于治疗ii型糖尿病。西他列汀通过抑制dpp-4的活性从而提高葡萄糖依赖性促胰岛素释放激素(gip)和胰高血糖素样肽-1(glp-1)的水平,后两者可以促进胰岛素的分泌来达到降低血糖的作用。西他列汀相对于传统的口服降糖药相比,具有更好的肠胃耐受性,不易引起低血糖副作用并具有改善脂肪代谢的功能。
[0003][0004]
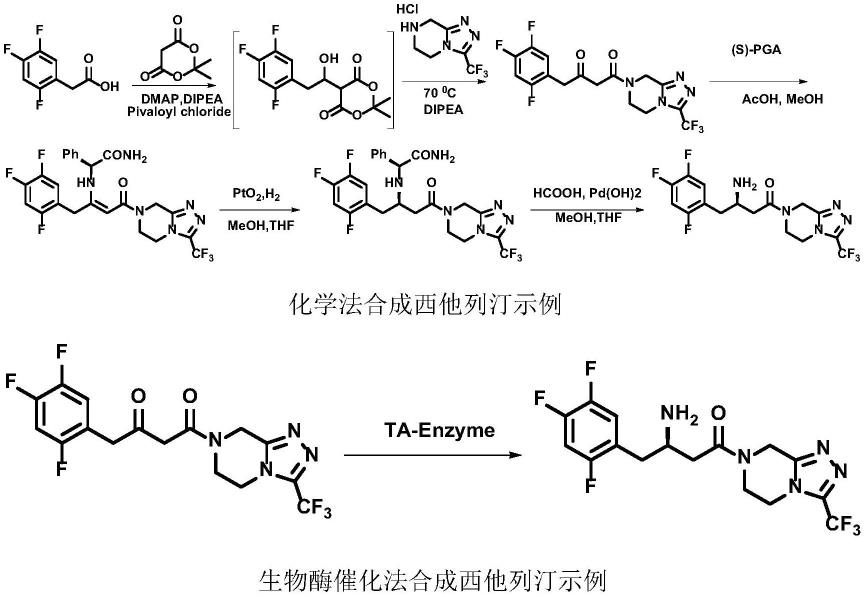
西他列汀的合成方法有化学法和生物酶催化法两种,其中化学法因步骤多,收率低,对环境不友好等诸多负面因素存在,使得其后续前景看低;而生物酶催化法可以一步高效高产率的建立单一手性中心,并且大大降低生产过程中的三废排放,是目前西他列汀绿色工艺改进的热点。目前主流的生物酶催化法合成西他列汀是建立在merck和codexis公司开发的ata117转氨酶,此酶来源于节杆菌属knk168,经过基因改造,具有很好的底物适配性和手性选择性,但是此酶目前多用于全细胞催化,导致分离纯化困难,收率偏低,发酵成本高,发酵三废排放高等诸多限制。
[0005]
技术实现要素:
[0006]
本发明的目的是提供一种固定化转氨酶及其在西他列汀制备中的应用,以解决现有技术中的不足。
[0007]
本发明采用以下技术方案:
[0008]
一种固定化转氨酶,所述固定化转氨酶为转氨酶固定于固定化载体上所得;所述转氨酶来源于假单胞菌并进行基因改造,其氨基酸序列为seq id no:1所示;所述固定化载体为树脂经多聚羟基化合物或多聚氨基化合物修饰后醛基化所得。
[0009]
进一步地,所述树脂为醛基树脂、环氧树脂或氨基树脂。
[0010]
进一步地,所述多聚羟基化合物包括聚丙三醇或聚乙烯醇;所述多聚氨基化合物包括聚乙烯亚胺或聚氨基多肽。
[0011]
进一步地,所述固定化载体为树脂经多聚羟基化合物或多聚氨基化合物修饰后醛基化所得,具体包括如下步骤:
[0012]
1质量份的树脂和2-6体积份的0.2-5wt%多聚羟基化合物水溶液于20-40℃、ph9-10、80-250rpm条件下反应1-32h进行羟基化,得到羟基化树脂;然后羟基化树脂、2-8体积份的0.2-3wt%次氯酸钠水溶液和2-8体积份的0.2-3wt%溴化钾水溶液于20-40℃、80-250rpm条件下反应1-24h氧化成醛基化树脂;
[0013]
或1质量份的树脂和2-6体积份的0.2-5wt%多聚氨基化合物水溶液于20-40℃、80-250rpm条件下反应1-32h进行氨基化,得到氨基化树脂;然后氨基化树脂和2-8体积份的0.2-5wt%戊二醛水溶液于20-40℃、ph6-9、80-250rpm条件下反应1-24h转化成醛基化树脂;
[0014]
其中,质量份以g为计量单位时,体积份以ml为计量单位。
[0015]
进一步地,所述固定化转氨酶为转氨酶固定于固定化载体上所得,具体包括如下
步骤:1质量份的固定化载体和1-8体积份的转氨酶破碎上清液在20-40℃、ph6-9、80-250rpm条件下固定化1-24h,之后用去离子水清洗,得到所述固定化转氨酶;其中,质量份以g为计量单位时,体积份以ml为计量单位。
[0016]
更进一步地,所述转氨酶破碎上清液是od
600
为0.6-0.8的转氨酶重组大肠杆菌培养物经诱导表达培养后破碎、离心得到的上清液。
[0017]
上述固定化转氨酶在西他列汀制备中的应用。
[0018]
进一步地,具体包括如下步骤:以固定化转氨酶为生物酶催化剂,以西他列汀前体酮为底物,以异丙胺为共同底物,以甲醇和二甲亚砜为助溶剂,以磷酸吡哆醛作为辅酶,以ph8-9的异丙胺+异丙胺盐酸盐为缓冲液,以上反应体系在25-50℃、70-200rpm条件下反应16-48h,反应时间包括滴加西他列汀前体酮的时间,反应结束后对反应液进行分离纯化得到西他列汀。
[0019]
更进一步地,所述反应体系中固定化转氨酶用量为50-200g/l,西他列汀前体酮终浓度为10-90g/l,甲醇和二甲亚砜终浓度为10-35v/v%,甲醇和二甲亚砜体积比1:5-4:1,磷酸吡哆醛终浓度为0.2-2.5g/l。
[0020]
更进一步地,反应结束后对反应液进行分离纯化得到西他列汀,具体包括如下步骤:将反应液先用盐酸溶液调节ph到2,加入醋酸异丙酯分离未反应原料,水相用氢氧化钠溶液调节ph到9,再加入醋酸异丙酯将产品萃取至有机相,真空浓缩。
[0021]
本发明的有益效果:
[0022]
本发明西他列汀制备使用生物酶催化法,较传统化学法减少70%以上的三废排放,手性纯度从不足97%提高至99.5%以上,并大量节约能耗、降低成本,是符合国家环保绿色理念的新一代生物合成技术。
[0023]
本发明的生物酶催化法以固定化转氨酶作为生物酶催化剂,将针对底物优化的源于假单胞菌基因改造转氨酶固定在经特定修饰的树脂上,避免了全细胞催化的诸多缺点,比如分离纯化困难,收率偏低,发酵成本高,发酵三废排放高等,制备西他列汀最高转化率》97%,手性纯度》99.5%,并且本发明固定化转氨酶的循环使用次数达到80次以上而没有明显的酶活降低,高手性选择性仍保持不变,是有着巨大工业化潜力的工艺技术。
[0024]
相较于非修饰的固定化载体,本发明以经多聚羟基化合物或多聚氨基化合物修饰后醛基化的树脂为固定化载体,其可以提供更多的结合位点,更大的结合网络空间,能够提高固定化转氨酶的酶活的稳定性和单位催化能力。
附图说明
[0025]
图1为实施例2蛋白电泳图,阴性对照是不含有转氨酶的大肠杆菌菌株,阳性单克隆(1、2、3、4和5)是含有转氨酶的重组大肠杆菌菌株。
具体实施方式
[0026]
下面结合实施例和附图对本发明做更进一步地解释。下列实施例仅用于说明本发明,但并不用来限定本发明的实施范围。
[0027]
一种固定化转氨酶,所述固定化转氨酶为转氨酶固定于固定化载体上所得。所述转氨酶来源于假单胞菌并进行基因改造(47位的亮氨酸突变成精氨酸,93位的酪氨酸突变
成苯丙氨酸,95位丙氨酸突变成赖氨酸,164位的赖氨酸突变成精氨酸,194位甘氨酸突变成半胱氨酸,238位的甘氨酸突变成丝氨酸,300位的异亮氨酸突变成半胱氨酸,360位的甘氨酸突变成缬氨酸),其氨基酸序列为seq idno:1所示(mstaerapilltpgplttsyrtrrammvdwgswdsdfneltasvcqrllki vggegshtcvplqgsgtfaveaaigtlvprdgkvlvlingafgkrlakicevlqrpfstleteenvpttaadverllaadpaishvalihcetstgilnpleaiakvverhgrrlivdamssfgaigidarkvpfdaliaasckclegvpgmgfvfarsaaleasagnchslamdlqdqhaymrktsqwrftppthvvaalhealsqyeeegglparqrryasncetllgemarlgfrsflpaeiqapcivtfhaprdpryrfadfyqrvrekgfilypgkltqvetfrvgcighvdaaemrqavaaivealrelevlei),核苷酸序列为seq id no:2所示。所述固定化载体为树脂经多聚羟基化合物或多聚氨基化合物修饰后醛基化所得。所述树脂为醛基树脂、环氧树脂或氨基树脂,优选为环氧树脂或醛基树脂。所述多聚羟基化合物包括聚丙三醇或聚乙烯醇。所述多聚氨基化合物包括聚乙烯亚胺或聚氨基多肽。
[0028]
所述固定化载体为树脂经多聚羟基化合物或多聚氨基化合物修饰后醛基化所得,具体包括如下步骤:
[0029]
1质量份的树脂和2-6体积份的0.2-5wt%多聚羟基化合物水溶液于20-40℃、ph9-10、80-250rpm条件下反应1-32h进行羟基化,得到羟基化树脂;然后羟基化树脂、2-8体积份的0.2-3wt%次氯酸钠水溶液和2-8体积份的0.2-3wt%溴化钾水溶液于20-40℃、80-250rpm条件下反应1-24h氧化成醛基化树脂;
[0030]
或1质量份的树脂和2-6体积份的0.2-5wt%多聚氨基化合物水溶液于20-40℃、80-250rpm条件下反应1-32h进行氨基化,得到氨基化树脂;然后氨基化树脂和2-8体积份的0.2-5wt%戊二醛水溶液于20-40℃、ph6-9、80-250rpm条件下反应1-24h转化成醛基化树脂;
[0031]
其中,质量份以g为计量单位时,体积份以ml为计量单位。
[0032]
所述固定化转氨酶为转氨酶固定于固定化载体上所得,具体包括如下步骤:1质量份的固定化载体和1-8体积份的转氨酶破碎上清液在20-40℃、ph6-9、80-250rpm条件下固定化1-24h,之后用去离子水清洗,得到所述固定化转氨酶;其中,质量份以g为计量单位时,体积份以ml为计量单位。所述转氨酶破碎上清液是od
600
为0.6-0.8的转氨酶重组大肠杆菌培养物经诱导表达培养后破碎、离心得到的上清液。
[0033]
上述固定化转氨酶在西他列汀制备中的应用,具体包括如下步骤:以固定化转氨酶为生物酶催化剂,以西他列汀前体酮为底物,以异丙胺为共同底物,以甲醇和二甲亚砜为助溶剂,以磷酸吡哆醛作为辅酶,以ph8-9的异丙胺+异丙胺盐酸盐为缓冲液,以上反应体系在25-50℃、70-200rpm条件下反应16-48h,反应时间包括滴加西他列汀前体酮的时间,反应结束后对反应液进行分离纯化得到西他列汀:将反应液先用盐酸溶液调节ph到2,加入醋酸异丙酯分离未反应原料,水相用氢氧化钠溶液调节ph到9,再加入醋酸异丙酯将产品萃取至有机相,真空浓缩;其中,所述反应体系中固定化转氨酶用量为50-200g/l,西他列汀前体酮终浓度为10-90g/l,甲醇和二甲亚砜终浓度为10-35v/v%,甲醇和二甲亚砜体积比1:5-4:1,磷酸吡哆醛终浓度为0.2-2.5g/l。
[0034]
本发明反应式如下:
200)水溶液,加入12g环氧树脂(天津南开和成科技有限公司,es-108)进行氨基化:在室温条件下,200rpm速度摇床氨基化20h,氨基化好的树脂用去离子水清洗三遍,得到氨基化的固定化载体(氨基化树脂)。
[0046]
实施例5:固定化载体的羟基化
[0047]
在250ml摇瓶里加入60ml5wt%的聚乙烯醇(可乐丽,mowiol 10-98)水溶液,加4wt%naoh溶液将ph调至9.5,加入12g环氧树脂(天津南开和成科技有限公司,es-108)进行羟基化:在室温条件下,200rpm速度摇床羟基化20h,羟基化好的树脂用去离子水清洗三遍,得到羟基化的固定化载体(羟基化树脂)。
[0048]
实施例6:固定化载体的羟基化
[0049]
在250ml摇瓶里加入60ml5wt%的聚丙三醇(广东翁江化学试剂,二聚丙三醇)水溶液,加4wt%naoh溶液将ph调至9.5,加入12g环氧树脂(天津南开和成科技有限公司,es-108)进行羟基化:在室温条件下,200rpm速度摇床羟基化20h,羟基化好的树脂用去离子水清洗三遍,得到羟基化的固定化载体(羟基化树脂)。
[0050]
实施例7:氨基化的固定化载体的醛基化
[0051]
在250ml摇瓶里加入60ml2wt%的戊二醛水溶液,用10wt%磷酸氢二钠/磷酸二氢钠水溶液调节ph至7.0,加入实施例3的氨基化树脂12g进行醛基化:在室温条件下,200rpm速度摇床醛基化2h,醛基化好的树脂用去离子水清洗三遍,得到醛基化的固定化载体(醛基化树脂)。
[0052]
实施例8:转氨酶的固定化
[0053]
在250ml摇瓶里加入75ml转氨酶破碎上清液(实施例2),用10wt%磷酸氢二钠/磷酸二氢钠水溶液调节ph至7.0,加入实施例7的醛基化树脂12g进行固定化:在室温条件下,200rpm速度摇床固定2h,固定好的树脂用去离子水清洗三遍,得到固定化转氨酶(转氨酶固定化树脂)。
[0054]
实施例9:羟基化的固定化载体的醛基化(羟基氧化)
[0055]
在250ml摇瓶里加入30ml1wt%的次氯酸钠水溶液和30ml1wt%的溴化钾水溶液,加入实施例5的羟基化树脂12g进行醛基化:在40℃条件下,200rpm速度摇床醛基化16h,醛基化好的树脂用去离子水清洗三遍,得到醛基化的固定化载体(醛基化树脂)。
[0056]
实施例10:转氨酶的固定化
[0057]
在250ml摇瓶里加入75ml转氨酶破碎上清液(实施例2),用10wt%磷酸氢二钠/磷酸二氢钠水溶液调节ph至7.0,加入实施例9的醛基化树脂12g进行固定化:在室温条件下,200rpm速度摇床固定2h,固定好的树脂用去离子水清洗三遍,得到固定化转氨酶(转氨酶固定化树脂)。
[0058]
实施例11:固定化转氨酶的催化
[0059]
异丙胺盐酸盐溶液:3.5m异丙胺盐酸盐的配制(ph=8.5)
[0060]
在通风橱中,称取异丙胺103.25g,加入200ml去离子水,120g30wt%盐酸,再用30wt%盐酸调ph为8.5,定容到500ml。
[0061]
溶液1:取一只洁净干燥的25ml烧杯,分别准确称量4.5g西他列汀前体酮,甲醇2.57g,二甲基亚砜3.545g,混匀。
[0062]
溶液2:取一只洁净干燥100ml烧杯,加入28.5g3.5m异丙氨盐酸盐溶液(ph=8.5),
6g甲醇,4g二甲基亚砜,混匀。
[0063]
溶液3:取一只洁净干燥100ml烧杯,分别称量20g去离子水,18.75mg的磷酸吡哆醛(plp),混匀。
[0064]
在100ml烧瓶加入12g实施例8中的转氨酶固定化树脂,加入溶液2和溶液3,搅拌均匀,测定此时瓶中溶液ph值,并用异丙胺调节ph到8.5。将烧瓶放入油浴锅加热到45℃,用注射泵吸取9ml溶液1,设置进样速度为0.3ml/h,启动注射泵往烧瓶中滴加溶液1,同时搅拌器以转速160rpm进行搅拌。30h后滴加完毕,期间补加异丙胺保持ph在8.2-8.7之间,延长2h后将转氨酶固定化树脂过滤分离,用3倍树脂体积去离子水洗涤转氨酶固定化树脂3次,反应液送液相检测,反应转化率为97.9%,手性纯度》99.5%。
[0065]
实施例12:固定化转氨酶的催化
[0066]
异丙胺盐酸盐溶液:3.5m异丙胺盐酸盐的配制(ph=8.5)
[0067]
在通风橱中,称取异丙胺103.25g,加入200ml去离子水,120g30wt%盐酸,再用30%盐酸调ph为8.5,定容到500ml。
[0068]
溶液1:取一只洁净干燥的25ml烧杯,分别准确称量4.5g西他列汀前体酮,甲醇2.57g,二甲基亚砜3.545g,混匀。
[0069]
溶液2:取一只洁净干燥100ml烧杯,加入28.5g3.5m异丙氨盐酸盐溶液(ph=8.5),6g甲醇,4g二甲基亚砜,混匀。
[0070]
溶液3:取一只洁净干燥100ml烧杯,分别称量20g去离子水,18.75mg的磷酸吡哆醛(plp),混匀。
[0071]
在100ml烧瓶加入12g实施例10中的转氨酶固定化树脂,加入溶液2和溶液3,搅拌均匀,测定此时瓶中溶液ph值,并用异丙胺调节ph到8.5。将烧瓶放入油浴锅加热到45℃,用注射泵吸取9ml溶液1,设置进样速度为0.3ml/h,启动注射泵往烧瓶中滴加溶液1,同时搅拌器以转速160rpm进行搅拌。30h后滴加完毕,期间补加异丙胺保持ph在8.2-8.7之间,延长2h后将转氨酶固定化树脂过滤分离,用3倍树脂体积去离子水洗涤转氨酶固定化树脂3次,反应液送液相检测,反应转化率为91.6%,手性纯度》99.5%。
[0072]
实施例13:固定化转氨酶的催化套用
[0073]
按照实施例11的试验方法进行重复,仅仅将新转氨酶固定化树脂换成实施例11中已经使用并清洗的转氨酶固定化树脂,得到反应液送液相检测,反应转化率为97.8%,手性纯度》99.5%。
[0074]
实施例14:固定化转氨酶的催化套用
[0075]
按照实施例12的试验方法进行重复,仅仅将新转氨酶固定化树脂换成实施例12中已经使用并清洗的转氨酶固定化树脂,得到反应液送液相检测,反应转化率为90.6%,手性纯度》99.5%。
[0076]
实施例15:固定化转氨酶的催化套用
[0077]
按照实施例11的试验方法进行重复,仅仅将新转氨酶固定化树脂换成实施例11套用50次并清洗的转氨酶固定化树脂,得到反应液送液相检测,反应转化率为93.2%,手性纯度》99.5%。
[0078]
实施例16:固定化转氨酶的催化套用
[0079]
按照实施例11的试验方法进行重复,仅仅将新转氨酶固定化树脂换成实施例11套
用80次并清洗的转氨酶固定化树脂,得到反应液送液相检测,反应转化率为86.0%,手性纯度》99.5%。
[0080]
通过上述实施例证明转氨酶固定化树脂在高达80次套用后仍保留很高的酶活,其中套用50次后仍有初始的95%酶活,套用80次后仍有初始88%酶活,稳定性很好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1