一种重组大肠杆菌生产L-高丝氨酸的发酵工艺
本发明涉及生物发酵,尤其涉及一种重组大肠杆菌生产l-高丝氨酸的发酵工艺。
背景技术:
1、l-高丝氨酸(l-homoserine,2-amino-4-hydroxybutyricacid,hs),属于l-天冬氨酸家族非天然氨基酸,是合成必需氨基酸l-苏氨酸,l-甲硫氨酸和l-异亮氨酸的前体物。作为重要的平台化合物,l-高丝氨酸还被用于o-乙酰高丝氨酸、高丝氨酸内酯、异丁醇和γ-丁内酯等高附加值化合物的合成。l-高丝氨酸还具有提高植物抗逆性、促进家禽生长的功能。由此可见,l-高丝氨酸有望广泛应用于食品、医疗及农业等领域。
2、目前l-高丝氨酸的主要生产方式为化学合成,包括甲硫氨酸法、丁内酯法,但因反应过程中所使用的试剂价格昂贵,反应时间长或者提纯步骤繁琐等因素限制了其发展。生物法具有绿色高效,底物廉价易得等优势备受人们的关注。
3、2016年,江南大学李华等通过敲除大肠杆菌w3110l-高丝氨酸竞争代谢支路和降解途径上的lysa、thrb、thrc和meta基因,并通过质粒pbr322过表达代谢途径中的metl基因,同时对l-高丝氨酸的运输系统进行了进一步的改造,最终在15l发酵罐中发酵得到39.54g/l的l-高丝氨酸;2019年,华东理工大学魏东芝团队同样通过敲除竞争和降解途径同时结合对中心代谢途径的改造获得高丝氨酸高产菌株ijl12,分批补料发酵产量达35.8g/l;2021年,北京微生物研究所于波团队采用还原力平衡控制的方式,在竞争和降解途径解除的生产菌株中实现84.1g/l的高丝氨酸生产;申请人的在先专利cn109055290b也提供了一种高产l-高丝氨酸的重组大肠杆菌。以上所述生产l-高丝氨酸的重组大肠杆菌都面临着共性问题,即底盘菌始终面临必需氨基酸缺陷的问题。菌株必需氨基酸缺陷会造成罐内控制工艺控制复杂、生产重现性较差的问题。
4、尽管高丝氨酸底盘改造在一定程度上实现了高丝氨酸的高产,但尚未达到工业化应用标准,需要进一步解决发酵工艺的问题。因此,针对高丝氨酸底盘菌必需氨基酸生物合成途径敲除的问题,开发一种能够缩短发酵周期、优化生长性能并提高发酵产量的发酵工艺是本领域技术人员需要解决的问题。
技术实现思路
1、高丝氨酸底盘细胞敲除了必须氨基酸生物合成基因,会存在发酵进程中菌体生产与生长难以控制的问题。同时,通过培养基中添加缺陷型氨基酸的方式去解决敲除必须氨基酸生物合成基因造成的影响,但仍存在生长过程缺陷氨基酸供应量不足的问题,影响发酵过程菌体生长进而影响产量。
2、针对此,本发明提供了一种重组大肠杆菌生产l-高丝氨酸的发酵工艺。本发明的目的是通过发酵工艺优化,改善氨基酸缺陷株的高丝氨酸生产发酵方法,提高生物量和产量,同时缩短发酵周期的发酵调控工艺。
3、本发明的具体技术方案为:
4、本发明提供了一种重组大肠杆菌生产l-高丝氨酸的发酵工艺,在该工艺中,以生产l-高丝氨酸的重组大肠杆菌为生产菌株发酵培养,发酵过程控制以下参数:
5、(1)ph及温度:ph维持在6.6~7.0,温度维持在30~32℃。
6、(2)葡萄糖含量:葡萄糖含量为0.1~5g/l。
7、(3)od600值:菌体进入停滞期,脉冲式定量流加氨基酸,并使od600值在30~50范围。
8、(4)do值:体系do值第一次下降至9~12%,此后维持do值在9~12%。
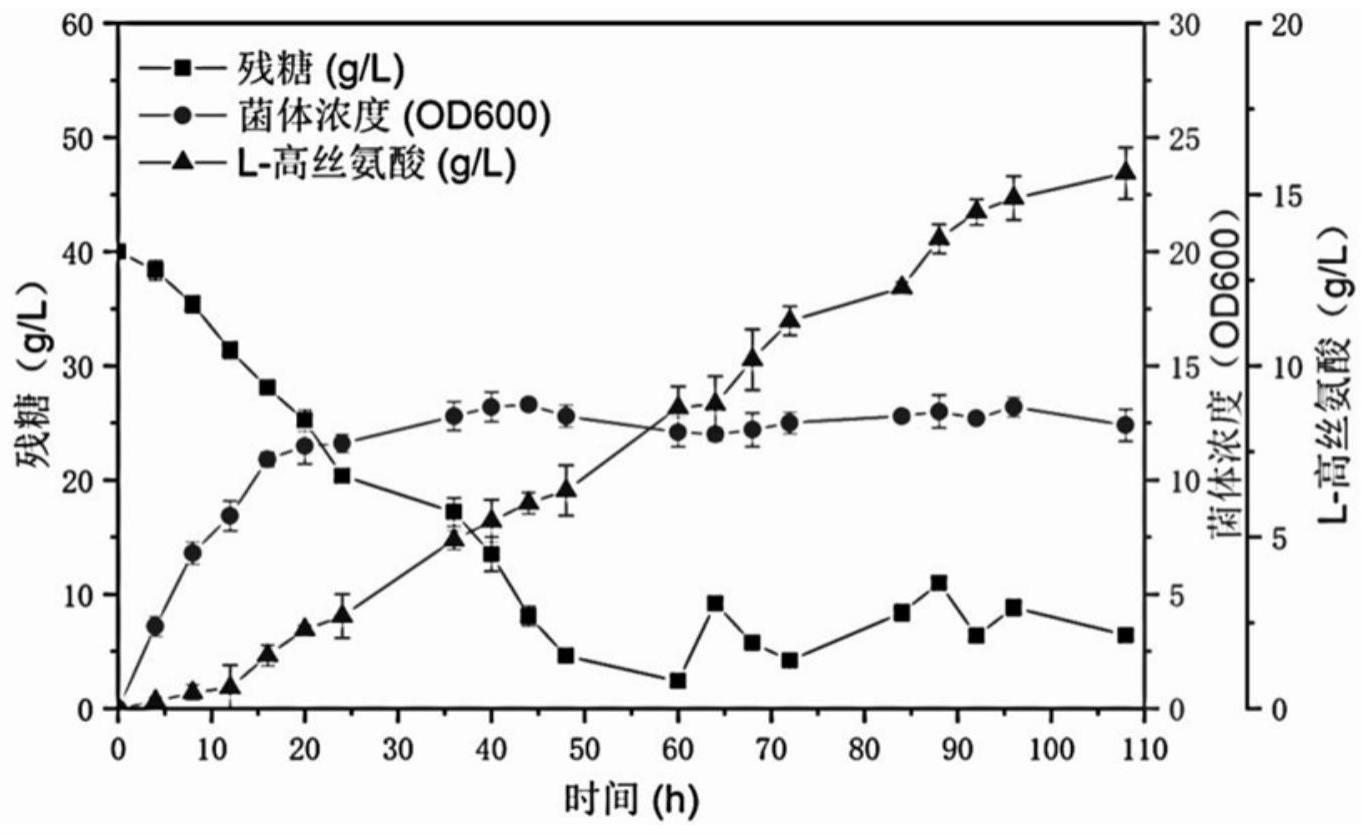
9、与现有重组大肠杆菌生产l-高丝氨酸的发酵工艺不同,本发明提供的重组大肠杆菌生产l-高丝氨酸的发酵工艺主要针对现有重组大肠杆菌生产l-高丝氨酸发酵工艺过程中存在的发酵进程中菌体生长难以控制、进而高产量难以重现的问题。本发明通过使发酵过程中的ph、温度、葡萄糖含量、od600值及do值控制在一定范围内,最终使菌体生长的各个阶段都可以保持最佳生产状态,实现发酵进程中菌体生长的控制,最终提升l-高丝氨酸的产量。本发明提供的发酵工艺能够在70h内的发酵过程,得到产量为75g/l的l-高丝氨酸,且该高产量重现性好。
10、在本发明提供的发酵工艺中,通过①控制ph及温度、②控制葡萄糖含量、③控制od600值及④控制do值这四个方面才能使菌体生长的各个阶段保持最佳生产状态,以此达到高产量的重现。如果有任意一个方面不符合,产量均有可能大打折扣。具体而言:
11、关于第①方面,ph的变化是菌体在发酵过程中代谢活动的综合反映,当ph超出一定范围,菌体就会失去调节能力,发酵液的ph失去自身调节后会不断地波动,而发酵液ph的波动又会反过来影响菌体本身及其ph调节能力。引起ph波动的原因除了取决于菌体自身的代谢外,还与周围环境有关,如培养基。在本发明重组大肠杆菌生产l-高丝氨酸的发酵体系中,综合菌体本身及培养环境,将ph维持在6.6~7.0能使菌体处于最好的生产状态。而温度30~32℃能使ph为6.6~7.0环境下的菌体生产最优化。
12、关于第②方面,葡萄糖浓度控制在0.1~5g/l,使葡萄糖在整个发酵过程中浓度均一,有利于菌体生长代谢提高产量,而该葡萄糖浓度是依赖于第①方面的ph及温度范围的。若是一次性补入大量葡萄糖,菌体生产初期,便以较大的生长速度生长,最终细胞密度过大,不利于菌体生长代谢,同时,后期葡萄糖含量低,无法满足菌体生长代谢的需要,造成产量低。
13、关于第③方面,采用脉冲式定量流加氨基酸的方式控制体系的od600值使其在30~50范围,可以使碳通量更多地流向细胞代谢,发酵高产l-高丝氨酸,同时,在此范围内,发酵流变学性质好。若氨基酸浓度过高,会造成碳通量流向细胞生长,流向细胞代谢的碳通量减少,l-高丝氨酸产量减少;除了流向细胞代谢的碳通量减少外,并会造成细胞密度过大,对细胞代谢起到进一步的阻碍作用。若氨基酸浓度过低,由于菌株为氨基酸缺陷型,氨基酸缺少不利于菌体生长代谢。
14、关于第④方面,使发酵体系do值第一次下降至9~12%,此后维持do值在9~12%。l-高丝氨酸生物合成分为aspa和aspc途径,通过溶氧反馈使体系do值在9~12%下,可以驱使细胞代谢通过更高效的aspc途径合成高丝氨酸,从而提升发酵产量。并结合第②及③方面的细胞密度控制作用,使得菌体生长的各个阶段都可以保持最佳生产状态。
15、作为本发明上述技术方案的优选,重组大肠杆菌为大肠杆菌hs33。
16、大肠杆菌hs33已在文献multiplex design ofmetabolic networkforproduction of l-homoserine in escherichia coli[j].applied andenvironmentalmicrobiology.2020,86(20)e01477-20.中披露,由浙江工业大学微生物菌种保藏室提供。值得注意的是,本发明上述技术方案优选但不仅限于大肠杆菌hs33基因工程菌。本发明中所述重组大肠杆菌还可以是蛋氨酸、赖氨酸和/或苏氨酸缺陷型菌株。
17、作为本发明上述技术方案的优选,ph用氨水维持。优选地,氨水的浓度为45~55wt%。
18、作为本发明上述技术方案的优选,所述定量流加氨基酸包括流加苏氨酸、蛋氨酸和赖氨酸。
19、作为本发明上述技术方案的优选,所述定量流加氨基酸每次流加的量为10ml。
20、作为本发明上述技术方案的优选,所述维持do值通过溶氧反馈补料实现。当所述do值大于10%时,流加补料培养基。
21、低氧条件下的溶氧反馈控制,可以驱使细胞代谢通过更高效的aspc途径合成高丝氨酸,从而提升发酵产量。
22、作为本发明上述技术方案的优选,补料培养基的组成为:葡萄糖500g/l,kh2po412.5g/l,(nh4)2so410 g/l,苏氨酸4g/l,l-蛋氨酸0.5g/l,l-赖氨酸1g/l,金属离子2ml/l,甜菜碱2g/l,vb122 mg/l,vb15 mg/l,溶剂为水,ph自然。
23、作为本发明上述技术方案的优选,发酵培养基组成为:葡萄糖15g/l,(nh4)2so417g/l,yeast extract 4g/l,kh2po41 g/l,mgso40.5 g/l,feso4·7h2o 0.005g/l,mnso4·7h2o 0.005g/l,znso40.005 g/l,苏氨酸0.4g/l,蛋氨酸0.125g/l,赖氨酸0.25g/l,vb122mg/l,vb15mg/l,甜菜碱2g/l,消泡剂1ml/l,溶剂为水,ph自然。
24、与现有技术相比,本发明具有以下技术效果:
25、(1)本发明提供的l-高丝氨酸的发酵工艺通过使发酵过程中的ph、温度、葡萄糖含量、od600值及do值控制在一定范围内,能使菌体生长的各个阶段都可以保持最佳生产状态,实现发酵进程中菌体生长的控制。
26、(2)本发明提供的l-高丝氨酸的发酵工艺产量高,并且高产重现性好。
27、(3)本发明提供的l-高丝氨酸的发酵工艺通过低溶氧、残糖和ph控制,可以有效解决生产过程副产物积累的问题,提升l-高丝氨酸的产量。
- 还没有人留言评论。精彩留言会获得点赞!