一种诱导原代输卵管上皮细胞定向分化为纤毛细胞的方法
本发明涉及生物,尤其是涉及一种诱导原代输卵管上皮细胞定向分化为纤毛细胞的方法。
背景技术:
1、卵泡液是女性体内的正常生理性液体,含有丰富的类固醇激素、细胞因子、ros、前列腺素和蛋白水解酶等多种物质,有关卵泡液作用于输卵管的研究相对较少,而且其研究方向主要集中在与癌变相关的方面,几乎没有卵泡液对输卵管上皮细胞(fallopian tubeepithelial cells,以下简称ftecs)本身生理特性及分化的研究。
2、相关研究中使用永生化的ftecs和携带驱动突变累积严重的高级别浆液性卵巢癌细胞(high-grade serous carcinoma,以下简称hgsoc)来探索卵泡液在hgsoc发展中的作用,结果表明卵泡液中的igf2、hgf等因子会导致ftecs恶性转化、增殖,并可转移到卵巢和腹膜形成hgsoc。然而相关技术中,对于如何高效利用卵泡液或其他激素类物质诱导原代输卵管上皮细胞分化为纤毛细胞的研究尚未报道。
3、因此,亟需寻求一种能够高效诱导原代输卵管上皮细胞分化为纤毛细胞的方法。
技术实现思路
1、本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出了一种诱导原代输卵管上皮细胞定向分化为纤毛细胞的方法,其培养的获得的纤毛细胞分化程度高、具有与体内生理状态相似的生理特征,且能够在体外长期维持。
2、本发明的一种诱导原代输卵管上皮细胞定向分化为纤毛细胞的方法,包括以下步骤:
3、步骤s1、获取原代输卵管上皮细胞;
4、步骤s2、将所述原代输卵管上皮细胞与含血清的5mix培养基混合制备细胞悬浮液,然后接种至细胞培养小室的上室,并在所述细胞培养小室的下室加入含血清的dmem/f12培养基,培养至细胞贴壁;
5、步骤s3、待所述细胞贴壁后,将所述上室和所述下室中的培养基替换为无血清的5mix培养基,并继续培养至细胞达到90%以上融合;
6、步骤s4、去除所述上室和所述下室中的培养基,并在所述下室中加入含雌激素的5mix培养基或含卵泡液的5mix培养基进行气液界面培养10~15天即可;
7、其中所述5mix培养基是在dmem/f12培养基的基础上添加b27添加剂、glutamax添加剂、表皮生长因子、尼克酰胺和tgf-β受体激酶抑制剂得到。
8、根据本发明实施例的方法,至少具有如下有益效果:
9、(1)本发明基于气液界面培养方法可以更好的模拟出细胞在体内的生长状况,形成与体内组织相似的组织结构和生理功能的假复层柱状上皮,允许分离和共培养原代输卵管分泌细胞和纤毛细胞,并保留原生输卵管上皮的形态和生物学特性。
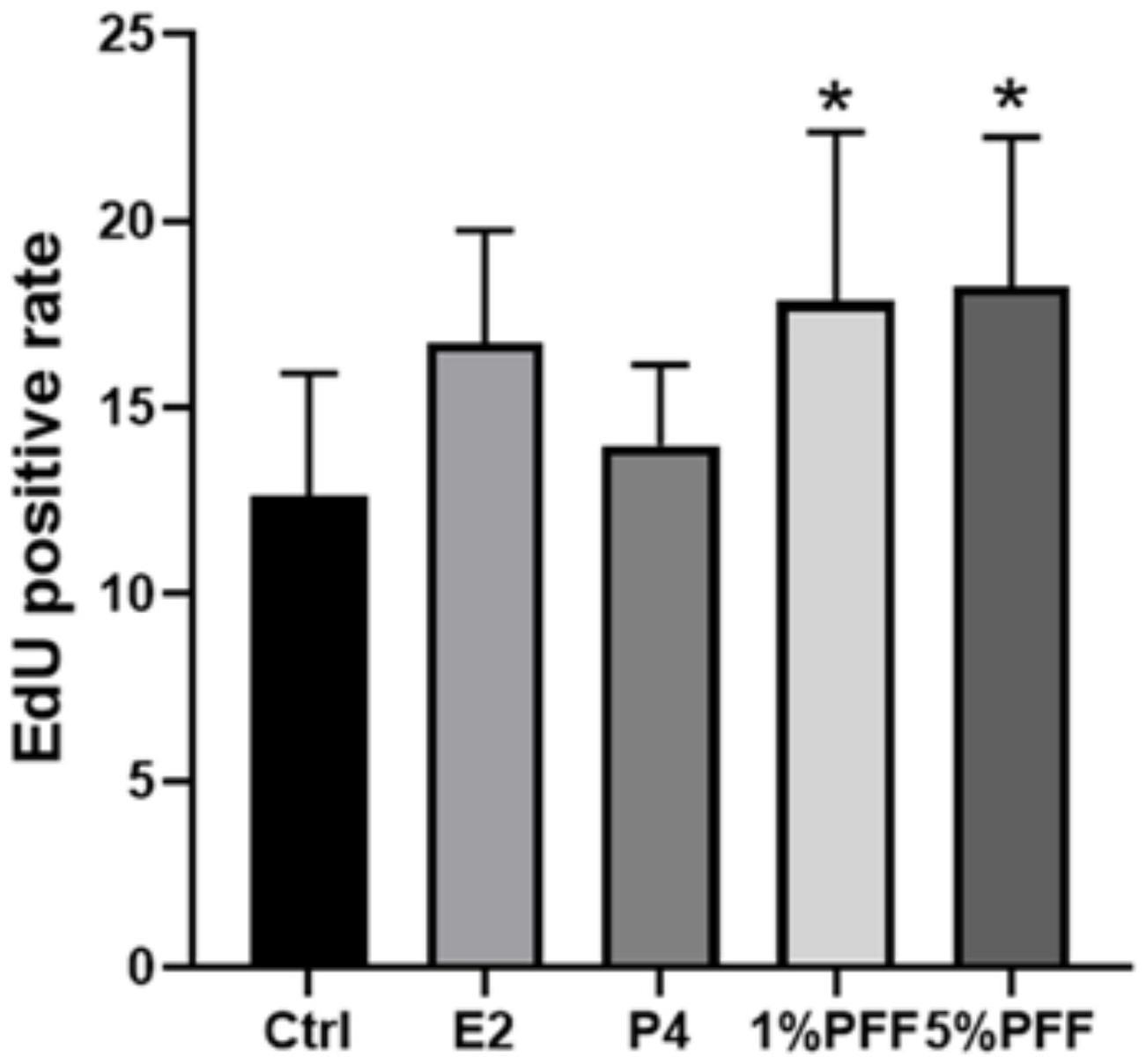
10、(2)本发明通过添加雌激素或卵泡液有效提高了原代输卵管上皮细胞定向分化为纤毛细胞的分化程度。本发明通过荧光染色试验表明在分化培养过程中添加一定含量的雌激素(estrogen,以下简称e2)和pff有助于纤毛细胞的形成。
11、(3)在本发明方法中细胞培养前期采用的是含血清的5mix培养基,由于血清里含利于细胞生长增殖的激素及生长因子,因此有助于细胞贴壁,而在细胞分化培养后期替换为无血清的5mix培养基,这主要是由于一直采用含血清的培养基培养会使细胞失去它原有的特性,甚至变成成纤维细胞,而在培养后期去除血清可以避免其对后续细胞的增殖分化带来影响。
12、在本发明的一些实施方式中,所述获取原代输卵管上皮细胞的方法包括:刮取输卵管内腔上皮细胞层,依次置于含胶原酶和dnaseⅰ的dmem/f12培养基中进行消化处理,然后收集细胞悬液,离心,得到原代输卵管上皮细胞。
13、采用本发明的方法获得的原代输卵管上皮细胞活性高,且由于本发明方案采用的是原代输卵管上皮细胞,因此其相对于使用传统的传代ftecs系基因完整性更好,培养出来的细胞也更具有与体内生理状态相似的生理特征。
14、在本发明的一些实施方式中,所述细胞培养小室为transwell细胞培养小室或millicell细胞培养小室。
15、在本发明的一些实施方式中,所述细胞培养小室的上室与下室之间通过聚碳酸酯膜间隔隔。
16、在本发明的一些实施方式中,所述胶原酶选自胶原酶ⅰ、胶原酶ⅱ和胶原酶ⅳ中的至少一种。
17、在本发明的一些实施方式中,所述胶原酶的浓度为80~100u/ml;具体的,所述胶原酶ⅳ的浓度可以为100u/ml。
18、在本发明的一些实施方式中,所述dnaseⅰ的浓度为8~12μg/ml;具体的,所述dnaseⅰ的浓度可以为10μg/ml。
19、在本发明的一些实施方式中,步骤s2中,所述细胞悬浮液中原代输卵管上皮细胞的细胞密度为6×102~8×102个细胞每微升。
20、在本发明的一些实施方式中,步骤s2中,所述含血清的5mix培养基中所述血清为胎牛血清;
21、优选地,所述血清的体积含量为8~12%。
22、在本发明的一些实施方式中,步骤s3中,换为无血清的5mix培养基后继续培养至细胞达到95%以上融合;优选地,继续培养至细胞达到100%融合。
23、如果细胞的融合度过低易造成细胞脱落甚至死亡,因此在培养过程中需要尽量培养至细胞长满后再进行加药等后续实验。
24、在本发明的一些实施方式中,步骤s4中,所述含雌激素的5mix培养基中所述雌激素的浓度为1~3ng/ml;
25、优选地,所述含雌激素的5mix培养基中雌激素的浓度为2ng/ml。
26、在本发明的一些实施方式中,所述含卵泡液的5mix培养基中所述卵泡液的体积含量为1~10%。
27、过高的卵泡液会对细胞带来不利影响,比如造成细胞从小室上脱落甚至死亡,因此需要将其控制在一定范围内,以便于充分发挥诱导细胞增殖及分化功能。
28、优选地,所述含卵泡液的5mix培养基中所述卵泡液的体积含量为3~8%;
29、优选地,所述含卵泡液的5mix培养基中所述卵泡液的体积含量为1~5%;
30、更优选地,所述含卵泡液的5mix培养基中所述卵泡液的体积含量为5%。
31、在本发明的一些实施方式中,所述原代输卵管上皮细胞与所述卵泡液来源于同一种属。
32、优选地,所述原代输卵管上皮细胞与所述卵泡液均来源于猪、牛、马、羊中的至少一种。
33、更优选地,所述原代输卵管上皮细胞与所述卵泡液可均来源于猪。
34、采用同一种属的原代输卵管上皮细胞与卵泡液能够降低排异反应,有助于提高分化效果。
35、在本发明的一些实施方式中,所述卵泡液为青春期发情前期的母猪卵巢卵泡液。
36、在本发明的一些实施方式中,步骤s4中,所述培养的过程中每2~3天更换一次新鲜培养基。
37、具体的,所述新鲜培养基是指含雌激素的5mix培养基或含卵泡液的5mix培养基;当采用含雌激素的5mix培养基进行气液界面培养时,所述新鲜培养基指含雌激素的5mix培养基;当采用含卵泡液的5mix培养基进行气液界面培养时,所述新鲜培养基指含卵泡液的5mix培养基。
38、在本发明的一些实施方式中,所述5mix培养基中,所述b27添加剂的体积含量为1~3%;具体的,所述5mix培养基中,所述b27添加剂的体积含量可以为2%。
39、在本发明的一些实施方式中,所述5mix培养基中,所述glutamax添加剂的体积含量为0.5~2%;具体的所述glutamax添加剂的体积含量可以为1%。
40、在本发明的一些实施方式中,所述5mix培养基中,所述表皮生长因子的浓度为8~12ng/ml;具体的所述表皮生长因子的浓度可以为10ng/ml。
41、在本发明的一些实施方式中,所述5mix培养基中,所述尼克酰胺的浓度为0.5~1.5mmol/l;具体的,所述尼克酰胺的终浓度可以为1mm。
42、在本发明的一些实施方式中,所述5mix培养基中,所述tgf-β受体激酶抑制剂的浓度为0.2~1μmol/l;具体的所述tgf-β受体激酶抑制剂的终浓度可以为0.5μm。
43、在本发明的一些实施方式中,所述tgf-β受体激酶抑制剂可以为sb431542。
44、在本发明的一些实施方式中,所述培养的温度均为37±2℃,所述培养过程中co2体积含量为4~6%。
45、本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。
- 还没有人留言评论。精彩留言会获得点赞!