用于从基于三酰基甘油的油中去除叶绿素衍生物的二氧化硅吸附剂处理的制作方法
用于从基于三酰基甘油的油中去除叶绿素衍生物的二氧化硅吸附剂处理
1.相关申请的交叉引用本技术要求于2019年3月27日提交的美国临时申请序列号62/824,636的优先权利益,所述美国临时申请的全部内容引入本文作为参考。
技术领域
2.本公开内容涉及用于处理包含叶绿素衍生物的油的方法。特别地,本公开内容涉及用于从油中去除包括叶绿素衍生物和/或痕量金属在内的杂质的改善方法,并且涉及用于该方法中的改善的基于二氧化硅的吸附剂。
3.序列表本技术含有已以ascii形式电子方式提交,并且在此整体引入作为参考的序列表。于2019年3月26日创建的所述ascii副本命名为
‘
35893
‑
513_seq_list.txt’且大小为36,864字节。
背景技术:
4.从压榨或溶剂提取方法获得的粗制三酰基甘油油是三酰基甘油、磷脂、固醇、生育酚、二酰基甘油、游离脂肪酸、痕量金属、叶绿素、β
‑
胡萝卜素和其它微量化合物的复杂混合物。期望去除磷脂、游离脂肪酸、痕量金属、叶绿素和β
‑
胡萝卜素,以便生产具有淡味、浅色和长贮存期限的优质完全精炼油或色拉油。
5.磷脂的去除生成与三硝基甘油油的精炼相关的最大量的中性油损失。叶绿素的去除生成与基于三硝基甘油的油精炼相关的第二大量的中性油损失。
6.几种不同的技术可以用于磷脂去除,包括水脱胶、酶辅助水脱胶、酸脱胶、苛性碱精炼和酶促处理。
7.水脱胶通常应用于含有大量可水合磷脂的粗制油。由于其温和的特征,所获得的磷脂可以用作卵磷脂(天然乳化剂)。尽管仅是部分脱胶的,但从这种技术获得的油在行业中一般被称为“脱胶的”。由于水脱胶油仍含有大量磷脂,尤其是不可水合的磷脂,因此可能需要使用其它工艺技术,例如苛性碱精炼或磷脂酶a(pla)酶脱胶,以生产具有高稳定性和低颜色的成品高品质油。
8.在水脱胶工艺中,伴随混合将水加入粗制油中,以帮助油中存在的磷脂的水合。磷脂或“胶质”的水合作用促使胶质膨胀并凝聚为絮凝剂,其随后与油的剩余部分分开。来自水脱胶工艺的油损失可能是显著的,对精炼油工艺成本的总体经济平衡具有负面影响。
9.酶辅助水脱胶通常应用于含有大量可水合磷脂的粗制油,其中目标是使所有可水合磷脂反应并且将其转换成二酰基甘油,增加油产率,同时维持油中不可水合的磷脂。用于该工艺的酶是磷脂酶c(plc)和磷脂酰肌醇磷脂酶(pi
‑
plc)。
10.在酶辅助水脱胶工艺中,伴随混合将水和plc加入粗制油中。然后允许酶伴随剪切混合与油中的磷脂反应,以帮助油中的磷脂酰胆碱(pc)、磷脂酰乙醇胺(pe)和pi转换为二
酰基甘油。重相(水、变性蛋白质和磷化合物)具有的比重高于油的比重,并且可以通过沉降、过滤或离心的工业实践进行分离。酶辅助水脱胶工艺占优势地仅去除可水合的磷脂。作为磷脂酸的盐测量的剩余磷脂可以在后续加工操作中去除。
11.当目标是磷脂的完全去除时,酸脱胶通常应用于粗制油。所获得的油在行业中通常称为“超级脱胶的”或“完全脱胶的”。粗制油用磷酸或柠檬酸进行处理。酸改善了不可水合的磷脂(nhp)的亲水性,因此帮助其去除。然后将水加入酸处理的粗制油中,并且将油混合以帮助磷脂的水合。磷脂或“胶质”的水合作用促使胶质膨胀并凝聚为絮凝剂,其随后被去除。酸脱胶工艺去除了大部分磷脂,但脱胶油中仍保留足够的磷脂需要另外的加工。如水脱胶工艺中,一些油被乳化且被视为工艺损失,对精炼油工艺成本的总体经济平衡具有负面经济影响。
12.当目标是去除所有磷脂和游离脂肪酸时,苛性碱精炼通常应用于粗制油或水脱胶油。粗制油或水脱胶油用磷酸或柠檬酸进行处理。酸改善了nhp的亲水性,从而有助于其去除。将稀释的氢氧化钠溶液加入酸处理的油中。苛性碱溶液中和游离脂肪酸(产生钠皂),中和过量的酸,并且伴随产生的钠皂,帮助水合且乳化所有剩余的磷脂。将氢氧化钠溶液/油混合,然后通过沉降、过滤或在工业上通过离心分离。然后将苛性碱处理的油“洗涤”并再次离心。来自离心机的油称为“精炼一次的”,且水通常称为“洗涤水”。对于食物应用,“精炼一次的”油通常经受漂白和除臭,以生产色拉油。水洗涤的替代方法是用吸附剂硅胶处理苛性碱处理的油,并且过滤出在初始离心中未去除的残留皂和磷脂。
13.当目标是磷脂的完全去除时,使用“酶促精炼”或“酶促脱胶”。一般地,现有技术的酶促脱胶处理已对先前已通过其它方法之一(通常为水脱胶)脱胶的油进行实践。对于食物应用,酶脱胶油序贯地经受漂白和除臭,在行业中称为“物理精炼”的工艺。酶促脱胶提供了比水、酸或苛性碱脱胶更好的油产率,具有改善的经济结果。
14.酶促反应改变了磷脂的性质,切割了一些磷脂部分。这减少了磷脂的乳化特性,使得当胶质与油分开时,损失更少的油,因此节省油。对磷脂显示出活性的酶通常称为“磷脂酶”。磷脂酶的类型基于酶对其反应的磷脂分子上的位置,并且称为pla1、pla2、plc和pld。不同类型的磷脂酶与磷脂反应后产生不同的化合物。
15.具有磷脂酶活性的商业pla1酶是lecitase
®ꢀ
ultra和quaralowp。具有磷脂酶活性的商业pla2酶是rohalase xtra和lysomax。已知这些产品当在4.5<ph<7.0和40℃<t<55℃下与脱胶油和1
‑
1.5%水柠檬酸
‑
naoh缓冲液混合时,产生极性溶血磷脂和极性脂肪酸。pla1选择性水解与甘油主链上的磷酸官能团相对的脂肪酸,并且pla2选择性水解在磷脂的甘油主链中心的脂肪酸。pla对于它们与之反应的磷脂是非选择性的。
16.所得到的反应产生溶血磷脂和脂肪酸。溶血磷脂分子已丧失一个亲水性官能团,并且在反应部位处剩余的醇基是亲水性的。现在具有两个亲水位点,溶血磷脂分子是水溶性的,并且已丧失其乳化特性。因此,pla1或pla2脱胶工艺通过不再用胶质去除任何中性油减少了精炼损失,并且唯一的损失是原始磷脂分子。
17.本领域已知plc酶通过选择性水解磷酸官能团而与磷脂反应。所得到的反应产生二酰基甘油(“dag”)和磷脂基团。二酰基甘油分子不再具有磷酸官能团,并且无需被去除。plc脱胶工艺通过保留原始磷脂分子,同时仅去除磷酸官能团来减少精炼损失。然而,plc并不与油中存在的所有磷脂反应。一般地,plc并不与磷脂酸(pa)或磷脂酰肌醇(pi)反应。与
plc组合使用的pi
‑
plc使得pc、pe和pi的反应和去除成为可能。然而,不可水合的磷脂在水脱胶后仍保留在油中。因此,酶促辅助水脱胶处理的油必须进一步用苛性碱进行处理,以去除残留的胶质,或者可以进一步用pla1或pla2进行处理。
18.来自油籽如大豆和卡诺拉(canola)以及油果实如棕榈和藻类来源油的三酰基甘油油含有叶绿素。叶绿素在油生产方法的许多阶段过程中被去除,所述阶段包括种子压碎、油提取、脱胶、苛性碱处理和漂白步骤。在这些步骤的最后,漂白工艺残留的叶绿素被去除,以达到可接受的水平。这种叶绿素通常在漂白工艺步骤中从油中去除,涉及加热油并使其运行通过吸附剂,以去除影响成品油的外观和/或稳定性的叶绿素和其它有色化合物。
19.高水平的叶绿素色素赋予不期望的颜色,并且在贮存过程中诱导油的氧化,导致油的变质。在食用油加工业中,采用漂白步骤将叶绿素水平降低到低至0.02 ppm,以保证在颜色和感官特性方面的油品质。由于夹带在漂白粘土中,这一漂白步骤增加了加工成本并减少了油产率。然后,“废”粘土必须进行环境处置,并且由于大约30重量%的酸处理材料和吸附油的自燃性质而成为危险运输材料。
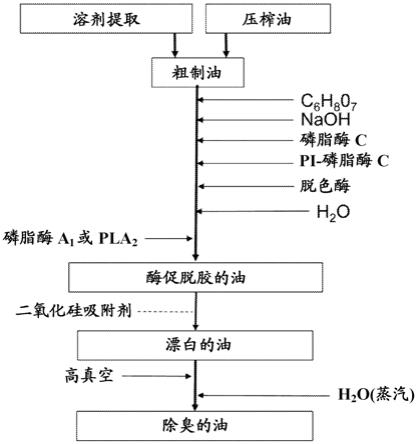
20.通过来自卟啉(氯)环的镁离子丧失,叶绿素在油加工过程中被修饰成称为脱镁叶绿素的衍生物(参见图1)。通常,在加工过程中,脱镁叶绿素在油中比叶绿素更丰富。脱镁叶绿素可以进一步降解成焦脱镁叶绿素(参见behavior of chlorophyll derivatives in canola oil processing”,jaocs,第9卷,1993年9月,第837
‑
841页)。焦脱镁叶绿素占优势地在植物油的加工过程中形成(参见例如,
‘
the lipid handbook’编辑frank d. gunstone,john l. harwood,albert j. dijkstra. 2007
‑‑
第3版,第56页)。叶绿素、脱镁叶绿素和焦脱镁叶绿素以a型和b型两种形式存在。a组分具有在c7位置处的甲基。b组分具有在c7位置处的醛。
21.根据wo2010/143149和wo2013/160372,已知使用酶用于去除植物油中的焦脱镁叶绿素。wo2010/143149公开了使用例如衍生自小麦(triticum aestivum)和莱茵衣藻(chlamydomonas reinhardtii)的能够水解焦脱镁叶绿素的酶,用于处理含有焦脱镁叶绿素的组合物的方法。wo2013/160372公开了例如来自拟南芥(arabidopsis thaliana)和小麦的几种叶绿素酶,其能够转换油中的脱镁叶绿素和焦脱镁叶绿素。
22.二氧化硅也已用作吸附剂,用于从基于三酰基甘油的油中去除杂质。已用于纯化油的二氧化硅的实例包括美国专利号9,295,810;4,781,864;和9,493,748中描述的那些二氧化硅。然而,此类二氧化硅不能完全有效地从油中去除杂质,并且即使在二氧化硅处理之后,不希望水平的杂质,包括色素如叶绿素衍生物,仍可能保留在油中。
23.因此需要能够从基于三酰基甘油的油中去除杂质的替代二氧化硅。
技术实现要素:
24.在一个方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方法包括使油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触,其中所述吸附剂具有约7或更大,包括约7至约10的ph,包含以干基计约0.1重量%或更多的碱土金属氧化物例如mgo,并且具有约3重量%或更大,并且优选约10重量%或更大、或约25重量%至约75重量%的含水量。
25.在一个特定方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方
法包括使油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触,其中所述吸附剂具有约7至约10的ph,并且包含以干基计约2.5至约15重量%、或约5至约25重量%、或约10至约20重量%的mgo,并且具有约25至约75重量%的含水量。
26.在另一个方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方法包括:使油与具有脱色酶活性的多肽或包含该多肽的组合物接触,以产生脱色酶处理的油,并且使脱色酶处理的油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触,其中所述吸附剂具有约7或更大、例如约7至约10的ph,包含以干基计约0.1重量%或更多的碱土金属氧化物例如mgo,并且具有约3重量%或更大,优选约10重量%或更大、或约25至约75重量%的含水量。
27.在另一个方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方法包括:使油与具有脱色酶活性的多肽或包含该多肽的组合物接触,以产生脱色酶处理的油,并且使脱色酶处理的油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触;其中所述吸附剂具有约7至约10的ph,并且包含以干基计约2.5至约15重量%、或约5至约25重量%、或约10至约20重量%的mgo,并且具有约25至约75重量%的含水量。
28.在另一个方面,本公开内容涉及用于处理包含焦脱镁叶绿素的油的方法,该方法包括:使油与具有焦脱镁叶绿素酶活性的多肽或包含该多肽的组合物接触,其中焦脱镁叶绿素转换成焦脱镁叶绿酸,并且任选地其中脱镁叶绿素转换成脱镁叶绿酸,以产生焦脱镁叶绿素酶处理的油,并且使焦脱镁叶绿素酶处理的油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触,其中所述吸附剂具有约7或更大、例如约7至约10的ph,包含以干基计约0.1重量%或更多的碱土金属氧化物例如mgo,并且具有约3重量%或更大,优选约10重量%或更大、或约25至约75重量%的含水量。
29.在另一个方面,本公开内容涉及用于处理包含焦脱镁叶绿素的油的方法,该方法包括:使油与具有焦脱镁叶绿素酶活性的多肽或包含该多肽的组合物接触,其中焦脱镁叶绿素转换成焦脱镁叶绿酸,并且任选地其中脱镁叶绿素转换成脱镁叶绿酸,以产生焦脱镁叶绿素酶处理的油,并且使焦脱镁叶绿素酶处理的油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触;其中所述吸附剂具有约7至约10的ph,并且包含以干基计约2.5至约15重量%、或约5至约25重量%、或约10至约20重量%的mgo,并且具有约25至约75重量%的含水量。
30.在另一个方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方法包括:使油与具有脱色酶活性的多肽或包含该多肽的组合物接触,以产生脱色酶处理的油,并且使脱色酶处理的油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触,其中所述吸附剂具有约7或更大、例如约7至约10的ph,包含以干基计约0.1重量%或更多的碱土金属氧化物例如mgo,并且具有约3重量%或更大,优选约10重量%或更大,例如约25至约75重量%的含水量;并且其中相比于与吸附剂接触之前组合物中的叶绿素衍生物的总浓度,所述处理使组合物中的叶绿素衍生物的总浓度减少了至少5重量%。
31.在另一个方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方法包括:使油与具有脱色酶活性的多肽或包含该多肽的组合物接触,以产生脱色酶处理的油,并且使脱色酶处理的油与包含用碱土金属氧化物处理的二氧化硅的吸附剂接触;其中所述吸附剂具有约7至约10的ph,并且包含以干基计约2.5至约15重量%、或约5至约25重量%、或
约10至约20重量%的mgo,并且具有约25至约75重量%的含水量;并且其中相比于与吸附剂接触之前组合物中的叶绿素衍生物的总浓度,所述处理使组合物中的叶绿素衍生物的总浓度减少了至少5重量%。
32.在另一个方面,本公开内容的方法中使用的多肽是具有焦脱镁叶绿素酶活性的多肽,其中所述多肽选自:a. 分离的多肽,其与seq id no: 1的氨基酸1至318具有至少80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%或100%的同一性;和,b. 由核酸序列编码的多肽,所述核酸序列与seq id no: 2的核酸序列具有至少80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%或100%的同一性。
33.在一个实施方案中,本公开内容的方法中使用的多肽将叶绿素底物转换成叶绿素产物。叶绿素底物可以选自叶绿素、脱镁叶绿素、焦脱镁叶绿素及其组合,并且叶绿素产物可以选自脱植基叶绿素、脱镁叶绿酸、焦脱镁叶绿酸及其组合。
34.在一个方面,油包含焦脱镁叶绿素,多肽具有如本文公开的焦脱镁叶绿素酶活性,并且焦脱镁叶绿素转换成焦脱镁叶绿酸。
35.在另一个方面,本公开内容涉及通过本文公开的方法生产的油。
36.在另一个方面,本公开内容涉及用于本公开内容的方法中的改善的基于二氧化硅的吸附剂。吸附剂包含用碱土金属氧化物,优选氧化镁处理的无定形多孔二氧化硅,其量足以在最终吸附剂中提供约7或更大的ph以及约3重量%或更大的含水量。
附图说明
37.图1:叶绿素转换成脱镁叶绿酸和焦脱镁叶绿素以及转换成分别的反应产物脱植基叶绿素、脱镁叶绿酸和焦脱镁叶绿酸的概述。显示了a化合物,其具有在c7位置处的甲基。b化合物具有在c7基团中的醛而不是甲基。结构取自pubchem,ncbi。
38.图2
‑
2a:使脱镁叶绿素a和b以及焦脱镁叶绿素a和b与不同的假定叶绿素酶在ph 7和50℃下温育24小时的hplc结果。底物脱镁叶绿素a和b以及焦脱镁叶绿素a和b与反应产物脱镁叶绿酸a和b以及焦脱镁叶绿酸a和b的量作为峰表面积给出。前两列显示了反应产物和底物的总和。“nd”意指:无法检测的。
39.图3:使脱镁叶绿素a和b以及焦脱镁叶绿素a和b与不同的假定叶绿素酶在ph 5和50℃下温育24小时的hplc结果。底物脱镁叶绿素a和b以及焦脱镁叶绿素a和b与反应产物脱镁叶绿酸a和b以及焦脱镁叶绿酸a和b的量作为峰表面积给出。前两列显示了反应产物和底物的总和。“nd”意指:无法检测的。
40.图4a和4b:4a:叶绿素衍生物4b:在与来自大麦(hordeum vulgare)的chl26酶或来自莱茵衣藻的参考酶eldc94的24小时温育后,卡诺拉油中的磷化合物。
41.图5a
‑
5c:5a:叶绿素衍生物,以及5b:在不同反应条件下,在与来自大麦的chl26酶和/或来自莱茵衣藻的参考酶eldc94的几次温育后,卡诺拉油和大豆中的磷化合物,以及5c:所得到的胶质中的叶绿素衍生物。
42.图6
‑
6a:在苛性碱精炼后、以及在与来自大麦的chl26酶或来自莱茵衣藻的参考酶eldc94温育后,卡诺拉油和大豆油中的叶绿素衍生物。
43.图7:用于基于三酰基甘油的油的通常化学精炼方法的示意图。对油籽(油菜籽或大豆)、油果植物(棕榈)或单细胞来源(藻类)进行溶剂提取和/或压榨以获得粗制油的方法。然后用柠檬酸或磷酸处理粗制油,以与不可水合的磷脂反应,然后加入氢氧化钠,以中和游离脂肪酸并形成钠皂。当使油离心以生产精炼油时,钠皂与存在的水形成乳状液,允许去除不可水合的磷脂。然后可以用热水洗涤精炼油并离心,以去除剩余的皂和磷脂。可替代地,精炼油可以用酸性二氧化硅处理,以吸附肥皂、痕量金属和磷脂。工业酸性二氧化硅没有去除叶绿素或叶绿素衍生物的任何能力。然后用漂白土处理油,以去除油中存在的皂、磷脂以及叶绿素和叶绿素衍生物。在除臭步骤中的最后一步是在升高的温度和小于5 mbar的真空下的蒸汽蒸馏。蒸馏主要去除过氧化物、醛、酮和其它香味化合物。它还破碎β
‑
胡萝卜素并去除剩余的游离脂肪酸(0.1%),以达到0.02至0.05%的最终游离脂肪酸(ffa)水平。
44.图8:通常的酶促脱胶/物理精炼方法的示意图。粗制油用磷酸或柠檬酸处理,以致使不可水合的磷脂在ph大致2下丧失与其键合的钙或镁。然后加入氢氧化钠以使ph对于柠檬酸高于4或对于磷酸高于6,以便使得磷脂酶在与pla的酶促反应后可以起作用,并且获得非常低的残留磷<5 ppm)。可替代地,pla可以与plc和/或pi
‑
plc反应,以使油产率达到最大并且仍获得非常低的残留磷,允许物理精炼。然后用酸性二氧化硅随后为漂白土或与漂白土组合来洗涤或处理油。在叶绿素水平低于50 ppb的漂白过程后,油在除臭剂中进行物理精炼。高温蒸汽蒸馏去除了上述图7中的所有化合物,但其主要目的是ffa的去除。ffa在洗涤器中进行蒸馏且收集。相比于与水脱胶或化学精炼中形成的乳状液相关的损失,非常有限的中性油在脱臭过程中丧失。
45.图9:在水脱胶方法或酶辅助水脱胶方法中使用脱色酶的示意图。脱色酶可以与60℃的水一起加入,或与plc一起加入,或与plc和pi
‑
plc的组合一起加入。在温育两小时后,将油加热至70至85℃并离心,以去除反应的胶质和反应的叶绿素衍生物。
46.图10:酶促脱胶方法的示意图,所述方法被修改为包括用脱色酶和本公开内容的二氧化硅吸附剂(例如mgo处理的吸附剂)的处理。粗制油首先用柠檬酸处理至ph大致2,以解离键合的钙和镁离子,将ph升高到高于4,以致使plc和脱色酶处于致使其有效工作的ph。对于水解反应添加1至5百分比的水。在plc和脱色酶温育完成后,可以添加pla1或pla2,以与油中存在的不可水合的磷脂反应。在另外温育2至6小时后,将油加热至70至85℃并离心,以去除反应的胶质和叶绿素衍生物,产生在油中具有小于5 ppm的残留磷的油。然后任选地在真空下,可以使酶促脱胶的油与本公开内容的二氧化硅吸附剂接触,以进一步去除叶绿素衍生物和痕量金属,如本文所述的。
47.图11:用脱色酶,随后为用本公开内容的二氧化硅吸附剂处理的化学精炼方法的示意图。由于在方法的早期步骤中非常低的ph(大致2)和非常高的ph(大致14),在酸或苛性碱添加步骤中可能不添加脱色酶。脱色酶必须在精炼油的初始离心步骤后添加。在适合于酶的温度(50至65℃)下,伴随洗涤步骤加入脱色酶是有利的。在离心之前,允许至少2小时的温育时间,随后为加热至70至85℃。然后任选地在真空下,通过与本公开内容的二氧化硅吸附剂接触进一步加工油,以进一步去除叶绿素衍生物和/或痕量金属,如本文所述的。
48.图12:酶促脱胶/物理精炼方法的示意图,所述方法被修改为包括用本公开内容的二氧化硅吸附剂处理,但不含脱色酶处理。任选地在真空下,使酶促脱胶油或酶促脱胶并洗涤的油与本公开内容的二氧化硅吸附剂和任选的漂白土接触,以去除叶绿素衍生物和痕量
金属,如本文所述的。
49.图13:用于基于三酰基甘油的油的化学精炼方法的示意图,所述方法被修改为包括用本公开内容的二氧化硅吸附剂处理,但不含脱色酶处理。任选地在真空下,使精炼油或精炼一次的油与本公开内容的基于二氧化硅的吸附剂和任选的漂白土接触,以去除叶绿素衍生物和痕量金属,如本文所述的。
50.定义术语“控制序列”可以与术语“表达调控核酸序列”互换使用。如本文使用的,该术语指用于在特定宿主生物中或在体外表达可操作连接的编码序列所需的和/或影响其表达的核酸序列。当两个核酸序列可操作地连接时,它们通常将处于相同的取向并且也在相同的读码框内。它们通常是基本上邻接的,尽管这可能不是必需的。表达调控核酸序列,例如尤其是适当的转录起始、终止、启动子、前导区、信号肽、前肽、前原肽或增强子序列;夏因
‑
达尔加诺序列(shine
‑
dalgarno sequence)、阻遏子或激活物序列;有效的rna加工信号,如剪接和多腺苷酸化信号;稳定细胞质mrna的序列;增强翻译效率的序列(例如,核糖体结合位点);增强蛋白质稳定性的序列;以及需要时,增强蛋白质分泌的序列,可以是在选择的宿主生物中显示活性的任何核酸序列,并且可以衍生自编码蛋白质的基因,所述蛋白质对于宿主细胞是内源的或异源的。每个控制序列对于编码多肽的核酸序列可以是天然的或外源的(异源的)。需要时,控制序列可以提供有接头,用于引入特异性限制性位点的目的,促进控制序列与编码多肽的核酸序列的编码区的连接。控制序列可以对于其具体目的进行优化。
51.如本文使用的,术语“叶绿素衍生物”包括叶绿素底物和叶绿素产物。叶绿素底物包含叶绿素、脱镁叶绿素和焦脱镁叶绿素。叶绿素产物包含脱植基叶绿素、脱镁叶绿酸和焦脱镁叶绿酸。叶绿素衍生物包含所谓的a和b化合物。
52.如本文使用的,术语“脱色酶”(及其变体,包括短语“具有脱色酶活性的多肽”)意指能够将一种或多种叶绿素底物转换成叶绿素产物的多肽。例如,多肽可能能够将叶绿素水解成脱植基叶绿素;将脱镁叶绿素水解成脱镁叶绿酸;和/或将焦脱镁叶绿素水解成焦脱镁叶绿酸。因此,术语“脱色酶活性”可以包括叶绿素酶活性、脱镁叶绿素酶活性、焦脱镁叶绿素酶活性或其组合。
53.如本文使用的,术语“水凝胶”指基于二氧化硅的吸附剂,其具有约25重量%或更大,且优选约25至约75重量%的含水量。
54.术语“无定形的”在本文中用于意指其组成原子、分子或离子以随机、无序模式排列的固体材料,所述模式在所有三个方向上延伸,其可以通过x射线衍射或差示扫描量热法进行确定。
55.如本文使用的,术语“多孔的”指如通过如din 66134中所述的barrett
‑
joyner
‑
halenda(bjh)氮孔隙率测定法测量的,具有0.1 cc/g或更大的内部孔隙率的材料。
56.如本文关于用碱土金属氧化物处理使用的,术语“处理的”指二氧化硅和碱土金属氧化物在高剪切条件下的紧密混合。
57.术语“颗粒表面积”定义为意指如通过brunauer emmet teller(bet)氮吸附方法测量的颗粒表面积。
58.短语“中值粒度”指当颗粒在水或有机溶剂(如丙酮或乙醇)中浆化时,通过动态光
散射测量的中值粒度(d50,其为50体积百分比的颗粒在尺寸上小于这一数字,且50体积百分比的颗粒大于这一数字的体积分布)。
59.术语“基于三酰基甘油的油”指包含三酰基甘油的油。
60.术语“表达”包括涉及多肽生产的任何步骤,包括但不限于转录、转录后修饰、翻译、翻译后修饰和分泌。
61.表达载体包含编码多肽的多核苷酸,其可操作地连接至适当的控制序列(例如启动子、rbs/夏因达尔加诺以及转录和翻译终止信号),用于多核苷酸的体外或在宿主细胞中的转录和/或翻译。
62.表达载体可以是任何载体(例如,质粒或病毒),其可以方便地经受重组dna程序,并且可以造成多核苷酸的表达。载体的选择通常取决于载体与载体待引入其内的细胞的相容性。载体可以是线性或闭合环状质粒。载体可以是自主复制载体,即作为染色体外实体存在的载体,其复制不依赖于染色体复制,例如质粒、染色体外元件、微型染色体或人工染色体。可替代地,载体可以是这样的载体,当引入宿主细胞内时,其整合到基因组内并且连同与它已整合到其内的染色体一起复制。整合克隆载体可以在宿主细胞的染色体中的随机或预定靶基因座处整合。载体系统可以是单个载体或质粒、或者两个或更多个载体或质粒,其一起含有待引入宿主细胞的基因组内的总dna,或转座子。
63.如本文定义的,宿主细胞是适合于遗传操纵的生物,以及可以在可用于靶产物(例如根据本发明的多肽)的工业生产的细胞密度下培养的生物。宿主细胞可以是自然界中发现的宿主细胞,或者在遗传操纵或经典诱变后衍生自亲本宿主细胞的宿主细胞。有利地,宿主细胞是重组宿主细胞。
64.宿主细胞可以是原核、古细菌或真核宿主细胞。原核宿主细胞可以是但不限于细菌宿主细胞。真核宿主细胞可以是但不限于酵母、真菌、变形虫、藻类、植物、动物或昆虫宿主细胞。
65.如本文使用的,术语“异源的”指非天然存在于宿主细胞中的核酸或氨基酸序列。换言之,核酸或氨基酸序列与宿主细胞中天然发现的不同。
66.核酸或多核苷酸序列在本文中定义为包含至少5个核苷酸或核酸单元的核苷酸聚合物。核苷酸或核酸指rna和dna。术语“核酸”和“多核苷酸序列”在本文中可互换使用。
[0067]“肽”指通过肽(酰胺)键连接的氨基酸残基短链。最短的肽,二肽,由通过单个肽键连接的2个氨基酸组成。
[0068]
术语“多肽”指包含通过肽键连接的氨基酸残基,并且含有多于五个氨基酸残基的分子。如本文使用的,术语“蛋白质”与术语“多肽”同义,并且还可以指两种或更多种多肽。因此,术语“蛋白质”和“多肽”可以互换使用。多肽可以任选地是修饰的(例如,糖基化、磷酸化、酰化、法呢基化、异戊二烯化、磺化等等),以增加功能性。在特定条件下在特定底物的存在下显示出活性的多肽可以被称为酶。应理解,作为遗传密码简并性的结果,可以产生编码给定多肽的许多核苷酸序列。
[0069]“分离的核酸片段”是并非作为片段天然存在并且在天然状态下并未发现的核酸片段。
[0070]
如本文使用的,术语“分离的多肽”意指去除它与之天然相关的至少一种组分,例如其它多肽材料的多肽。分离的多肽可以不含任何其它杂质。分离的多肽可以是至少50%纯
的,例如至少60%纯的,至少70%纯的,至少75%纯的,至少80%纯的,至少85%纯的,至少80%纯的,至少90%纯的,或至少95%纯的,96%、97%、98%、99%、99.5%、99.9%纯的,如通过sds
‑
page或适合于此目的且本领域技术人员已知的任何其它分析方法确定的。分离的多肽可以由重组宿主细胞产生。
[0071]
术语“启动子”在本文中定义为这样的dna序列,其结合rna聚合酶,并且将聚合酶引导至核酸序列的正确下游转录起始位点,以启动转录。启动子序列相对于编码多肽的核酸序列可以是天然的或异源的。
[0072]
当提及细胞、核酸、蛋白质或载体使用时,术语“重组的”指示细胞、核酸、蛋白质或载体已通过引入异源核酸或蛋白质或者天然核酸或蛋白质的改变进行修饰,或者细胞衍生自如此修饰的细胞。因此,例如,重组细胞表达在细胞的天然(非重组)形式内未发现的基因,或者表达以其它方式异常表达、表达不足或根本不表达的天然基因。术语“重组的”与“遗传修饰的”和“转基因的”同义。
[0073]
术语“序列同一性”和“序列同源性”在本文中可互换使用。为了本发明的目的,此处定义,为了确定两个氨基酸序列或两个核酸序列的序列同源性或序列同一性的百分比,为了最佳比较的目的比对序列。为了优化两个序列之间的比对,可以在比较的两个序列中的任一个中引入缺口。这种比对可以在待比较序列的全长上进行。可替代地,可以在较短的长度上,例如在约20、约50、约100个或更多个核酸/碱基或氨基酸上进行比对。序列同一性是在报告的比对区域上两个序列之间的相同匹配的百分比。两个氨基酸序列之间或两个核苷酸序列之间的序列同一性百分比,可以使用用于两个序列比对的needleman和wunsch算法来确定。(needleman,s. b.和wunsch,c. d.(1970)j. mol. biol. 48,443
‑
453)。氨基酸序列和核苷酸序列两者均可以通过该算法进行比对。needleman
‑
wunsch算法已在计算机程序needle中实现。为了本发明的目的,使用来自emboss包的needle程序(版本2.8.0或更高版本,emboss: the european molecular biology open software suite(2000)rice,p. longden,i.和bleasby,a. trends in genetics 16,(6)第276—277页,http://emboss.bioinformatics.nl/)。对于蛋白质序列,eblosum62用于取代矩阵。对于核苷酸序列,使用ednafull。使用的任选参数是缺口开放罚分10和缺口延伸罚分0.5。技术人员将了解,所有这些不同的参数将产生略微不同的结果,但当使用不同算法时,两个序列的总体同一性百分比并不显著改变。
[0074]
在通过如上所述的程序needle比对后,查询序列和本发明的序列之间的序列同一性百分比如下进行计算:在比对中显示了两个序列中的相同氨基酸或相同核苷酸的相应位置数目除以在扣除比对中的缺口总数后比对的总长度。如本文定义的同一性可以通过使用nobrief选项从needle获得,并且在程序的输出中标记为“最长同一性”。
[0075]
本公开内容的核酸和蛋白质序列可以进一步用作“查询序列”,以执行针对公共数据库的搜索,以例如鉴定其它家族成员或有关序列。可以使用altschul等人(1990)j. mol. biol. 215:403—10的nblast和xblast程序(版本2.0)执行此类搜索。blast核苷酸搜索可以用nblast程序,得分 = 100,字长 = 12来执行,以获得与本发明的核酸分子同源的核苷酸序列。blast蛋白质搜索可以用xblast程序,得分 = 50,字长 = 3来执行,以获得与本发明的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的缺口比对,可以如altschul等人(1997)nucleic acids res. 25(17): 3389
‑
3402中所述利用gapped blast。当利用
blast和gapped blast程序时,可以使用相应程序(例如xblast和nblast)的默认参数。参见在http://www.ncbi.nlm.nih.gov/处的美国国家生物技术信息中心(national center for biotechnology information)的主页。
[0076]“合成分子”,例如合成核酸或合成多肽通过体外化学或酶促合成产生。它包括但不限于以所选择的宿主生物的最佳密码子使用制备的变体核酸。
[0077]
合成的核酸可以对于密码子使用进行优化,优选根据wo2006/077258和/或wo2008000632中描述的方法,所述专利引入本文作为参考。wo2008/000632致力于密码子对优化。密码子对优化是这样的方法,其中优化编码多肽的核苷酸序列,所述核苷酸序列已关于其密码子使用特别是使用的密码子对进行修饰,以获得编码多肽的核苷酸序列的改善表达和/或编码多肽的改善产生。密码子对定义为编码序列中的一组两个相继三联体(密码子)。本领域技术人员将知道密码子使用需要根据宿主物种进行适应,可能导致与seq id no: 1具有显著同源性偏差,但仍编码根据本发明的多肽的变体。
[0078]
如本文使用的,术语“变体”、“衍生物”、“突变体”或“同源物”可以互换使用。它们可以指多肽或核酸。变体包括在相对于参考序列的一个或多个位置处的取代、插入、缺失、截短、颠换和/或倒位。变体可以通过例如位点饱和诱变、扫描诱变、插入诱变、随机诱变、定点诱变和定向进化以及本领域技术人员已知的各种其它重组方法来制备。核酸的变体基因可以通过本领域已知的技术人工合成。
具体实施方式
[0079]
本公开内容涉及用于从油且特别是基于三酰基甘油的油中去除杂质的方法,所述杂质包括含磷化合物例如磷胶、皂、痕量金属、叶绿素衍生物、游离脂肪酸等等。更特别地,本公开内容涉及包含已用碱土金属氧化物处理的无定形多孔二氧化硅的吸附剂,以及此类吸附剂从油中去除杂质的用途。
[0080]
目前已发现,用碱土金属如镁,且特别是碱土金属氧化物如氧化镁处理具有指定含水量的多孔无定形二氧化硅,导致与先前已知的二氧化硅相比,具有从油中去除杂质例如叶绿素衍生物和痕量金属的改善能力的吸附剂。已进一步发现,与基于其它类型的二氧化硅的先前吸附剂例如干凝胶或酸性水凝胶相比,具有约7或更大且优选约7至约10的ph的碱土金属氧化物处理的二氧化硅吸附剂,能够从基于三酰基甘油的油中去除更多杂质(例如痕量金属、叶绿素衍生物等)。
[0081]
因此,在一个方面,本公开内容涉及用于处理包含叶绿素衍生物的油的方法,该方法包括使油与吸附剂接触,其中所述吸附剂包含已用碱土金属氧化物如mgo处理的二氧化硅,且特别是多孔无定形的二氧化硅,其中所述吸附剂具有约7或更大的ph,以及约3重量%或更大,或优选约10重量%或更大、或约25至约75重量%的含水量。在一个特定实施方案中,吸附剂是水凝胶,并且具有约7至约10的ph和约25至约75重量%的含水量,并且包含以干基计约2.5至约15重量%、或约5至约25重量%、或约10至约20重量%的mgo。
[0082]
在一个实施方案中,吸附剂包含用碱土金属氧化物处理的多孔无定形二氧化硅,其量足以提供以干基计约0.1重量%或更多,并且更通常地,约1重量%至约40重量%、或约5重量%至约25重量%、或约10至约20重量%、或约2.5重量%至约15重量%的碱土金属氧化物。在一个特定实施方案中,二氧化硅用氧化镁(mgo)进行处理,并且无定形二氧化硅是凝胶。在这
样的实施方案中,吸附剂包含以干基计约0.1重量%或更多的mgo,或约1重量%至约40重量%、或约2.5重量%至约15重量%、或约5重量%至约25重量%、或约5重量%至约15重量%、或约10重量%至约20重量%、或约10重量%至约15重量%的mgo。在一个特定实施方案中,吸附剂包含约10重量%至约20重量%的mgo。
[0083]
在一些实施方案中,本公开内容的吸附剂具有约1:3.8至约1:26,包括约1:12.77至约1:3.3、或约1:12.77至约1:4.89、或约1:8.09至约1:4.90、或约1:5.44至约1:4.89的mgo:sio2的摩尔比。在一个特定实施方案中,吸附剂具有约1:5.44至约1:4.89的mgo:sio2的摩尔比。
[0084]
本公开内容的吸附剂可以具有至少约3重量%,并且更通常地,约10重量%或更大、约20重量%或更大、或者甚至约55重量%或更大的含水量。在某些实施方案中,本公开内容的吸附剂有利地由二氧化硅水凝胶制备,并且具有约25重量%至约75重量%的含水量。在其它实施方案中,吸附剂具有约30重量%至约65重量%、或约40重量%至约70重量%、或约50重量%至约65重量%、或约55重量%至约67重量%、或者约58重量%至约65重量%的含水量。
[0085]
本公开内容的吸附剂具有约7或更大,包括约7至约10、或约7.5至约9.7、或约8.0至约9.5、或约8.0至约9.0、或约8.2至约9.3的ph。如本文讨论的并且如实施例中证实的,与基于酸性水凝胶的现有吸附剂相比,已发现本公开内容的吸附剂在从油中去除杂质方面更优异。
[0086]
本公开内容的吸附剂可以具有约0.1至约2000微米,包括约1至约1000微米、或约2至约500微米、或约5至约50微米的中值粒度。在一个实施方案中,吸附剂具有约10至约30微米的中值粒度。
[0087]
本公开内容的吸附剂可以具有约50 m2/g或更大,包括约300 m2/g或更大、或者约650 m2/g或更大的表面积。在一些实施方案中,本公开内容的吸附剂具有约50 m2/g至约800 m2/g、或约300 m2/g至约700 m2/g的表面积,如通过bet表面测量确定的。
[0088]
本公开内容的吸附剂可以具有约0.1 cc/g或更大,优选约0.4 cc/g或更大的孔体积。在一些实施方案中,吸附剂的孔体积的范围可以为约0.2 cc/g至约2.0 cc/g、或约0.7 cc/g至约2.0 cc/g,如通过氮孔隙率测定法确定的。
[0089]
在一个特定实施方案中,本公开内容的吸附剂包含无定形硅胶,其已用氧化镁(mgo)进行处理,并且具有约7至约10的ph,并且包含以干基计约2.5重量%至约15重量%的mgo,并且具有约25重量%至约75重量%的含水量。更特别地,在一个实施方案中,本公开内容的吸附剂包含无定形硅胶,其已用mgo进行处理,并且具有约8至约9的ph,包含以干基计约10重量%至约20重量%的mgo,且具有约50重量%至约65重量%的含水量。
[0090]
可以用于制备本公开内容的吸附剂的合适的二氧化硅包括无定形多孔硅胶,以及在二氧化硅的孔中具有约3重量%或更大的水分含量的沉淀物。在一个实施方案中,无定形二氧化硅是具有约25重量%或更大的水分含量,优选大于40重量%,最优选大于50重量%,且甚至更优选约30至约65重量%水分的“水凝胶”。在一些实施方案中,合适的二氧化硅水凝胶包括但不限于商购可得的硅胶,例如trisyl
®
二氧化硅和trisyl
®ꢀ
300(w.r. grace & co.
‑
conn.,columbia,md.)。
[0091]
在另一个实施方案中,基本上不含水分的二氧化硅可以用作起始二氧化硅。“基本上无水的”意指用于制备具有小于约15%水分的吸附剂的二氧化硅。随后通过使凝胶与足够
量的水接触使基本上无水的二氧化硅水合,以在与碱土金属氧化物组合之前,提供优选在二氧化硅的孔中所需的水分含量,即约30重量%或更大。待加入的水量与所使用的特定二氧化硅的孔体积相关联,并且可以由本领域技术人员容易地确定。适用于本公开内容的方法中的二氧化硅制备的非限制性描述在实施例中进行阐述。
[0092]
可用于制备本公开内容的吸附剂的合适的碱土金属氧化物包括但不限于氧化镁、氧化钙、氧化锶、氧化钡、氧化铍或其组合。优选地,碱土金属氧化物是氧化镁。
[0093]
本公开内容的吸附剂可以通过优选在高剪切条件下,将所需量的碱金属氧化物粉末与具有所需含水量的无定形硅胶物理上共混进行制备。共混进行的时间和温度足以提供自由流动的粉末。优选地,共混在范围约室温至约100℃的温度下进行足以获得均匀混合物的时间,例如约1秒或更长时间。本发明的最终吸附剂包含碱土金属氧化物处理的硅胶,其具有约3重量%或更大的水分含量和约7或更大的ph。在一个实施方案中,最终吸附剂是由w.r. grace & co.
‑
conn在产品名称sp
‑
2115下提供的自由流动粉末,所述产品含有以干基计约10至约13重量%的氧化镁、约50至约65%的含水量和约8.2至约9.3的ph。
[0094]
一般而言,本公开内容的方法包括使油与其量从油中有效去除杂质的本公开内容的吸附剂接触。在一个非限制性实施方案中,使油与其量为基于油的重量约10重量%或更少的本公开内容的吸附剂接触。在其它实施方案中,使油与其量为以下的吸附剂接触:基于油的重量约0.01重量%至约10重量%、或约0.1重量%至约8重量%、或约0.1重量%至约5重量%、或约0.1重量%至约1重量%、或约0.1重量%至约0.5重量%、或约0.1重量%至约0.4重量%、或约0.1重量%至约0.3重量%、或约0.1重量%至约0.2重量%。
[0095]
在某些实施方案中,可以在小于约100℃的温度下,或更通常在约60℃至小于约100℃的温度下,包括在约80℃的温度下,使油与本公开内容的吸附剂接触。在一些实施方案中,可以在真空下在小于约110℃的温度下,例如在约70℃至约130℃的温度下,或在约100℃的温度下,使油与本公开内容的吸附剂接触。在一个实施方案中,真空可以为约50至约700 mbar,且更通常为约100 mbar。在一个实施方案中,在约100 mbar的真空和约100℃的温度下,使油与本公开内容的吸附剂接触。在另一个实施方案中,在约60℃至小于约100℃的温度下或在约80℃的温度下,使油与本公开内容的吸附剂接触,随后应用约50至约700 mbar,且更通常为约100 mbar的真空,以及温度至约70℃至约130℃的增加。在一个特定实施方案中,在约80℃的温度下,使油与本公开内容的吸附剂接触,随后应用约100 mbar的真空,以及温度至约100℃的增加。在一些实施方案中,使吸附剂与油接触约5至约240分钟,包括约15至约60分钟。在处理之后,可以使用任何合适的技术,包括过滤,从油中去除二氧化硅。
[0096]
可以使用本公开内容的方法从油中去除的杂质包括但不限于含磷化合物包括磷胶、皂、痕量金属(例如但不限于钠、钾、镁、钙、铁、铝和铅)、叶绿素底物(包括叶绿素、脱镁叶绿素、焦脱镁叶绿素)、叶绿素衍生物(包括脱植基叶绿素、脱镁叶绿酸和焦脱镁叶绿酸)和游离脂肪酸(ffa)。
[0097]
如上文描述的用本公开内容的吸附剂处理油提供了满足包括烹调油在内的食用油的可接受的贸易和运输标准的油。此类标准包括美国国家油籽产品研究所(national institute of oilseed products)(niop)、美国石油化学家协会(american oil chemists society)和iso的标准。
[0098]
可以使用本公开内容的方法处理的油包括但不限于选自以下的基于三酰基甘油的油:卡诺拉油、蓖麻油、椰子油、芫荽油、玉米油、棉籽油、榛子油、大麻籽油、亚麻籽油、芒果仁油、白芒花(meadowfoam)油、牛脚油、橄榄油、棕榈油、棕榈仁油、棕榈油精、花生油、菜籽油、米糠油、红花油、山茶花(sasanqua)油、芝麻油、大豆油、葵花籽油、妥尔油、椿油、植物油和来自藻类的油。在一个实施方案中,油是来自藻类的油。
[0099]
本公开内容的吸附剂可以用于在油加工期间的各个阶段从油中去除杂质。例如,待处理的油可以选自粗制未脱胶油、脱胶油、苛性碱精炼油、苛性碱精炼且水洗涤的油或水脱胶油。在一个实施方案中,油是粗制油,并且该方法包括使粗制油与本公开内容的二氧化硅接触。
[0100]
在另一个实施方案中,油在与吸附剂接触之前首先经受脱色酶处理。例如,在一个实施方案中,该方法包括使包含叶绿素衍生物的油与具有脱色酶活性的多肽或包含该多肽的组合物接触,以产生脱色酶处理的油,并且使脱色酶处理的油与本公开内容的吸附剂接触。可以用于本公开内容的方法中的具有脱色酶活性的合适多肽的实例,包括但不限于下文详细讨论的那些多肽。下文还详细描述了用于生产脱色酶处理的油的合适方法以及各种油加工方法。
[0101]
相对于与吸附剂接触之前油中的杂质水平,用本公开内容的吸附剂处理油有利地减少了杂质的水平。例如,相比于与二氧化硅接触之前油中存在的叶绿素衍生物的总浓度(按重量计),使油(包括脱色酶处理的油)与本公开内容的二氧化硅接触,可以将油中的叶绿素衍生物(包括叶绿素底物和/或叶绿素产物)的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。
[0102]
在另一个实施方案中,油中的叶绿素衍生物包含焦脱镁叶绿素,并且相比于与吸附剂接触之前油中存在的焦脱镁叶绿素的总浓度(按重量计),使油(包括脱色酶处理的油)与本公开内容的吸附剂接触,可以将油中的焦脱镁叶绿素的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。
[0103]
在另一个实施方案中,油中的叶绿素衍生物包含脱镁叶绿素,并且相比于与二氧化硅接触之前油中存在的脱镁叶绿素的总浓度(按重量计),使油(包括脱色酶处理的油)与本公开内容的吸附剂接触,可以将油中的脱镁叶绿素的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。
[0104]
在另一个实施方案中,油中的叶绿素衍生物包含叶绿素,并且相比于与二氧化硅接触之前油中存在的叶绿素的总浓度(按重量计),使油(包括脱色酶处理的油)与本公开内容的二氧化硅接触,将油中的叶绿素的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。
[0105]
在另一个实施方案中,相比于与吸附剂接触之前油中存在的痕量金属杂质的总浓度(按重量计),使油(包括脱色酶处理的油)与本公开内容的基于二氧化硅的吸附剂接触,可以将油中的痕量金属杂质(例如但不限于钠、钾、镁、钙、铁、铝和铅)按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至
少95%、至少99%或100%。
[0106]
在另一个实施方案中,使包含叶绿素衍生物且特别是叶绿素底物的油与具有脱色酶活性的多肽或包含该多肽的组合物接触,以产生脱色酶处理的油。在一个这样的实施方案中,叶绿素底物包含焦脱镁叶绿素,脱色酶处理将焦脱镁叶绿素的至少一部分转换成焦脱镁叶绿酸,并且相比于与吸附剂接触之前脱色酶处理的油中存在的焦脱镁叶绿酸的总浓度(按重量计),使脱色酶处理的油与本公开内容的吸附剂接触,将脱色酶处理的油中的焦脱镁叶绿酸的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。在另一个实施方案中,叶绿素底物包含脱镁叶绿素,脱色酶处理将脱镁叶绿素的至少一部分转换成脱镁叶绿酸,并且相比于与吸附剂接触之前脱色酶处理的油中存在的脱镁叶绿酸的总浓度(按重量计),使脱色酶处理的油与本公开内容的吸附剂接触,将油中的脱镁叶绿酸的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。在另一个实施方案中,叶绿素底物包含叶绿素,脱色酶处理将叶绿素的至少一部分转换成脱植基叶绿素,并且相比于与吸附剂接触之前脱色酶处理的油中存在的脱植基叶绿素的总浓度(按重量计),使脱色酶处理的油与本公开内容的吸附剂接触,将脱色酶处理的油中的脱植基叶绿素的总浓度按重量计减少至少5%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少99%或100%。
[0107]
在一个实施方案中,本公开内容的方法进一步包括使油或脱色酶处理的油与选自以下的另外的酶接触:磷脂酶、脱镁叶绿素酶、焦脱镁叶绿素酶、脱镁叶绿酸酶、叶绿素酶及其组合。
[0108]
在另一个实施方案中,本公开内容涉及用于处理包含焦脱镁叶绿素的油的方法,该方法包括使油与具有焦脱镁叶绿素酶活性的多肽或包含该多肽的组合物接触,其中焦脱镁叶绿素转换成焦脱镁叶绿酸,并且任选地,其中脱镁叶绿素转换成脱镁叶绿酸,以产生焦脱镁叶绿素酶处理的油,并且使焦脱镁叶绿素酶处理的油与本公开内容的吸附剂接触。
[0109]
多肽任何合适的具有脱色酶活性的多肽都可以用于本公开内容的方法中。在一个特定实施方案中,该多肽是具有焦脱镁叶绿素酶活性的多肽,并且选自以下:a. 分离的多肽,其与seq id no: 1的氨基酸1至318具有至少80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%,或者具有100%的同一性;和,b. 由核酸序列编码的多肽,所述核酸序列与seq id no: 2的核酸序列具有至少80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%,或者具有100%的同一性。
[0110]
具有焦脱镁叶绿素酶活性的多肽可以是与seq id no: 1的氨基酸1至318具有至少80%同一性的多肽。如本文公开的多肽可以与seq id no: 1的氨基酸1至318具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%的同一性。如本文公开的多肽可以与seq id no: 1的氨基酸1至318具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%的同一性。如本文公开的,具有焦脱镁叶绿素酶活性的多肽可以包含或含有seq id no: 1的氨基酸1至318,或由其组成。具有焦脱镁
叶绿素酶活性的多肽可以包含或含有seq id no: 1的氨基酸2至318,或由其组成。令人惊讶的是,发现与seq id no: 1的氨基酸1至318或氨基酸2至318具有至少80%同一性的多肽包含焦脱镁叶绿素酶活性。
[0111]
具有焦脱镁叶绿素酶活性的多肽将焦脱镁叶绿素水解成焦脱镁叶绿酸(还参见图1)。如本文公开的,具有焦脱镁叶绿素酶活性的多肽优选将焦脱镁叶绿素a和焦脱镁叶绿素b水解成其焦脱镁叶绿酸a和b化合物。相应地,焦脱镁叶绿素酶活性可以通过焦脱镁叶绿酸的形成进行确定。
[0112]
如本文公开的多肽可以进一步包含脱镁叶绿素酶活性。具有脱镁叶绿素酶活性的多肽将脱镁叶绿素水解成脱镁叶绿酸。优选地,如本文公开的多肽将脱镁叶绿素a和/或脱镁叶绿素b水解成其分别的脱镁叶绿酸化合物。相应地,脱镁叶绿素酶活性可以通过脱镁叶绿素的形成进行确定。
[0113]
如本文公开的具有焦脱镁叶绿素酶活性的多肽还可以包含叶绿素酶活性。具有叶绿素酶活性的多肽水解叶绿素转换成脱植基叶绿素。优选地,如本文公开的多肽将叶绿素a和/或叶绿素b水解成其分别的脱植基叶绿素化合物。
[0114]
在一个实施方案中,如本文公开的多肽具有焦脱镁叶绿素酶活性、脱镁叶绿素酶活性和叶绿素酶活性。
[0115]
焦脱镁叶绿素、脱镁叶绿素、叶绿素以及反应产物焦脱镁叶绿酸、脱镁叶绿酸、脱植基叶绿素的确定可以通过如实施例中公开的hplc来执行。
[0116]
多肽可以衍生自任何合适的起源,例如植物、藻类或蓝细菌。如本文公开的多肽可以衍生自植物,例如大麦属物种(hordeum sp.)或小麦属物种(triticum sp.),例如大麦或小麦。如本文公开的多肽也可以使用标准分子技术例如从头合成而生成。
[0117]
如本文公开的具有脱色酶活性例如焦脱镁叶绿素酶活性的多肽可以是分离的、纯的、重组的、合成的或变体多肽。如本文公开的多肽可以是纯化的。蛋白质的纯化可以通过本领域技术人员已知的几种方法来执行。
[0118]
如本文公开的,具有焦脱镁叶绿素酶活性的多肽的变体多肽可以是与seq id no: 1的氨基酸1至318或与seq id no: 1的氨基酸2至318具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%的同一性的多肽。
[0119]
如本文公开的,具有焦脱镁叶绿素酶活性的多肽可以是多肽例如变体多肽,当与根据seq id no: 1的氨基酸序列比对时,所述多肽包含与seq id no: 1相比在一个或多个氨基酸位置处的取代、缺失和/或插入。例如,如本文公开的多肽可以是这样的多肽,当与seq id no: 1的多肽比对时,所述多肽包含与seq id no: 1相比的1、2、3、4、5、6、7、8、9、10、11或12个或更多个氨基取代、缺失和/或插入,由此多肽仍具有如本文公开的多肽的活性或功能。技术人员将了解,如本文公开的多肽中的这些微小氨基酸变化可以存在(例如天然发生的突变)或制备(例如使用r
‑
dna技术),而无蛋白质功能或活性的丧失。在这些突变存在于多肽的结合结构域、活性位点或其它功能结构域中的情况下,多肽的性质可能改变,但多肽可能保持其活性。在存在不靠近活性位点、结合结构域或其它功能结构域的突变的情况下,可以预计较小的效应。
[0120]
如本文公开的多肽可以由任何合适的多核苷酸序列编码,只要该多肽显示出如本文公开的焦脱镁叶绿素酶活性。通常,编码如本文公开的具有焦脱镁叶绿素酶活性的多肽
fluorescens)。
[0130]
在本发明的另一个实施方案中,公开了核酸,其是seq id no: 2的核酸的分离的、纯的、重组的、合成的或变体核酸。变体核酸序列可以例如与seq id no: 2具有至少80%、85% 86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或至少99%的序列同一性。
[0131]
本发明还涉及包含如本文公开的核酸的表达载体,其中所述核酸与指导宿主细胞中的多肽表达的一个或多个控制序列可操作地连接。
[0132]
存在将核酸插入核酸构建体或表达载体内的几种方法,其是本领域技术人员已知的,参见例如,sambrook & russell,molecular cloning: a laboratory manual,第3版,cshl press,cold spring harbor,ny,2001。可能期望用控制序列例如启动子和终止序列来操纵编码本发明的多肽的核酸。
[0133]
启动子可以是适合于真核或原核宿主细胞的任何适当的启动子序列,其显示转录活性,包括突变的、截短的和杂合启动子,并且可以得自编码对于细胞或内源(天然)或异源(外来)的细胞外或细胞内多肽的多核苷酸。启动子可以是组成型或诱导型启动子。优选地,启动子是诱导型启动子,例如淀粉诱导型启动子。
[0134]
在丝状真菌中合适的启动子是可以选自下组的启动子,其包括但不限于得自编码以下的多核苷酸的启动子:米曲霉(a. oryzae)taka淀粉酶、米黑根毛霉(rhizomucor miehei)天冬氨酸蛋白酶、曲霉属(aspergillus)gpda启动子、黑曲霉(a. niger)中性α
‑
淀粉酶、黑曲霉酸稳定性α
‑
淀粉酶、黑曲霉或泡盛曲霉(a. awamori)葡糖淀粉酶(glaa)、黑曲霉或泡盛曲霉内切木聚糖酶(xlna)或β
‑
木糖苷酶(xlnd)、里氏木霉(t. reesei)纤维二糖水解酶i(cbhi)、米黑根毛霉脂肪酶、米曲霉碱性蛋白酶、米曲霉磷酸丙糖异构酶、构巢曲霉(a. nidulans)乙酰胺酶、fusarium venenatum淀粉葡糖苷酶(wo 00/56900)、fusarium venenatum dania(wo 00/56900)、fusarium venenatum quinn(wo 00/56900)、尖孢镰刀菌(fusarium oxysporum)胰蛋白酶样蛋白酶(wo 96/00787)、里氏木霉β
‑
葡糖苷酶、里氏木霉纤维二糖水解酶i、里氏木霉纤维二糖水解酶ii、里氏木霉内切葡聚糖酶i、里氏木霉内切葡聚糖酶ii、里氏木霉内切葡聚糖酶iii、里氏木霉内切葡聚糖酶iv、里氏木霉内切葡聚糖酶v、里氏木霉木聚糖酶i、里氏木霉木聚糖酶ii、里氏木霉β
‑
木糖苷酶、以及na2
‑
tpi启动子(来自编码黑曲霉中性α
‑
淀粉酶和米曲霉磷酸丙糖异构酶的多核苷酸的启动子的杂合体),以及其突变的、截短的和杂合启动子。
[0135]
在细菌宿主中合适的启动子是可以选自以下的启动子:大肠杆菌(e. coli)lac启动子、aroh启动子、arabad启动子、t7启动子、trc启动子、tac启动子和trp启动子。启动子的其它实例是天蓝色链霉菌(streptomyces coelicolor)琼脂酶基因(daga)的启动子、迟缓芽孢杆菌(bacillus lentus)碱性蛋白酶基因(aprh)的启动子、地衣芽孢杆菌(bacillus licheniformis)碱性蛋白酶基因(枯草杆菌蛋白酶carlsberg基因)的启动子、枯草芽孢杆菌(bacillus subtilis)果聚糖蔗糖酶基因(sacb)的启动子、枯草芽孢杆菌α淀粉酶基因(amye)的启动子、地衣芽孢杆菌α淀粉酶基因(amyl)的启动子、嗜热脂肪芽孢杆菌(bacillus stearothermophilus)生麦芽糖淀粉酶基因(amym)的启动子、或解淀粉芽孢杆菌(bacillus amyloliquefaciens)α
‑
淀粉酶基因(amyq)的启动子。另一个实例是对于"
‑
35"区域具有序列ttgaca且对于"
‑
10"区域具有序列tataat的“共有”启动子。
[0136]
本发明还涉及包含如本文公开的核酸或如公开的表达载体的重组宿主细胞,其中
所述核酸对于宿主细胞是异源的。如本文公开的重组宿主细胞可以是这样的宿主细胞,其中如本文公开的核酸和具有脱色酶(包括焦脱镁叶绿素酶)活性的编码多肽对于宿主细胞是异源的。
[0137]
如本文公开的宿主细胞可以是任何合适的微生物、植物或昆虫细胞。合适的宿主细胞可以是真菌细胞,例如来自枝顶孢属(acremonium)、曲霉属、金孢子菌属(chrysosporium)、镰刀菌属(fusarium)、青霉属(penicillium)、rasamsonia、木霉属(trichoderma)、酵母属(saccharomyces)、克鲁维酵母属(kluyveromyces)、毕赤酵母属,例如黑曲霉、泡盛曲霉、臭曲霉(aspergillus foetidus)、米曲霉、酱油曲霉(a. sojae)、埃默森罗萨氏菌(rasamsonia emersonii)、chrysosporium lucknowense、尖孢镰刀菌、里氏木霉或酿酒酵母(saccharomyces cerevisiae)、乳酸克鲁维酵母(kluyveromyces lactis)或巴斯德毕赤酵母(pichia pastoris)。
[0138]
宿主细胞可以是原核细胞,例如细菌细胞。术语“细菌细胞”包括革兰氏阴性和革兰氏阳性微生物两者。合适的细菌可以来自埃希氏菌属(escherichia)、假单胞菌属(pseudomonas)、芽孢杆菌属(bacillus)、肠杆菌属(enterobacter)、乳杆菌属(lactobacillus)、乳球菌属(lactococcus)或链霉菌属(streptomyces)。细菌细胞可以来自以下物种:枯草芽孢杆菌、解淀粉芽孢杆菌、地衣芽孢杆菌、b. puntis、巨大芽孢杆菌(b. megaterium)、耐盐芽孢杆菌(b. halodurans)、短小芽孢杆菌(b. pumilus)、pseudomonas zeaxanthinifaciens、荧光假单胞菌或大肠杆菌。
[0139]
合适的细菌宿主细胞可以例如是假单胞菌属物种,例如荧光假单胞菌。
[0140]
多肽生产方法适用于本公开内容的方法中的多肽(例如,具有脱色酶活性的多肽,包括具有焦脱镁叶绿素酶活性的多肽)可以通过以下产生:在允许多肽表达的条件下,在合适的发酵培养基中培养如本文公开的宿主细胞,且产生多肽。本领域技术人员理解如何根据使用的宿主细胞来执行用于生产如本文公开的多肽的方法,例如ph、温度和发酵培养基的组成。可以在摇瓶中或者体积为0.5或1升或更大至10至100或更多立方米的发酵罐中培养宿主细胞。培养可以根据宿主细胞的需要好氧或厌氧地执行。在宿主细胞是假单胞菌属物种例如荧光假单胞菌的情况下,宿主细胞的培养在好氧条件下执行。
[0141]
有利地,例如通过本领域技术人员已知的离心或过滤,从发酵培养基中回收或分离如本文公开的多肽。具有焦脱镁叶绿素酶活性的多肽的回收还可以包括破碎多肽在其中产生的细胞。细胞的破碎可以使用玻璃珠和/或本领域技术人员已知的超声处理来执行。
[0142]
关于用具有脱色酶活性的多肽处理包含叶绿素衍生物的油的方法在一个实施方案中,本公开内容的方法还包括用如本文公开的具有脱色酶活性的多肽、或包含如本文上文公开的多肽的组合物处理包含叶绿素衍生物(例如焦脱镁叶绿素)的油。在一个实施方案中,如本文公开的多肽具有焦脱镁叶绿素酶活性。在另一个实施方案中,多肽具有脱镁叶绿素酶活性。在另一个实施方案中,多肽具有焦脱镁叶绿素酶活性和脱镁叶绿素酶活性。在另一个实施方案中,多肽具有焦脱镁叶绿素酶活性、脱镁叶绿素酶活性和叶绿素酶活性。
[0143]
如本文讨论的,具有焦脱镁叶绿素酶活性的多肽能够将焦脱镁叶绿素水解成焦脱镁叶绿酸,具有脱镁叶绿素酶活性的多肽能够将脱镁叶绿素水解成脱镁叶绿酸,并且具有
8、ph 5至ph 7、ph 5至8或ph 6.5至7.5。在一个实施方案中,在4.0至7.5、或4.5至8.0、或4.5至7.0的ph下,使多肽与油接触。在一个实施方案中,在4.0至5.0的ph下,或更具体地在4.5的ph下,使多肽与油接触。在另一个实施方案中,多肽在7.0的ph下接触。
[0149]
用于使包含一种或多种叶绿素底物的油与如本文公开的具有脱色酶活性的多肽接触的合适温度可以是10℃至90℃,例如20℃至80℃、30℃至70℃、45℃至70℃、40℃至60℃或50℃至65℃。
[0150]
例如,使包含一种或多种叶绿素底物的油与具有脱色酶活性的多肽接触,可以在5至8的ph和40℃至60℃的温度下、或在4.5至7.0的ph和40℃至60℃的温度下、或在7.0的ph和45℃至70℃的温度下、或在7.0的ph和50
°
c至65℃的温度下执行。
[0151]
可以将具有脱色酶活性的多肽以任何合适的量计量加入(dose)包含叶绿素底物的油中。例如,多肽可以以1至50 u/克处理的油的范围计量加入,例如1.4至50 u/克处理的油,或5至50 u/克处理的油。依照下文实施例中教导的酶活性定义一个单位。
[0152]
令人惊讶的是,发现与参考多肽相比,如本文公开的具有脱色酶例如焦脱镁叶绿素酶活性的多肽,在酸性和苛性碱条件下将更高量的叶绿素底物转换成叶绿素产物。参考多肽是包含根据seq id no: 12的氨基酸序列的多肽。seq id no: 12包含具有焦脱镁叶绿素酶活性的莱茵衣藻叶绿素酶。
[0153]
使包含一种或多种叶绿素底物的油与具有脱色酶活性的多肽接触可以在油脱胶过程中执行。油脱胶包括几个加工步骤,例如压榨和/或己烷提取、例如在脱胶酶如wo2005/086900或wo2011/046812中公开的磷脂酶的存在下的脱胶、精炼、漂白和除臭。使包含一种或多种叶绿素底物的油与具有焦脱镁叶绿素酶活性、脱镁叶绿素酶活性和/或叶绿素酶活性的多肽接触,可以在油脱胶加工中的漂白步骤期间执行,如下文更详细地描述的。
[0154]
使具有焦脱镁叶绿素酶活性的多肽与油例如三酰基甘油油或藻类油接触,可以包括将包含如本文公开的多肽的水溶液分散在油中。用具有焦脱镁叶绿素酶活性的多肽处理的油通常包含0.5至10 w/w%的水,例如1至10 w/w%的水、1至5 w/w%的水、2至8 w/w%的水、2至4 w/w%的水、3至6 w/w%的水、0.5至5 w/w%的水、1至3 w/w%、1.5至2 w/w%的水、或5 w/w%的水。
[0155]
多肽可以与油接触5分钟至24小时、10分钟至12小时、15分钟至10小时、0.5至24小时、1至12小时、1.5小时至6小时、或2至4小时的时间。在一个实施方案中,多肽可以与油接触2小时。在所述接触之后,通常将水相和油相分开。
[0156]
在如本文公开的方法中处理的油可以是粗制未脱胶的、脱胶的(水脱胶的、酶脱胶的或酸脱胶的)、苛性碱精炼的或苛性碱精炼且水洗涤的油或水脱胶油。在一个特定实施方案中,油包含未脱胶的粗制油。粗制油通常是机械压榨或溶剂提取的油,并且其中所述油通常含有游离脂肪酸(ffa)和磷脂。脱胶油是其中大部分磷脂已从粗制油中去除的油。通常,脱胶油包含0.5至200 ppm原子磷,例如1至100 ppm原子磷,例如5至50 ppm原子磷。精炼油是其中ffa已通过苛性碱处理中和且去除的油。油的苛性碱处理通常包括用氢氧化钠处理油。
[0157]
例如在油的脱胶过程中,使如本文公开的具有脱色酶(例如焦脱镁叶绿素酶)活性的多肽与油接触,可以在任何合适的温度下,例如在45至70℃,包括50至65℃的温度下执行。
[0158]
例如在油的脱胶过程中,使如本文公开的具有脱色酶(例如焦脱镁叶绿素酶)活性的多肽与油接触,可以在任何合适的ph下,例如3.5至8.0的ph,例如ph 4至7.5,例如ph 4.5至7.0下执行。
[0159]
在一个实施方案中,本文公开的处理方法进一步包括使油经受水脱胶。如本文讨论的,水脱胶通常应用于含有大量可水合磷脂的粗制油。由于其温和的特征,所获得的磷脂可以用作卵磷脂(天然乳化剂)。尽管仅是部分脱胶的,但从这种方法获得的油在行业中一般被称为“脱胶的”。
[0160]
因此,在一个方面,本公开内容的处理方法包括使包含叶绿素衍生物(例如叶绿素底物)的油(例如,未脱胶的粗制油)与水和本公开内容的多肽接触。通常,油的温度为45至70℃,包括50至65℃。水可以以1至5 w/w%,包括2至4 w/w%的量加入。多肽可以以1至50 u/克处理的油,例如1.4至50 u/克处理的油、或5至50 u/克处理的油的量计量加入。如本文公开的多肽和水可以作为单一组合物加入,或者多肽可以与水分开加入。通常,不将酸或碱加入所得到的混合物中,并且该方法在中性ph(例如,约ph 7.0)下进行。在与多肽和水接触之后,油可以任选地使用剪切混合器进行混合。随后使油伴随搅拌(例如,使用连续搅拌的反应器)温育0.5至24小时、或1至12小时、或1.5至6小时、或2至4小时,其有助于油中存在的磷脂的水合。在温育和搅拌之后,将油加热至70至85℃的温度。所得到的油可以通过沉降、过滤或离心的工业实践进行分离。离心机产生两个流,水脱胶油和湿胶。
[0161]
在另一个实施方案中,本文公开的处理方法进一步包括使油经受酶辅助水脱胶。如本文讨论的,酶辅助水脱胶通常应用于含有大量可水合磷脂的粗制油,其中目标是使所有可水合磷脂反应并且将其转换成二酰基甘油,增加油产率,同时维持油中不可水合的磷脂。用于这种方法的酶包括磷脂酶c(plc)和磷脂酰肌醇
‑
磷脂酶(pi
‑
plc)。
[0162]
因此,在一个方面,本公开内容的处理方法包括使包含叶绿素衍生物(例如叶绿素底物)的油(例如,未脱胶的粗制油)与水、本公开内容的多肽和另外的酶接触。另外的酶可以选自plc、pi
‑
plc及其组合。在一个实施方案中,另外的酶包括plc和pi
‑
plc两者。通常,油的温度为45至70℃,包括50至65℃。水可以以1至5 w/w%,包括2至4 w/w%的量加入。多肽可以以1至50 u/克处理的油,例如1.4至50 u/克处理的油、或5至50 u/克处理的油的量计量加入。plc(例如,purifine plc)可以以50至500 ppm,包括100至400 ppm、或150至250 ppm的量加入。pi
‑
plc可以以50至500 ppm,包括100至400 ppm、或150至250 ppm的量加入。在一个实施方案中,另外的酶是purifine 4g,其含有plc和pi
‑
plc两者。在该实施方案中,purifine 4g可以以50至500 ppm,包括100至400 ppm、或150至250 ppm的量加入。如本文公开的多肽、另外的酶和水可以作为单一组合物加入,或者如本文公开的多肽、另外的酶和水可以分开加入。通常,不将酸或碱加入所得到的混合物中,并且该方法在中性ph(例如,约ph 7.0)下进行。在与多肽、另外的酶和水接触之后,组合物可以任选地使用剪切混合器进行混合。合适的剪切混合器是连续剪切混合器ika dispax reactor。随后使组合物伴随搅拌(例如,使用连续搅拌的反应器)温育0.5至24小时、或1至12小时、或1.5至6小时、或2至4小时,其有助于油中的pc、pe、和pi转换为二酰基甘油。在温育和搅拌之后,将组合物加热至70至85℃,例如85℃的温度。所得到的组合物可以通过沉降、过滤或离心的工业实践进行分离。离心机产生两个流,水脱胶油和重相(含有水、变性蛋白质和磷化合物)。
[0163]
在另一个实施方案中,本文公开的处理方法进一步包括使油经受酶脱胶。酶脱胶
可以应用于粗制油或先前已通过不同方法脱胶的油,所述不同方法例如水脱胶、酶辅助水脱胶或酸脱胶。希望产生用于食物或工业市场的卵磷脂的处理器可以在进一步加工之前对油进行水脱胶。磷脂的破坏在卵磷脂应用中是无法接受的。
[0164]
因此,在一个方面,本公开内容的处理方法包括使包含叶绿素衍生物(例如叶绿素底物)的组合物,例如油(例如,粗制油或先前脱胶的油)与本公开内容的多肽接触。例如通过添加其量为100至1000 ppm,包括500 ppm的酸(例如,柠檬酸或磷酸),可以在与多肽接触之前调整油的ph。通常,将ph调整至4.5至8.0,包括4.5至7.0的ph。通常,在ph调整时油的温度为70至85℃。在酸添加之后,取决于混合器的类型(例如,高剪切、搅拌器等),所得到的油可以混合5分钟至24小时。本领域技术人员将理解,当使用高剪切混合器时将需要较短的混合时间,而当应用较小的剪切时(例如,当使用简单的搅拌器时)将需要较长的混合时间。在ph调整之后,将组合物(例如油)冷却至45至70℃,包括50至65℃,并且加入水、本公开内容的多肽和任选地另外的酶。另外的酶(当使用时)可以选自plc、pi
‑
plc及其组合。在一个实施方案中,另外的酶包括plc和pi
‑
plc两者。水可以以1至5 w/w%,包括2至4 w/w%的量加入。多肽可以以1至50 u/克处理的油,例如1.4至50 u/克处理的油、或5至50 u/克处理的油的量计量加入。plc(例如,purifine plc)可以以50至500 ppm,包括100至400 ppm、或150至250 ppm的量加入。pi
‑
plc可以以50至500 ppm,包括100至400 ppm、或150至250 ppm的量加入。在一个实施方案中,另外的酶是purifine 4g,其含有plc和pi
‑
plc两者。在该实施方案中,purifine 4g可以以50至500 ppm,包括100至400 ppm、或150至250 ppm的量加入。多肽、另外的酶(当存在时)和水可以作为单一组合物加入,或者多肽、另外的酶和水可以分开加入。
[0165]
在与多肽、另外的酶(当存在时)和水接触之后,组合物可以使用剪切混合器进行混合。合适的剪切混合器是连续剪切混合器ika dispax reactor。剪切混合是任选的,特别是当待处理的组合物是或包含粗制的未脱胶油时。随后将组合物搅拌(例如,使用连续搅拌的反应器)0.5至24小时,或1至12小时,或1.5至6小时,或2至4小时。
[0166]
在搅拌之后,将磷脂酶a(pla)酶加入油中。pla酶可以是pla1酶和/或pla2酶。在一个实施方案中,酶是pla1酶。具有磷脂酶活性的氨基酸序列在本领域得到广泛报道,包括在三酰基甘油油中具有活性的磷脂。具有磷脂酶活性的商业pla1酶包括lecitase
®ꢀ
ultra和quaralowp。具有磷脂酶活性的商业pla2酶包括rohalase xtra和lysomax。取决于制造商和所使用的连续搅拌槽反应器的类型,添加的任何合适的pla酶都可以改变。在pla酶添加之后,油可以使用剪切混合器进行混合。合适的剪切混合器是连续剪切混合器ika dispax reactor。随后使油伴随搅拌(例如,使用连续搅拌的反应器)温育。油可以与pla1酶一起温育,允许反应1至8小时、或2至7小时、或3至6小时。在温育和搅拌之后,将油加热至70至85℃,例如85℃的温度。取决于pla剂量和存在的不可水合的磷脂(nhp)(例如,磷脂酸的ca和mg盐)的水平,反应时间可能不同。所得到的油可以通过沉降、过滤或离心的工业实践进行分离。
[0167]
在另一个实施方案中,本公开内容的处理方法包括使包含叶绿素衍生物(例如叶绿素底物)的油,特别是精炼一次的油与本公开内容的多肽接触。通常,油的温度为45至70℃,包括50至65℃。多肽可以以1至50 u/克处理的油,例如1.4至50 u/克处理的油、或5至50 u/克处理的油的量计量加入。水可以以1至10 w/w%,包括2至8 w/w%、或3至6 w/w%、或5 w/
12在本文中也称为eldc94。
[0173]
seq id no: 13;spei位点和核糖体结合位点seq id no: 14;终止密码子和xhoi位点。
实施例
[0174]
材料和方法一般概述标准遗传技术,例如宿主细胞中酶的过表达、宿主细胞的遗传修饰或杂交技术,是本领域的已知方法,例如在sambrook和russel(2001)"molecular cloning: a laboratory manual(第3版),cold spring harbor laboratory,cold spring harbor laboratory press,或者f. ausubel等人,编辑,"current protocols in molecular biology",green publishing and wiley interscience,new york(1987)中描述的。当没有其它指定时,水是milli
‑
q水。
[0175]
分析方法:ph
ꢀ–ꢀ
加入油中的酸和碱/水百分比的化学计量添加。2000克反应中2百分比的水将是40克,加入2.0克50百分比的柠檬酸溶液,加上1.6 ml的4 m氢氧化钠将产生具有ph 4.5的水溶液。油的ph将始终保持7。
[0176]
皂
ꢀ–ꢀ
美国石油化学家协会官方方法cc 13a
‑
43,2017年修订。
[0177]
游离脂肪酸
ꢀ‑‑ꢀ
美国石油化学家协会官方方法ca 5a
‑
40,2017年修订。
[0178]
颜色
ꢀ–ꢀ
美国石油化学家协会官方方法ce 13e
‑
92,2017年重新批准。利用5
¼”
比色皿下的tintometer’s pfx
‑
950。
[0179]
磷和痕量金属
‑ꢀ
美国石油化学家协会官方方法ca 17
‑
01
‑
43,2017年修订。
[0180]
磷脂组合物 对于
31
p nmr方法(也称为31
‑
p nmr),将10
ꢀµ
l 10% dol分散体分散在1 ml含有去矿物质水的水性溶剂中,所述水性溶剂具有10%氧化氘(d2o,cambridge isotope laboratories,dlm
‑
4)、25 mg/ml脱氧胆酸(sigma d2510)、5.84 mg/ml edta di na(titriplex iii,merck 108418)和5.45 mg/ml tris碱(三(羟甲基)氨基甲烷,merck 108387),其中使用4n koh将ph调整至ph9,并且向其中加入2 mg/ml tip内部标准品(磷酸三异丙酯,aldrich 554669)(准确称重的)。
[0181]
所有样品都在具有prodigy bbo探针的bruker 400 mhz avanceiii nmr光谱仪中进行测量。探针头部的温度设定为300k。
[0182]
用半定量参数执行定量测量:128次扫描,90
°
脉冲,d1 = 5秒。值以
µ
mol/g样品的干重(dol)报告。
[0183]
通过uv/vis分析绿色含量
–ꢀ
aocs uv/vis方法用于测量油的绿色含量。aocs uv/vis方法在2017年重新批准的cc 13d
‑
55中进行描述。
[0184]
通过hplc
‑
flu分析叶绿素衍生物脱镁叶绿素a和b、以及焦脱镁叶绿素a和b及其脱镁叶绿环类、以及叶绿素和脱植基叶绿素的分析通过hplc使用荧光检测执行,该方法基于hwang等人j. food hyg. soc. japan第46卷,第2期,45
‑
48的工作开发,通过对于a化合物在λex 410 nm / λem 666 nm处且对于b化合物在λex 436 nm / λem 653 nm处的荧光检测扩展。
[0185]
关于吸附剂的含水量的分析通过将吸附剂加热至1750 f直到观察到恒定重量来测定以重量%计的含水量。含水量等于以百分比表示的损失的质量除以材料的原始质量。
[0186]
样品制备油样品在丙酮中进行稀释,1g油在9 ml丙酮中,并且以14000 rpm离心5分钟。将澄清的上清液转移到注射小瓶内,并且将10
ꢀµ
l样品注射到hplc内。由于叶绿素水平在所有实际的油样品中都是如此低,因此在分析中没有考虑这些。
[0187]
数据分析层析图的峰表面积(以任意单位)指示了油样品中存在的脱镁叶绿素、焦脱镁叶绿素、脱镁叶绿酸和焦脱镁叶绿酸的量。图2和图3显示了在ph 5和ph 7下,在与假定的叶绿素酶一起温育后,油样品中的脱镁叶绿素、焦脱镁叶绿素、脱镁叶绿酸和焦脱镁叶绿酸的峰表面积。显示了植酸钙镁的峰表面积之和,脱镁叶绿环类的峰表面积之和,以及个别化合物的峰表面积。脱镁叶绿酸和焦脱镁叶绿酸的形成分别是脱镁叶绿素酶活性和焦脱镁叶绿素酶活性存在的量度。
[0188]
酶purifine
®
磷脂酶c(plc)、以及purifine
®ꢀ
pi
‑
plc和真菌pla1得自dsm。
[0189]
purifine
®
磷脂酶c包含seq id no: 2的氨基酸38
‑
282,具有wo2005/086900中公开的氨基酸取代63d、131s和134dpurifine
®ꢀ
pi
‑
plc包含根据wo2011/046812中公开的seq id no: 8的成熟多肽。
[0190]
真菌pla1包含欧洲申请号ep18171015.3中公开的seq id no: 1的成熟氨基酸序列设备顶置混合器是具有平叶片桨的ika rw 20 digital。
[0191]
离心机是安装有用于连续分离的“the bowl unit”的de laval gyro
ꢀ–
tester。离心机转鼓用安装的旋塞螺钉进行封闭。
[0192]
剪切混合用具有g450转子定子的ultra
‑
turrax匀浆器sd
‑
45以10,000 rpm完成。
[0193]
二氧化硅吸附剂测试吸附剂sp
‑
2113、sp
‑
2114、sp
‑
2115、sp
‑
2116、sp
‑
2117和sp
‑
2119得自w.r. grace & co.
‑
conn.(columbia,md.)。trisyl
®
二氧化硅和trisyl
®ꢀ
300(w.r. grace & co.
‑
conn.,columbia,md.)是商购可得的。实施例中使用的各种二氧化硅和吸附剂的性质在下文阐述。
[0194]
实施例 1. 假单胞菌中的假定叶绿素酶的表达如图2和3的表中提供的假定叶绿素酶(chl)在从dow global technologies inc.(us20050130160、us20050186666和us20060110747)获得的假单胞菌属系统中表达。通过根据dna2.0的算法(genegps
®
技术)优化用于假单胞菌属的基因密码子使用,设计基于如图2
‑
2a和3中所示的假定叶绿素酶蛋白质序列的蛋白质序列的12种合成基因。为了克隆目的,dna序列含有在5'端处的spei位点和核糖体结合位点(actagtaggaggtaactaatg)(seq id no: 13)、以及在3'端处的终止密码子和xhoi位点(tgatgactcgag)(seq id no: 14)。
[0195]
seq id no: 2显示了编码大麦的假定叶绿素酶seq id no: 1的密码子优化的核酸序列。
[0196]
使用spei和xhoi限制性酶克隆,将dna序列插入pdow1169载体(dow global technologies inc.,us20080058262)中。然后将含有在修饰的tac启动子的控制下,编码chl和pph酶的基因的pdow1169载体引入荧光假单胞菌尿嘧啶营养缺陷型菌株dpfl0内。在不含尿嘧啶的m9基本培养基(dow global technologies inc.,us20050186666)上在30℃下温育48小时后选择转化的细胞(schneider等人2005)。
[0197]
在含有3 ml m9培养基的24孔预灭菌深孔板(axygen,ca,usa)中预培养正确的转化体。板通过breathseal(greiner bio
‑
one,frickenhausen,德国)进行覆盖,并且在microton培养箱振荡器(infors ag,bottmingen,瑞士)中在30℃、550 rpm和80%湿度下温育16小时。从这些培养物中,30 μl用于接种在30℃、550 rpm下含有3 ml m9培养基的第二块24孔预灭菌深孔板(axygen,ca,usa)24小时。在8小时后,用iptg(0.3 mm最终浓度)诱导培养物。通过以2750 rpm离心10分钟收获培养物,并且去除上清液。细胞团块在
‑
20℃下贮存过夜。将来自3 ml培养物的细胞团块悬浮于1 ml裂解缓冲液中,并且在37℃下温育一小时。裂解缓冲液(1mm edta、50 mm tris ph8、0.25 mg/ml溶菌酶、10 mg/ml dna酶i、25
ꢀµ
m mgso4和0.03%triton)。裂解物在2750 rpm下离心10分钟,并且取出上清液并贮存。
[0198]
实施例2. 粗制卡诺拉油中的无细胞提取物中的焦脱镁叶绿素酶活性的测定温育来自北美起源的高脱镁脱镁叶绿素和焦脱镁叶绿素的粗制卡诺拉油,以下述方式
用于确定如实施例1中产生的上清液中的酶对焦脱镁叶绿素a和b的活性。使用silverson混合器,在高剪切混合下,将缓冲液(5%(v/v))加入油中。对于ph 5,使用20mm柠檬酸缓冲液。对于ph 7,使用20mm磷酸盐缓冲液。24孔微量滴定板填充有1.425 ml油包缓冲液分散体/孔,并且向每孔中添加75 μl实施例1中产生的5%(v/v)无细胞提取物(上清液)。图2
‑
2a和图3的表中给出了测试样品列表,并且包括含有莱茵衣藻焦脱镁叶绿素酶的阳性参考和阴性对照绿色荧光蛋白(gfp)。微量滴定板用塑料箔[fasson s695]覆盖。每个孔都用个别的磁力搅拌棒搅拌。使用kbmd微量滴定板搅拌器,在50℃下执行温育。在24小时后获取样品,并且如上所述使用hplc
‑
flu分析脱镁叶绿素a和b、以及焦脱镁叶绿素a和b及其脱镁叶绿环类的存在。
[0199]
图2和图3中的结果显示了,仅chl26(来自大麦的假定叶绿素酶)能够在ph 7和ph 5下将所有脱镁叶绿素和焦脱镁叶绿素水解成其分别的(焦)脱镁叶绿酸。
[0200]
实施例3. 相对于时间,粗制卡诺拉油与chl26的温育以与实施例2中所述相同的方式,在ph 7下重复粗制卡诺拉油与如实施例1中所述产生的大麦假定叶绿素酶chl26的5%无细胞提取物的温育。在30分钟、2小时、5小时和24小时后获取样品。通过如上所述的hplc测量焦脱镁叶绿素a和b、以及脱镁叶绿素a和b、焦脱镁叶绿酸a和b以及脱镁叶绿酸a和b。
[0201]
表1中的反应产物焦脱镁叶绿酸a和b以及脱镁叶绿酸a和b的形成,表示为24小时后反应产物(分别的脱镁叶绿环类分子)的量的百分比。
[0202]
表2显示了以相对于在t=0时的值(4次测量的平均值)的百分比表示的,在0.5、2和5小时后,脱镁叶绿素和焦脱镁叶绿素根据时间的相对量。
[0203]
表1. 以相对于在24小时后的值的百分比,在ph 7和50℃下温育0.5、2、5和24小时后,所有反应产物的相对hplc结果。
[0204]
表 2. 以相对于在t=0时的值的百分比,在ph 7和50℃下温育0.5、2和5小时后,所有植酸钙镁化合物的相对hplc结果。
[0205]
表1和表2中的结果显示了,来自大麦的酶chl26能够水解脱镁叶绿素和焦脱镁叶绿素两者,以及a和b化合物两者。在2小时后,所有脱镁叶绿素都被转换(低于检测极限),而在5小时后,几乎所有焦脱镁叶绿素都被转换。
[0206]
实施例4. 通过10l生物反应器发酵生产chl26和eldc94菌株和接种物
u/g(0.04 w/w%)。
[0214]
实施例5. 相比于粗制卡诺拉油与来自莱茵衣藻的参考酶(eldc94)在各种条件下的温育,粗制卡诺拉油与衍生自大麦的具有焦脱镁叶绿素酶活性的酶(chl26)的温育使粗制卡诺拉油与0.5 w/w%的大麦假定叶绿素酶chl26的无细胞提取物一起温育,并且与0.04 w/w%的莱茵衣藻叶绿素酶(编码的eldc94 = ref)的无细胞提取物进行比较,两种酶均如实施例4中所述产生。温育在10 g的规模上执行(15 ml玻璃反应容器中的10 g油在具有温度控制的热板铝反应块上温育。内容物通过磁棒保持剧烈搅拌),并且现在在三个不同温度(40、50和60℃)下、以及在不同酸度的水相的四个方案下:酸性:400 ppm柠檬酸预处理;弱酸性:用500 ppm柠檬酸和138 ppm苛性碱(naoh)的预处理;中性:仅水;弱碱性:用150 ppm naoh的预处理。
[0215]
在温育期间的总含水量为3% w/w,其包括酶制剂和预处理溶液。在实验之前,通过用水将预处理的油1:1稀释来评价水性环境的酸度,然后通过ph计测量ph。这导致下述ph值,指示了在反应过程中的分散体中的水性环境的酸度:酸性:ph 3.4;弱酸性:ph 4.5;中性:ph 5.9和碱性ph 7.9。
[0216]
对于用柠檬酸的预处理,将柠檬酸(作为50% w/w溶液)在70℃下加入油中,在70℃下保持搅拌30分钟,随后将温度减少至温育温度,并且对于弱酸性条件,加入naoh(作为2.0% w/w溶液)。在仅加入naoh的情况下,将油在温育温度下搅拌30分钟。
[0217]
在温育期间,在0.5、2、4和24小时后获取样品,并且如实施例2中所述通过hplc
‑
flu进行分析,现在针对具有已知浓度的一组标准。所有底物(叶绿素、脱镁叶绿素、焦脱镁叶绿素
ꢀ‑ꢀ
a和b)和所有反应产物(脱植基叶绿素、脱镁叶绿酸、焦脱镁叶绿酸
ꢀ‑ꢀ
a和b)的浓度分别总计为以mg/kg油计的总底物和总反应产物。所有结果都在下表中以底物和反应产物的百分比给出。
[0218]
表3、4和5中的结果显示了,与来自莱茵衣藻的参考叶绿素酶相比,根据seq id no: 1的大麦酶chl26在酸和苛性碱的存在下具有更广泛的应用范围,并且在更高的温度下是活性的。
[0219]
表3. 在40℃下在不同条件下,在与来自大麦的chl26酶或来自莱茵衣藻的参考酶eldc94温育后,粗制卡诺拉油中的叶绿素衍生物(重量%)
表4在50℃下在不同条件下,在与来自大麦的chl26酶或来自莱茵衣藻的参考酶eldc94温育后,粗制卡诺拉油中的叶绿素衍生物(重量%)表5在60℃下在不同条件下,在与来自大麦的chl26酶或来自莱茵衣藻的参考酶eldc94温育后,粗制卡诺拉油中的叶绿素衍生物(重量%)
实施例6. 粗制卡诺拉油与来自莱茵衣藻的酶(eldc94)的温育,随后为用各种二氧化硅的处理将1,500克粗制卡诺拉油置于具有带方形桨的顶置混合器的2升夹套玻璃烧杯中,并且以90转/分钟(rpm)混合。夹套温度设定为65℃。一旦油温已达到设定点,就将20 ml eldc94衣藻属(chlamydomonas)(藻类)(如实施例4中所述制备的)和100克去离子水加入油中。在用塑料包装覆盖的同时,将材料剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且用塑料包装覆盖。材料在250 rpm下覆盖混合24小时。
[0220]
将1.5克50%(重量%)柠檬酸加入混合油中。夹套的设定点减少至55℃。一旦材料达到55℃,就将油移至剪切混合器。将1.2 ml 4 n naoh加入油中,并且剪切混合30秒。添加0.3克purifine
®
磷脂酶c(plc)和30克去离子水。在用塑料包装覆盖的同时,将油剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在55℃下以250 rpm混合2小时。
[0221]
将烧杯移回高剪切混合器,并且将0.1克磷脂酶a1(pla1)酶(lecitase ultra)加入油中,并且在用塑料包装覆盖的同时,剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在55℃下以250 rpm混合2小时。将水浴的设定点增加到75℃。一旦油达到75℃,就利用具有其中孔封闭的转筒(bowl)的gyro
‑
centrifuge将油离心。收集油的样品。将胶质弃去。
[0222]
将上述反应重复11次,并且将油合并且标记为“对照”。
[0223]
将上述酶处理的卡诺拉油“对照”的六个500克样品加入六个1000 ml圆底烧瓶中。将油加热至80℃,并且将0.25、1.0、2.0、4.0、6.0和8.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。出乎意料的是,在用测试二氧化硅的吸附过程期间,油变成深绿色。在使用工业二氧化硅(trisyl
®
(grace davison,columbia,md.)或sorbsil
®
二氧化硅(ineos silicas,joliet,ill.)的先前实验中,油的颜色并未改变。将真空打破并且用布氏漏斗过滤材料,滤纸盘呈深绿色,但当使用工业二氧化硅时,滤盘和滤饼始终呈黄色。滤盘和滤饼呈深绿色。
[0224]
将来自上文的上述酶处理的卡诺拉油“对照”的两个500克样品拆分开,并且加入具有吸附剂程序的配置的两个1000 ml圆底烧瓶中。将油加热至80℃,并且将1.0和2.0克二
氧化硅sp
‑
2116混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在试验期间油的颜色与原始颜色没有变化。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈黄色。
[0225]
将来自上文的上述酶处理的卡诺拉油“对照”的两个500克样品拆分开,并且加入具有吸附剂程序的配置的两个1000 ml圆底烧瓶中。将油加热至80℃,并且将1.0和2.0克二氧化硅sp
‑
2117混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在试验期间油的颜色与原始颜色没有变化。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈黄色。
[0226]
油的含量在表6和7中阐述。
[0227]
表6:在用各种二氧化硅进一步处理后,eldc94处理的油中的p、ca、mg和fe含量表7:在用各种二氧化硅进一步处理后,eldc94处理的油中的叶绿素衍生物含量
chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸b.d. = 低于检测n.d. = 未确定的在24小时后,eldc94衣藻属(藻类)酶将叶绿素和叶绿素衍生物的量从19.86 ppm降低到8.06 ppm(经由aocsuv/vis方法,从53.6到38.49 ppm)。然而,它不足以在工业过程中显著启用该方法。需要具有水解叶绿素和叶绿素衍生物的更大能力的酶,以及用于更大去除那些生成的衍生物的方法。
[0228]
上述数据证实了,与其它两种二氧化硅相比,二氧化硅sp
‑
2115具有去除金属、叶绿素和叶绿素衍生物的最大能力。uv/vis方法证实了,与对照中的叶绿素量(即38.49 ppm)相比,用低剂量(即0.25 g和1 g)的sp
‑
2115处理分别使叶绿素减少了2.20和12.84 ppm。相比之下,在用最低剂量(即,0.25 g)的sp
‑
2116和sp
‑
2117处理之后的叶绿素量分别增加了0.54 ppm和0.17 ppm,而与对照相比,在用最高剂量(即,1 g)的sp
‑
2116和sp2117处理之后的叶绿素量分别降低了1.98 ppm和1.83 ppm。hplc测试方法证实了对于sp
‑
2116和sp
‑
2117,在最高剂量下的有限减少的相同模式。数据还证实了,需要通过找到另外的标准和响应因子来改善用于叶绿素和叶绿素衍生物的hplc方法,以便使其更接近于用于测量植物油中的绿色的aocs方法。关于该方法的另外工作已完成,并且包括在下述实施例中。
[0229]
实施例7. 与来自莱茵衣藻的参照酶(eldc94)相比,溶剂提取的粗制卡诺拉油与
衍生自大麦的具有焦脱镁叶绿素酶活性的酶(chl26)的温育将35磅容器的溶剂提取的粗制卡诺拉油倒入大型不锈钢容器内,并且用ika混合器使得均匀。
[0230]
在混合后,将大约1.5 kg粗制卡诺拉置于具有带方形桨的顶置混合器的2升夹套玻璃烧杯中,并且以90转/分钟(rpm)混合。夹套温度设定为65℃。一旦油温已达到设定点,就将如实施例4所述产生的0.7克酶eldc94(反应1)或7.5克chl26(反应2)连同100克去离子水一起加入油中。在用塑料包装覆盖的同时,将材料剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且用塑料包装覆盖。使材料在250 rpm下与酶一起温育24小时。
[0231]
将1.5克50%(重量%)柠檬酸加入混合油中。夹套的设定点减少至55℃。一旦材料达到55℃,就将油移至剪切混合器。将1.2 ml 4 n naoh加入油中,并且剪切混合30秒。添加0.3克purifine
®
磷脂酶c(plc)和30克去离子水。在用塑料包装覆盖的同时,将油剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在55℃下以250 rpm混合2小时。
[0232]
将烧杯移回高剪切混合器,并且将0.1克真菌磷脂酶a1(pla1)酶加入油中,并且在用塑料包装覆盖的同时,剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在55℃下以250 rpm混合2小时。将水浴的设定点增加到75℃。一旦油达到75℃,就利用具有其中孔封闭的转筒的gyro
‑
centrifuge将油离心。收集油的样品和胶质,并且如上所述分析p、ca、mg和fe以及叶绿素衍生物(使用hplc)的存在。
[0233]
将离心机转筒中剩余的油和重相的混合物倒入400 ml烧杯内,在其中倾析出油。将剩余的油和重相置于50 ml离心管内并旋转。弃去来自倾析的转筒和管中的油,并且合并液体重相。
[0234]
表8和图4 a)中的结果显示了,根据seq id no: 1的具有焦脱镁叶绿素酶活性的chl26酶能够减少溶剂提取的粗制卡诺拉油中的叶绿素衍生物。叶绿素底物是叶绿素、脱镁叶绿素和焦脱镁叶绿素,并且叶绿素产物是脱植基叶绿素、脱镁叶绿酸和焦脱镁叶绿酸。
[0235]
表8. 在用酶chl26和参考酶eldc94处理后,粗制卡诺拉油中的化合物(以ppm计)图4 b)中的结果显示了,在收集的重相中仍存在未反应的磷脂,其指示了磷脂酶反应时间太短而无法完成。
[0236]
实施例8. 在不同条件下压榨的粗制卡诺拉油与chl26酶的温育,并且用二氧化硅sp
‑
2115处理将35磅容器的压榨的粗制卡诺拉油倒入大型不锈钢容器内,并且用ika混合器使
得均匀。
[0237]
反应3
ꢀ‑ꢀ
chl26与plc和pi
‑
plc在ph 4.5下温育2小时,随后与pla1温育2小时将约1.5 kg粗制卡诺拉置于具有带方形桨的顶置混合器的2升夹套玻璃烧杯中。油在90 rpm下混合。夹套温度设定为70℃。将1.5克50%(重量%)柠檬酸加入混合油中,并且剪切混合1分钟。夹套的设定点减少至60℃。一旦材料达到60℃,就将油移至剪切混合器。将1.2 ml 4 n naoh加入油中,并且剪切混合30秒。0.3克purifine plc(lr79.14 2018年2月)、0.02克purifine pi
‑
plc、如实施例4中所述产生的7.5克chl26酶[大麦双棱变种(hordeum vulgare var. distichum)(大麦,植物)]和100克去离子水。在用塑料包装覆盖的同时,将材料剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在60℃下以250 rpm混合2小时。
[0238]
将夹套玻璃烧杯再次移至剪切混合器,在其中加入0.075克pla1(notebook,0743b2),并且将油剪切混合1分钟。将夹套玻璃烧杯移回顶置混合器,并且用塑料包装覆盖。将油混合并且允许反应在250 rpm下持续2小时。将水浴的设定点增加到75℃。一旦油达到75℃,就利用具有其中孔封闭的转筒的gyro
‑
centrifuge将油离心。收集油的样品和胶质。
[0239]
将离心机转筒中剩余的油和重相的混合物倒入400 ml烧杯内,在其中倾析出油。将剩余的油和重相置于50 ml离心管内并旋转。弃去来自倾析的转筒和管中的油,并且合并液体重相。
[0240]
反应4
ꢀ‑ꢀ
eldc94与plc和pi
‑
plc在ph 4.5下温育2小时,随后与pla1温育2小时使用0.61克配制的酶溶液(如实施例4中所述产生的),对于酶eldc94采用来自上文反应1的相同程序。
[0241]
将反应4酶处理的卡诺拉油的两个450克样品拆分开,并且加入具有吸附剂程序的配置的两个1000 ml圆底烧瓶中。将油加热至80℃,并且将1.0和2.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在用测试二氧化硅的吸附过程期间,油变成深绿色。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0242]
反应5
ꢀ‑ꢀ
chl26与plc和pi
‑
plc在ph 4.5下温育2小时,随后与pla1温育4小时遵循与反应1相同的程序,但允许pla1反应4小时而不是仅2小时。
[0243]
将反应5酶处理的卡诺拉油的两个450克样品拆分开,并且加入具有吸附剂程序的配置的两个1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0和3.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0244]
反应6
ꢀ‑ꢀ
chl26与plc和pi
‑
plc在ph 4.5下温育2小时,随后与pla1温育4小时遵循与反应3相同的程序,除了将两倍量的chl26(总共15克)加入反应之外。
[0245]
将反应6酶处理的卡诺拉油的两个450克样品拆分开,并且加入具有吸附剂程序的配置的两个1000 ml圆底烧瓶中。将油加热至80℃,并且将1.0和2.0 g二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0246]
反应7
ꢀ‑ꢀ
chl26与plc和pi
‑
plc在中性ph下温育2小时,随后与pla1温育4小时
遵循与反应1相同的程序,除了不进行ph调整之外。
[0247]
反应8
ꢀ‑ꢀ
sbo chl26与plc和pi
‑
plc在ph 4.5下温育2小时,随后与pla1温育2小时遵循与反应1相同的程序,但油是溶剂提取的粗制大豆油(sbo)。
[0248]
将反应8酶处理的大豆油的三个450 g样品拆分开,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将0.25、0.5和1.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0249]
在表9和图5b)中,显示了在根据反应1至6的酶处理之前和之后,油和分别的胶质中的磷(p)、钙(ca)、镁(mg)和铁(fe)含量。与在ph 4.5下的反应相比,在中性ph下,更高量的p保留在油中。表9还显示了在用二氧化硅sp
‑
2115处理之后,油中的p、ca、mg和fe含量。该数据证实了,二氧化硅处理将痕量磷和金属去除到足以满足漂白油的工业标准的水平,而无需使用漂白土。当添加mgo时,它们并未丧失其吸附这些杂质的能力。
[0250]
表10和图5a)中的结果显示了,当酶在相同条件下温育时(反应1和2),与eldc94相比,chl26酶转换了粗制卡诺拉油中更高量的叶绿素衍生物。表10还显示了,相比于未进一步与二氧化硅接触的酶的处理油中的叶绿素底物和产物量,使酶处理的油与二氧化硅sp
‑
2115接触减少了油中的叶绿素底物和叶绿素产物两者的量。
[0251]
在本实施例中,与酸性条件(ph 4.5)相比,chl26酶在中性条件下将粗制卡诺拉油中较高量的叶绿素底物转换成分别的叶绿素产物(将反应7与反应3、5和6进行比较)。
[0252]
chl26酶还将大豆油中的叶绿素底物转换成分别的叶绿素产物(反应8)。
[0253]
表10中的结果还显示了,相比于与eldc94酶的反应,当油与chl26酶反应时,在胶质(重相)中发现更高量的叶绿素产物。
[0254]
表9. 与参考酶eldc94和/或无酶处理和/或二氧化硅处理后相比,用chl26酶处理后的卡诺拉油(can)或大豆油(sbo)中的化合物
b.d.
ꢀ‑ꢀ
低于检测tr
ꢀ‑ꢀ
痕量表10. 与参考酶eldc94和/或无酶处理和/或二氧化硅处理后相比,用chl26酶处理后的卡诺拉油或大豆油和分离的胶质中的叶绿素衍生物
b.d.
ꢀ‑‑ꢀ
低于检测实施例9. 在卡诺拉油和大豆油的苛性碱精炼应用中使用chl26酶和二氧化硅处理下述实验是在苛性碱精炼应用中chl26的评估,其中油已用磷酸和氢氧化钠进行处理,如在卡诺拉油和大豆油的工业过程中发生的。“精炼一次的”产物是这样的油,其用磷酸进行处理,然后用氢氧化钠进行处理,以将游离脂肪酸(ffa)转换成钠皂,所述钠皂是水溶性的,并且在“精炼”离心机的水或“重”相中去除。然后用水(2至10百分比 w/w)洗涤油,以去除油中存在的剩余皂和残留磷脂。任选地,在水洗步骤中的精炼离心机后评估酶,但在低得多的温度下。
[0255]
用高剪切混合器将五加仑塑料桶的精炼一次的卡诺拉(orcan)油混合,以使得均匀。抽取2
‑
3 kg样品用于下文实验中。
[0256]
反应9
ꢀ‑ꢀ
eldc94
‑
比较将2 kg精炼一次的卡诺拉置于热板上的4升玻璃烧杯内,伴随在90 rpm下的顶置混合。将油在搅动下加热至60℃。一旦材料达到60℃,就将烧杯移至剪切混合器。将0.8克酶
eldc94(如实施例4中所述产生的)和100克去离子水加入油中。在用塑料包装覆盖的同时,将材料剪切混合1分钟,以使水损失降到最低。将玻璃烧杯移回顶置混合器,并且用塑料包装覆盖。油在60℃下以250 rpm混合4小时。将温度增加到75℃。利用gyro
‑
centrifuge将油离心。收集分离的油。
[0257]
将离心机转筒中剩余的油和重相的混合物倒入400 ml烧杯内,在其中倾析出油。将剩余的油和重相置于50 ml离心管内并旋转。弃去来自倾析的转筒和管中的油,并且合并液体重相。重相呈深绿色。
[0258]
反应10
ꢀ‑ꢀ
eldc94
‑
比较反应10是反应9的重复,除了使用3 kg油和2.0克eldc94(如实施例4中所述产生的)之外。
[0259]
在分析来自反应9和10的油后,将油合并混合并且再次进行分析。
[0260]
反应11
ꢀ‑ꢀ
chl26反应11是反应9的重复,除了使用10.1克chl26(如实施例4所述产生)代替eldc94之外。重相是比反应9和10更浅的绿色。
[0261]
反应12
ꢀ‑ꢀ
chl26反应12是反应10的重复,除了利用20克chl26之外。
[0262]
在分析后,将反应11和12的油合并且混合,并且在混合后再次进行分析。
[0263]
反应13
ꢀ‑ꢀ
eldc94
‑
比较在水洗涤离心机后,从苛性碱精炼生产线编号1中抽取3 kg精炼一次的大豆油(orsbo)。将油置于4升玻璃烧杯内,并且置于具有带方形混合桨(90 rpm)的顶置混合的热板上。一旦材料冷却到60℃,就将烧杯移至剪切混合器。将1.0克eldc94酶(如实施例4中所述产生的)和150克去离子水加入油中。在用塑料包装覆盖的同时,将材料剪切混合1分钟,以使水分损失降到最低。将玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在60℃下以250 rpm混合4小时。将温度增加到75℃,然后利用gyro
‑
centrifuge将油离心。
[0264]
收集的油和重样品用于进一步分析。
[0265]
将离心机转筒中剩余的油和重相倒入400 ml烧杯内,在其中倾析出油。将剩余的油和重相置于50 ml离心管内并旋转。弃去管中剩余的油,并且合并液体重相。重相是无色的,没有可辨别的有色颜料。
[0266]
反应14
ꢀ‑ꢀ
chl26反应14是反应13的重复,除了利用15克chl26(如实施例4所述产生)代替eldc94之外。
[0267]
反应15
ꢀ‑ꢀ
edlc94
‑
比较在水洗涤离心机后,从苛性碱精炼生产线编号1中抽取3 kg精炼一次的大豆油(orsbo)。将油置于4升玻璃烧杯内,并且置于具有带方形混合桨(90 rpm)的顶置混合的热板上。一旦材料冷却到60℃,就将烧杯移至剪切混合器。将1.2克eldc94酶(如实施例4中所述产生的)和150克去离子水加入油中。在用塑料包装覆盖的同时,将材料剪切混合1分钟,以使水分损失降到最低。将玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在60℃下以250 rpm混合4小时。将温度增加到75℃,然后利用gyro
‑
centrifuge将油离心。
[0268]
收集的油和重相(克)样品用于进一步分析。
[0269]
将离心机转筒中剩余的油和重相倒入400 ml烧杯内,在其中倾析出油。将剩余的油和重相置于50 ml离心管内并旋转。弃去管中剩余的油,并且合并液体重相。重相是无色的,没有可辨别的有色颜料。
[0270]
反应16
ꢀ‑ꢀ
chl26反应16是反应15的重复,除了利用15克chl26之外。
[0271]
反应9至16的结果以及来自反应9和10以及来自反应11和12的合并且混合的油的结果显示于表11和图6
‑
6a中。
[0272]
表9和图6
‑
6a中的结果显示了,与参考叶绿素酶eldc94相比,具有焦脱镁叶绿素酶的酶chl26将更高量的叶绿素底物(叶绿素、脱镁叶绿素和焦脱镁叶绿素)转换成其叶绿素产物(脱植基叶绿素、脱镁叶绿酸、焦脱镁叶绿酸)。
[0273]
表11. 在苛性碱精炼以及用chl26酶和eldc94(参考)酶处理后,精炼一次的卡诺拉油(orcan)和精炼一次的大豆油(orsbo)中的叶绿素衍生物(底物和产物)b.d. = 低于检测n.m. = 未测量表12的结果显示了在上述酶促处理后,在精炼一次的卡诺拉油和精炼一次的大豆油中的游离脂肪酸(ffa)、皂和磷以及ca、mg、fe和/或叶绿素含量。
[0274]
表12. 在苛性碱精炼以及用chl26酶和eldc94(参考)酶处理后,精炼一次的卡诺拉油(orcan)、精炼一次的大豆(orsbo)油的组成
tr = 痕量b.d. = 低于检测n.m. = 未测量t.d. = 太暗而无法测量
* = hplc是总叶绿素衍生物的测量反应9和10
ꢀ‑ꢀ
二氧化硅处理将来自反应9和10的油合并,然后拆分成酶处理的orcan油的三个500克样品,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将1.0、2.0和3.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在用测试二氧化硅的吸附过程期间,油变成深绿色。将真空打破并且用布氏漏斗过滤材料。滤纸盘呈深绿色。将这些油分别标记为9101、9102和9103。标记为9100的油是反应9和反应10合并的样品。
[0275]
将处理的卡诺拉油9102(436克)和9103(448克)合并,并且置于3 l克莱森烧瓶中。油用氮喷射大约2分钟。启动真空,并且中断氮喷射,并且允许来自蒸汽发生器的水蒸气开始除臭过程。在除臭过程期间达到的真空为0.82
ꢀ‑ꢀ
0.98 mbar。在真空和水喷射(3重量%)下,将油加热至230℃。喷射和温度维持两小时。中断加热并且允许油在真空和水喷射下冷
却。在大约100℃下用氮打破真空,并且在向空气开放之前允许进一步冷却至70℃。油呈深绿色/灰色色调。将油标记为91023
‑
deo。
[0276]
表13中的结果显示了在如上所述的二氧化硅处理之后,合并的反应9和10油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和叶绿素含量。
[0277]
表13:在酶处理或酶和二氧化硅处理后,精炼一次的卡诺拉油(orcan)的组成tr = 痕量b.d. = 低于检测n.m. = 未测量t.d. = 太暗而无法测量
* = hplc是总叶绿素衍生物的测量表14中的结果显示了在如上所述的二氧化硅处理之后,合并的反应9和10油中的叶绿素底物和产物。
[0278]
表 14:在酶和二氧化硅处理后,油中的叶绿素底物和产物组成chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物b.d.=低于检测来自使用如根据hplc方法报告的18.71 ppm eldc94的反应的合并样品的进料材料,显示了在用sp
‑
2115处理之后底物急剧减少至14.04 ppm、以及在用sp
ꢀ‑ꢀ
2115处理之后合并样品中的产物从0.39 ppm到低于检测极限的完全去除。
[0279]
反应11和12
ꢀ‑ꢀ
二氧化硅处理将来自反应11和12的油合并,然后拆分成酶处理的orcan油的三个500克样品,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将1.0、2.0和3.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。将这些油分别标记为11121、11122和11123。标记为11120的油是反应11和反应12油的合并样品。
[0280]
将处理的卡诺拉油11122(449克)和11123(451克)合并,并且置于3 l克莱森烧瓶中,并且根据除臭程序组装。油用氮喷射大约2分钟。启动真空,并且中断氮喷射,并且允许来自蒸汽发生器的水蒸气开始除臭过程。在除臭过程期间达到的真空为0.28
ꢀ‑ꢀ
0.56 mbar。在真空和水喷射(3重量%)下,将油加热至230℃。喷射和温度维持两小时。中断加热并且允许油在真空和水喷射下冷却。在大约100℃下用氮打破真空,并且在向空气开放之前允许进一步冷却至70℃。油呈浅绿色/灰色色调。将油标记为111223
‑
deo。
[0281]
表15中的结果显示了在如上所述的二氧化硅处理之后,合并的反应11和12油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和叶绿素含量。
[0282]
表15:在酶处理或酶和二氧化硅处理后,精炼一次的卡诺拉油(orcan)的组成tr = 痕量b.d. = 低于检测n.m. = 未测量t.d. = 太暗而无法测量* = hplc是总叶绿素衍生物的测量表16中的结果显示了在如上所述的二氧化硅处理之后,合并的反应11和12油中的叶绿素底物和产物。
[0283]
表16:在酶处理或酶和二氧化硅处理后,油中的叶绿素底物和产物组成chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物b.d.=低于检测来自使用如根据hplc方法报告的18.19 ppm chl26的反应的合并样品的进料材料,显示了在用sp
‑
2115处理之后底物从12.00到3.95 ppm的急剧减少、以及产物从6.19 ppm到0.17 ppm的减少。明确的是,sp
‑
2115对于chl26酶促反应的底物和产物两者均具有在
吸附过程中用于其去除的能力。
[0284]
反应5和13
ꢀ‑ꢀ
二氧化硅处理。sp
‑
2114和sp
‑
2115的比较将来自反应13的酶处理的精炼大豆油的三个500克样品拆分开,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将0.5、1.0和2.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。将这些油分别标记为135、1310和1320。标记为130的油是来自反应13的样品。
[0285]
将来自反应5的酶处理的精炼大豆油的500克样品加入具有吸附剂程序的配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0克二氧化硅sp
‑
2114混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在吸附过程期间观察到油的颜色变化呈绿色/棕色。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈浅绿色。将样品标记为132
‑
2114。
[0286]
表17中的结果显示了在如上所述的二氧化硅处理之后,反应5和反应13油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和叶绿素含量。
[0287]
表17:在酶处理或酶和二氧化硅处理后,油的组成b.d. = 低于检测n.m. = 未测量* = hplc是总叶绿素衍生物的测量表18中的结果显示了在如上所述的二氧化硅处理之后,反应5和13油中的叶绿素底物和产物。
[0288]
表18:在酶处理或酶和二氧化硅处理后,油中的叶绿素底物和产物组成chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物b.d.=低于检测
nd = 未检测到在sp
‑
2114和sp
‑
2115的直接比较中,sp
‑
2114不如sp
‑
2115良好,但与使用sp
‑
2115所达到的41 ppb相比,能够将反应13油中的叶绿素从298 ppb减少到104 ppb,如根据uv/vis方法报告的。
[0289]
反应14
ꢀ‑ꢀ
二氧化硅处理。sp
‑
2113、sp
‑
2115和sp
‑
2119的比较将来自反应14的酶处理的精炼大豆油的三个500克样品拆分开,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将0.5、1.0和2.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。将这些油分别标记为145、1410和1420。标记为140的油是反应14的样品。
[0290]
将来自反应14的酶处理的精炼大豆油的500克样品加入具有吸附剂程序的配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0克二氧化硅sp
‑
2113混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在吸附过程期间没有观察到油的颜色的变化。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈黄色。将样品标记为142
‑
2113。
[0291]
将来自反应14的酶处理的精炼大豆油的500克样品加入具有吸附剂程序的配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0克二氧化硅sp
‑
2119混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。在吸附过程期间没有观察到油的颜色的变化。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈黄色。将样品标记为142
‑
2119。
[0292]
将酶处理和二氧化硅处理的精炼一次的大豆油样品1420(471克)和1410(461克)合并,并且置于3 l克莱森烧瓶中,并且根据除臭程序组装。油用氮喷射大约2分钟。启动真空,并且中断氮喷射,并且允许来自蒸汽发生器的水蒸气开始除臭过程。在除臭过程期间达到的真空为0.28
ꢀ‑ꢀ
0.56 mbar。在真空和水喷射(3重量%)下,将油加热至230℃。喷射和温度维持两小时。中断加热并且允许油在真空和水喷射下冷却。在大约100℃下用氮打破真空,并且在向空气开放之前允许进一步冷却至70℃。油是无色的,没有绿色调。将油标记为14101420
‑
deo。
[0293]
表19中的结果显示了在如上所述的二氧化硅处理之后,反应14油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和叶绿素含量。
[0294]
表19:在酶处理或酶和二氧化硅处理后,orsbo的组成
b.d. = 低于检测n.m. = 未测量* = hplc是总叶绿素衍生物的测量表20中的结果显示了在如上所述的二氧化硅处理之后,反应14油中的叶绿素底物和产物。
[0295]
表20:在酶处理或酶和二氧化硅处理后,orsbo中的叶绿素底物和产物组成chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物b.d.=低于检测与用sp
‑
2115处理的样品不同,用sp
‑
2113或sp
‑
2119处理的样品并未证实用于去除叶绿素的任何活性,如通过uv/vis方法测量的。这种方法由行业接受。
[0296]
反应15
ꢀ‑ꢀ
二氧化硅处理和/或除臭将来自反应15的酶处理的精炼大豆油的三个500 g样品拆分开,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将0.5、1.0和2.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。将这些油分别标记为155、1510和1520。标记为150的油是反应15的样品。
[0297]
将酶处理和二氧化硅处理的精炼一次的大豆油样品1520(457克)和1510(461克)合并,并且置于3 l克莱森烧瓶中,并且根据除臭程序组装。油用氮喷射大约2分钟。启动真
空,并且中断氮喷射,并且允许来自蒸汽发生器的水蒸气开始除臭过程。在除臭过程期间达到的真空为0.57
ꢀ‑ꢀ
0.97 mbar。在真空和水喷射(3重量%)下,将油加热至230℃。喷射和温度维持两小时。中断加热并且允许油在真空和水喷射下冷却。在大约100℃下用氮打破真空,并且在向空气开放之前允许进一步冷却至70℃。油是无色的,没有绿色调。将油标记为15101520
‑
deo。
[0298]
将没有任何吸附剂处理、来自反应15的618克酶处理的油置于3 l克莱森烧瓶中,并且根据除臭程序组装。油用氮喷射大约2分钟。启动真空,并且中断氮喷射,并且允许来自蒸汽发生器的水蒸气开始除臭过程。在除臭过程期间达到的真空为1.15
ꢀ‑ꢀ
1.40 mbar。在真空和水喷射(3重量%)下,将油加热至230℃。喷射和温度维持两小时。中断加热并且允许油在真空和水喷射下冷却。在100℃下用氮打破真空,并且在向空气开放之前允许冷却至70℃。油是无色的,没有任何绿色调。将油标记为150
‑
deo。
[0299]
表21中的结果显示了在如上所述的除臭和/或二氧化硅处理之后,反应15油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和叶绿素含量。
[0300]
表21:在酶处理或酶和二氧化硅处理后,油的组成tr = 痕量b.d. = 低于检测n.m. = 未测量* = hplc是总叶绿素衍生物的测量表22中的结果显示了在如上所述的除臭和/或二氧化硅处理之后,反应15油中的叶绿素底物和产物。结果证实需要吸附剂来去除最终较暗的颜色。
[0301]
表22:在酶处理或酶和二氧化硅处理后,油中的叶绿素底物和产物组成
chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物b.d.=低于检测反应16
ꢀ‑ꢀ
二氧化硅处理或除臭将来自反应16的酶处理的精炼大豆油的三个500克样品拆分开,并且加入具有吸附剂程序的配置的三个1000 ml圆底烧瓶中。将油加热至80℃,并且将0.5、1.0和2.0克二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。将油标记为165、1610和1620。标记为160的油是来自反应16的样品。
[0302]
将没有任何吸附剂处理、825.3克酶处理的油置于3 l克莱森烧瓶中,并且根据除臭程序组装。油用氮喷射大约2分钟。启动真空,并且中断氮喷射,并且允许来自蒸汽发生器的水蒸气开始除臭过程。在除臭过程期间达到的真空为1.15
ꢀ‑ꢀ
1.40 mbar。在真空和水喷射(3重量%)下,将油加热至230℃。喷射和温度维持两小时。中断加热并且允许油在真空和水喷射下冷却。在100℃下用氮打破真空,并且在向空气开放之前允许冷却至70℃。预计颜色变绿,但是非常轻微的红色,没有绿色调。将样品标记为160
‑
deo。
[0303]
表23中的结果显示了在如上所述的除臭或二氧化硅处理之后,反应16油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和叶绿素含量。
[0304]
表23:在酶处理或酶和二氧化硅处理后,油的组成tr = 痕量b.d. = 低于检测n.m. = 未测量* = hplc是总叶绿素衍生物的测量
表24中的结果显示了在如上所述的除臭或二氧化硅处理之后,反应16油中的叶绿素底物和产物。结果证实需要用吸附剂处理用于最终的绿色去除。
[0305]
表24:在酶处理或酶和二氧化硅处理后,油中的叶绿素底物和产物组成chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物b.d.=低于检测nd = 未检测到实施例10:精炼一次的卡诺拉(orcan)油与chl26酶一起温育,并且用二氧化硅sp
‑
2115或商业二氧化硅或漂白粘土处理用高剪切混合器将五加仑塑料桶的精炼一次的卡诺拉(orcan)油混合,以使得均匀。抽取样品以用于下述实验中。
[0306]
反应17
ꢀ‑ꢀ
chl26将3,000克精炼一次的卡诺拉油置于热板上的4升玻璃烧杯内,伴随顶置混合。将油在搅动下加热至60℃。一旦材料达到60℃,就将油移至剪切混合器。加入15 g脱色酶chl26(如实施例4中所述制备的)和150 g去离子水。将材料剪切混合1分钟。将玻璃烧杯移回顶置混合器,并且用塑料包装覆盖。油在60℃下混合4小时。将油温增加到75℃,并且利用具有其中孔封闭的转筒的gyro
‑
centrifuge将油离心。收集油和重样品。
[0307]
将转筒中剩余的油和重相倒入400 ml烧杯内,在其中倾析出油。将剩余的油和重相置于50 ml离心管内并旋转。弃去管中剩余的油,并且合并液体重相。重相呈深绿色。
[0308]
反应18
‑
20
ꢀ‑ꢀ
chl26将3000克精炼一次的卡诺拉油置于4升夹套玻璃烧杯内。将温度设定为60℃。一旦材料达到60℃,就将油移至剪切混合器。将15 g脱色酶chl26(如实施例4中所述制备的)和150 g去离子水加入热油中。将材料剪切混合1分钟。将玻璃烧杯移回顶置混合器,并且再次用塑料包装覆盖。油在60℃下混合4小时。将油温增加到75℃,并且利用具有其中孔封闭的转筒的gyro
‑
centrifuge将油离心。该程序重复3次,并且收集油并合并用于反应18
‑
20。
[0309]
反应17
ꢀ‑ꢀ
用sp
‑
2115的二氧化硅处理将来自反应17的500克精炼一次的卡诺拉油加入具有上述设备配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0 g二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。除了使用4、6和8克二氧化硅sp
‑
2115之外,在相同条件下重复该实验。
[0310]
反应18
‑
20
ꢀ‑ꢀ
二氧化硅处理。sp
‑
2115与商业二氧化硅和漂白粘土的比较
来自合并反应18
‑
20的精炼一次的卡诺拉油用商购可得的二氧化硅(trisyl
®ꢀ
300)、漂白粘土(clariant 126ff)或两个分开批次的sp
‑
2115进行处理,如下所述。
[0311]
将来自合并的反应18
‑
20的500克精炼一次的卡诺拉油加入具有上述设备配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0 g trisyl
®ꢀ
300混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃,并且将油混合30分钟。将真空打破并且用布氏漏斗过滤材料。
[0312]
将来自合并的反应18
‑
20的500克精炼一次的卡诺拉油加入具有上述设备配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0 g漂白粘土tonsil
®ꢀ
supreme 126 ff(clariant)混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃,并且将油混合30分钟。将真空打破并且用布氏漏斗过滤材料。
[0313]
将来自合并的反应18
‑
20的500克精炼一次的卡诺拉油加入具有上述设备配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0 g 第一批次的二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃,并且将油混合30分钟。将真空打破并且用布氏漏斗过滤材料。
[0314]
将来自合并的反应18
‑
20的500克精炼一次的卡诺拉油加入具有上述设备配置的1000 ml圆底烧瓶中。将油加热至80℃,并且将2.0 g 第二批次的二氧化硅sp
‑
2115混合到油内,并且添加大约100 mbar的真空。将温度增加到100℃,并且将油混合30分钟。将真空打破并且用布氏漏斗过滤材料。
[0315]
表25中的结果显示了在如上所述用二氧化硅sp
‑
2115、trisyl
®
二氧化硅或漂白粘土处理之后,反应17油或合并的反应18
‑
20油中的游离脂肪酸(ffa)、皂、p、ca、mg、fe和钠(na)含量。
[0316]
表25:在用chl26处理或者用chl26和sp
‑
2115、trisyl
®
300二氧化硅或漂白粘土处理后,油的组成 油皂ffapcamgfena
ꢀꢀ
(ppm)(%)(ppm)(ppm)(ppm)(ppm)(ppm)精炼一次的can1710.094.81.10.20.1011.4反应17
–
chl26canb.d.0.051.01.9tr0.05b.d.反应17
–
2.0gsp
‑
2115cann.m.0.05b.d.0.5b.d.0.02b.d.反应17
–
4.0gsp
‑
2115cann.m.0.05tr0.2b.d.0.03b.d.反应17
–
6.0gsp
‑
2115cann.m.0.040.10.2b.d.0.02b.d.反应17
‑‑
8.0gsp
‑
2115cann.m.0.040.30.3b.d.trb.d.反应18
‑
20
‑‑
chl26canb.d.0.050.82.0tr0.12b.d反应18
‑
20
–
2.0gtrisyl
®
300cann.m.0.05b.d.0.4b.d.b.d.b.d.反应18
‑
20
–
2.0gclariant126ffcann.m.0.060.20.9b.d.0.04b.d.反应18
‑
20
–
2.0gsp
‑
2115(第2批次)cann.m.0.050.80.9b.d.b.d.b.d.反应18
‑
20
–
2.0gsp
‑
2115(第1批次)cann.m.0.050.70.6b.d.0.05b.d.
b.d.
ꢀ‑‑ꢀ
低于检测tr
ꢀ‑ꢀ
痕量n.m.
ꢀ‑ꢀ
未测量精炼一次的意指洗涤且干燥的can
ꢀ‑ꢀ
卡诺拉
油样品(~1克)在100 ml容量瓶中用chcl3(氯仿)进行稀释,并且使用uv
‑
vis方法测量叶绿素含量,观察在670 nm处的峰值吸光度。还使用hplc方法进行测量。结果在表26中阐述。
[0317]
表26:在用chl26处理或者用chl26和sp
‑
2115、trisyl
®
二氧化硅或漂白粘土处理后,油的叶绿素含量油uv/vishplc
*
(ppb)(ppb)原材料(orco)3273336856反应173078127090
ꢀꢀꢀꢀ
反应17,2gsp
‑
21151652716722
ꢀꢀꢀꢀ
反应17,4gsp
‑
21151449013680
ꢀꢀꢀꢀ
反应17,6gsp
‑
211545245652
ꢀꢀꢀꢀ
反应17,8gsp
‑
211531654812 合并的反应18
‑
203107028840
ꢀꢀꢀꢀ
反应18
‑
20,2gtrisyl3002788125888
ꢀꢀꢀꢀ
反应18
‑
20,2gclariant126ff119756551
ꢀꢀꢀꢀ
反应18
‑
20,2gsp
‑
2115(第2批次)1546213207
ꢀꢀꢀꢀ
反应18
‑
20,2gsp
‑
2115(第1批次)1848715595* = hplc是总叶绿素衍生物的测量表27
‑
28中的结果显示了在如上所述的处理后,反应17或合并的反应18
‑
20油中的叶绿素底物和产物。剩余的水平接近工业过程中所需的叶绿素底物和产物的水平。优化关于脱色酶的反应条件将使得能够消除用于非常绿色的卡诺拉油的漂白土。
[0318]
表27:在用chl26处理或者用chl26和sp
‑
2115、trisyl
®
300或漂白粘土处理后,油中的叶绿素底物和产物组成chyl=叶绿素;pyn=脱镁叶绿素;ppyn=焦脱镁叶绿素;pob=脱镁叶绿酸;ppob=焦脱镁叶绿酸;sub=底物;prod =产物
b.d.=低于检测表28:在用chl26处理或者用chl26和sp
‑
2115、trisyl
®
300或漂白粘土处理后,油中的叶绿素底物和产物组成商业二氧化硅“trisyl
®ꢀ
300具有去除脱色酶反应中生成的产物的有限能力,并且实际上似乎将一些叶绿素产物转换回底物。漂白土具有去除未反应的脱色酶油中发现的叶绿素底物的更大能力,但并不去除脱色酶处理的油的产物以及本公开内容的二氧化硅。
[0319]
实施例11:二氧化硅吸附剂的制备本实施例描述了下文反应21
‑
30中的吸附剂的制备:反应21
ꢀ‑ꢀ
sp
‑
2113的制备使600克trisyl
®
二氧化硅在60℃下干燥,以去除173克水。然后用含有18.6克naoh和81.9克水的氢氧化钠溶液浸渍二氧化硅。将材料在waring搅拌机中共混5分钟。
[0320]
反应22
ꢀ‑ꢀ
sp
‑
2114的制备600克trisyl
®
二氧化硅在waring搅拌机中与12.2 g mgo粉末共混5分钟。
[0321]
反应23
ꢀ‑ꢀ
sp
‑
2115的制备600克trisyl
®
二氧化硅在waring搅拌机中与31.6 g mgo粉末共混5分钟。
[0322]
反应24
ꢀ‑ꢀ
sp
‑
2116的制备使600克trisyl
®ꢀ
300二氧化硅在60℃下干燥,以去除173克水。然后用含有11.4克naoh和92克水的氢氧化钠溶液浸渍二氧化硅。将材料在waring搅拌机中共混5分钟。
[0323]
反应25
ꢀ‑ꢀ
sp
‑
2117的制备使600克trisyl
®ꢀ
300二氧化硅在60℃下干燥,以去除173克水。然后用含有17.8克naoh和92克水的氢氧化钠溶液浸渍二氧化硅。将材料在waring搅拌机中共混5分钟。
[0324]
反应26
ꢀ‑ꢀ
sp
‑
2119的制备600克含有小于10重量%水、707 m2/g的表面积和19微米的中值粒度的二氧化硅干凝胶在waring搅拌机中与30克mgo共混5分钟。
[0325]
反应27
ꢀ‑ꢀ
吸附剂a的制备使4.8克sp
‑
2115在烘箱中在110℃下干燥3小时。
[0326]
反应28
ꢀ‑ꢀ
吸附剂b的制备将5克mgo粉末和20克trisyl
®
二氧化硅共混到容器内,密封,然后通过振荡混合1小时。
[0327]
反应29
ꢀ‑ꢀ
吸附剂c的制备用23.6克di水浸渍24.5克二氧化硅干凝胶,其含有小于10重量%水且具有707 m2/g的表面积和19微米的中值粒度,然后加入含有2.5克mgo粉末的容器中。将内容物密封并通过振荡混合1小时。
[0328]
反应30
ꢀ‑ꢀ
吸附剂d的制备用303克di水浸渍264克二氧化硅干凝胶,其具有4重量%水、330 m2/g的表面积和88至210微米的粒度。将材料分到六个不同的容器内,每个容器含有6克mgo粉末。每个容器通过振荡混合1小时,然后将内容物全部合并到更大的容器内,并且通过振荡共混1小时。
[0329]
实施例12:油的酶促和吸附剂处理。
[0330]
实施例11中制备的吸附剂用于进一步处理先前经受脱色酶处理的两个批次的油(即,如实施例9中所述制备的油11120)。
[0331]
反应31
ꢀ‑ꢀ
用吸附剂a处理脱色酶处理的油将100克酶处理的油11120加热至80℃,然后将0.21克吸附剂a混合到油内。应用100 mbar真空,然后将温度设定为100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0332]
反应32
ꢀ‑ꢀ
用吸附剂b处理脱色酶处理的油将100克酶处理的油11120加热至80℃,然后将0.4克吸附剂b混合到油内。应用100 mbar真空,然后将温度设定为100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0333]
反应33
ꢀ‑ꢀ
用吸附剂c处理脱色酶处理的油将100克酶处理的油11120加热至80℃,然后将0.4克吸附剂c混合到油内。应用100 mbar真空,然后将温度设定为100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0334]
反应34
ꢀ‑ꢀ
用吸附剂d处理脱色酶处理的油将100克酶处理的油11120加热至80℃,然后将0.4克吸附剂d混合到油内。应用100 mbar真空,然后将温度设定为100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈深绿色。
[0335]
反应35
ꢀ‑ꢀ
用trisyl
®
二氧化硅处理脱色酶处理的油将100克酶处理的油11120加热至80℃,然后将0.4克trisyl
®
二氧化硅混合到油内。应用100 mbar真空,然后将温度设定为100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈绿色。
[0336]
反应36
ꢀ‑ꢀ
用trisyl
®ꢀ
300二氧化硅处理脱色酶处理的油将100克酶处理的油11120加热至80℃,然后将0.4克trisyl
®ꢀ
300二氧化硅混合到油内。应用100 mbar真空,然后将温度设定为100℃并混合30分钟。将真空打破并且用布氏漏斗过滤材料。滤盘和滤饼呈黄色。
[0337]
使用aocsuv/vis方法确定来自反应31
‑
36中产生的油的绿色浓度。结果在表29中
阐述。
[0338]
表29:在用各种吸附剂进一步处理后,脱色酶处理的油的绿色。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1