一种氮丙啶类衍生物的合成方法
1.本发明涉及合成方法技术领域,具体涉及一种氮丙啶类衍生物的合成方法。
背景技术:
2.氮丙啶类衍生物在有机精细化工领域如生物医药、农业化学品及以助剂形 式在皮革加工和高分子领域展现出了显著的经济价值。特别指出的是氮丙啶作 为一类合成其他含氮化合物的潜在基础,兼具广泛而多样的生物学活性,这使其 存在于许多具有药理活性的天然产物中并助益于抗生素和抗癌剂的发展。因此, 开发制备这类含氮衍生物有着现实应用基础与实用意义。
3.目前,合成氮丙啶的研究报道仍然较少。基于现有研究基础之上的合成方 法在合成成本、有机小分子的底物可选择性及合成分子结构衍生化方面始终存 在一定局限性。比如,基于昂贵过渡金属催化剂或光敏剂催化的氮杂环丙烷合 成(org.lett.,2013,15,4858),这种基于过渡金属催化剂的传统合成方法体 系复杂且成本高昂,产物范围较窄且生成了有毒副产物。
4.近年来基于电化学有机合成方法开发了一种使用预官能团化胺进行氮丙啶 类衍生物合成的方法。例如,2002年yudin课题组开发了一种没有金属基试剂, 催化剂和化学计量氧化剂的电化学氮丙啶类衍生物合成方法,该方法使用n-氨 基邻苯二甲酰亚胺作为亲电氮源(j.am.chem.soc.2002,124,530);2018年 cheng课题组利用三氟甲基化的氨基磺酸盐进行了类似产物的合成(angew. chem.int.ed.2018,57,5695),对于电化学合成氮丙啶方法来说,底物小分子 试剂的范围仍限于预官能化胺类小分子,即phtnh2或hfsnh2,复杂的氮源导致 了产物的局限性以及反应后产物处理复杂化,通过烯烃和初级胺直接进行电化 学氧化偶联的方法目前鲜有报导。2020年,等运用微流动反应器实现了内 烯和苄胺进行电化学氧化偶联合成氮丙啶类衍生物(chem.2021,7,255),该 方法尽管简便高效但仅限于内烯转化。最近,wickens等使用噻蒽介导的电化学 方法将烯烃转变为介稳态双阳离子物种(双阳离子池策略),然后在碱的作用 下促进胺基和双阳离子的偶联合成氮丙啶类衍生物(nature 2021,596,74),电 化学诱导噻蒽间接催化的方法在烯烃底物范围中只适用于端烯,对于非端烯此 方法尚不可行。针对以上情况,开发经济高效的直接电化学合成手段,对于廉 价易得烯烃与胺类小分子进行氧化偶联合成氮丙啶类衍生物有着重要经济价 值。
技术实现要素:
5.发明要解决的问题
6.本发明所要解决的技术问题是克服现有技术的不足,提供一种氮丙啶类衍 生物的绿色高效合成方法,运用直接电化学合成的方法代替过渡金属催化合成 的传统方法,避免金属有毒物质掺杂,提高了反应的选择性和转化率。
7.用于解决问题的方案
8.为解决以上技术问题,本发明采取的一种技术方案是:
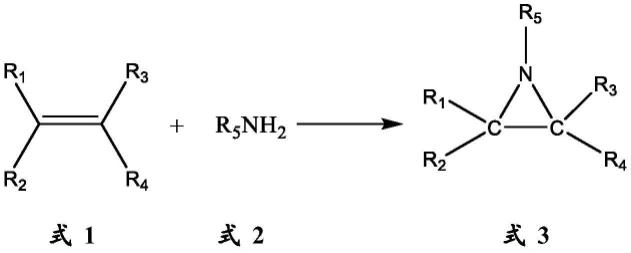
9.一种氮丙啶类衍生物的合成方法,如式3所示的氮丙啶类衍生物,由式1 所示的烯烃与式2所示的胺采用电化学方法合成,
[0010][0011]
其中,基团r
1-r4各自彼此独立为氢,氘,具有1-4个碳原子的烷基,在每 种情形下均可在苯基的邻位和/或间位和/或对位被氘、卤素、具有1-4个碳原子 的烷基或被卤素取代的具有1-4个碳原子的烷基取代的苄基或苯基,基团r1或 r2与基团r3或r4一起可闭合形成5-8元环,
[0012]
其中,基团r5为具有1-6个碳原子的烷基,被含氮、硫杂原子的5-8元杂 环取代的具有1-4个碳原子的烷基,被卤素取代的含氮、硫杂原子的5-8元杂环 取代的具有1-4个碳原子的烷基,在每种情形下均可在苯基的邻位和/或间位和/ 或对位被卤素、甲氧基、或被卤素取代的甲氧基、具有1-4个碳原子的烷基、 或被卤素取代的具有1-4个碳原子的烷基取代的苄基或苯基或苯乙基,
[0013]
所述电化学方法具体为在单一电解池中以恒电流方式由式1和式2进行目 标产物氮丙啶类衍生物式3的合成。
[0014]
式2所示的胺为过量的,式1所示的烯烃与式2所示的胺的比例至少应为 1:1.5。
[0015]
例如当使用1,1-二苯基乙烯与苄胺反应合成1-苄基-2,2-二苯基氮丙啶作为 所述方法的优选实施方案可由如下反应式表示:
[0016][0017]
式1的烯烃中的基团r
1-r4的实例如下:h、d、苯基、3-氟苯基、4-(三氟 甲基)苯基、全氟苯基、4-氯苯基、4-溴苯基、4-碘苯基、甲基、4-叔丁基苯基、 全氘苯基。
[0018]
合适的式1的烯烃的实例是1,1-二苯乙烯、苯乙烯、3-氟苯乙烯、4-(三氟 甲基)苯乙烯、全氟苯乙烯、4-氯苯乙烯、4-溴苯乙烯、4-碘苯乙烯、1-甲基-1-(4
‑ꢀ
氟苯基)乙烯、1,2-二氢萘、4-叔丁基苯乙烯、苯乙烯-d8。
[0019]
当式2的胺选用苄胺时,选用合适的烯烃得到的产物及产率如下所示:
[0020][0021]
式2的胺中的基团r5的实例如下:丁基、4-(三氟甲氧基)苄基、苯丙基、 4-甲基苯乙基、3,4-二氟苄基、4-氯苄基、3-甲氧基苄基、3,5-双(三氟甲基)苄基、 2-氟苯乙基、噻吩-2-乙基、6-氯吡啶-3-甲基、吡啶-3-乙基。
[0022]
合适的式2的胺的实例是1-丁胺、(4-(三氟甲氧基)苯基)甲胺、3-苯基丙-1
‑ꢀ
胺、2-(对甲苯基)乙-1-胺、(3,4-二氟苯基)甲胺、(4-氯苯基)甲胺、(3-甲氧基苯 基)甲胺、(3,5-双(三氟甲基)苯基)甲胺、2-(2-氟苯基)乙-1-胺、2-(噻吩-2-基)乙-1
‑ꢀ
胺、(6-氯吡啶-3-基)甲胺、2-(吡啶-3-基)乙-1-胺。
[0023]
当式1的烯烃选用1,1-二苯基乙烯时,选用合适的胺得到的产物及产率如 下所示:
[0024][0025]
优选地,电解池所用的阳极和阴极均为石墨电极,阳极还可以选用网状玻 璃碳,pt电极,阴极还可以选用铜,镍等金属电极。优选石墨电极是因为石墨 电极具有最好的反应活性及廉价易得的经济性优势。
[0026]
优选地,电解池中的电解质溶剂为有机溶剂、水或其混合物,其中有机溶 剂选用醇类。合适的溶剂例如是甲醇、三氟乙醇、水、三氟乙醇与水的混合物、 甲醇与水的混合物。
[0027]
进一步优选地,电解质溶剂为三氟乙醇和水的混合物。
[0028]
进一步优选地,三氟乙醇与水的体积比为1:10-10:1。合适的比例例如是 1:5-5:1,1:3-5:1,1:2-5:1,2:1-5:1,3:1-5:1,1:5-3:1,1:3-3:1,1:2-3:1,2:1-3:1, 1:5-2:1,1:3-2:1,1:2-2:1,1:3-1:2。
[0029]
进一步优选地,三氟乙醇与水的体积比为1:2。
[0030]
优选地,电解池中的电解质为季铵盐、氯化锂、溴化锂或碘化锂中的一种 或多种。
[0031]
进一步优选地,季铵盐选自四丁基氟化铵、四丁基氯化铵、四丁基溴化铵 或四丁基碘化铵等。
[0032]
进一步优选地,季铵盐选用四丁基碘化铵。
[0033]
进一步优选地,四丁基碘化铵的摩尔用量为式1所示的烯烃的0.1-2.5当量。
[0034]
优选地,电解池中的电解液中含有碱以使电解液处于碱性环境。
[0035]
进一步优选地,碱选自氢氧化钾、碳酸钾或碳酸铯等。
[0036]
进一步优选地,碱选用碳酸铯。
[0037]
进一步优选地,碳酸铯的摩尔用量为式1所示的烯烃的0.1-2.5当量。
[0038]
优选地,合成在恒电流5-30ma下进行。
[0039]
进一步优选地,合成在恒电流18ma下进行。
[0040]
优选地,合成的时间为4-15h。
[0041]
进一步优选地,合成的时间为6h。
[0042]
优选地,在单一电解池中以恒电流方式使1,1-二苯基乙烯与苄胺反应合成 1-苄基-2,2-二苯基氮丙啶。
[0043]
进一步优选地,电解池的阳极和阴极均为石墨电极,电解质为四丁基碘化 铵和氯化锂,电解质溶剂为三氟乙醇和水的混合物,碳酸铯提供碱性环境,合 成在恒电流18ma下反应6h。
[0044]
优选地,三氟乙醇与水的体积比为1:2。
[0045]
优选地,四丁基碘化铵的摩尔用量为1,1-二苯基乙烯的0.1-2.5当量。
[0046]
优选地,碳酸铯的摩尔用量为1,1-二苯基乙烯的0.1-2.5当量。
[0047]
优选地,苄胺为过量的,1,1-二苯基乙烯与苄胺的比例至少应为1:1.5。
[0048]
发明的有益效果
[0049]
由于以上技术方案的采用,本发明与现有技术相比具有如下优点:
[0050]
1、本发明运用直接电化学合成的方法代替过渡金属催化合成的传统方法, 避免金属有毒物质掺杂,提高了反应的选择性和转化率;
[0051]
2、本发明在温和简单的条件下绿色高效的合成了各类复杂结构的氮丙啶衍 生物,避免胺类小分子底物的预官能化,大大拓宽了底物/产物范围,提高了官 能团的兼容性,为氮丙啶类衍生物的合成提供了新的思路和方法;
[0052]
3、本发明的原料廉价易得且产物几乎为全新的氮丙啶骨架结构衍生物,具 有显著的应用潜力。
具体实施方式
[0053]
以下结合具体实施例对本发明做进一步详细说明。应理解,这些实施例仅 用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的 实验方法,通常按照常规实验条件。
[0054]
实施例
[0055]
以如下反应式所示1,1-二苯基乙烯1a与苄胺2a反应转化为目标产物1-苄 基-2,2-二苯基氮丙啶3a为典型实验,探讨不同条件下由烯烃类化合物和苄胺类 化合物合成氮丙啶类衍生物。
[0056][0057]
本发明的典型操作如下:
[0058]
向反应单池中加入1,1-二苯基乙烯1a,苄胺2a,电解液(包含电解质和溶 剂),碱。在双电极存在条件下,恒电流反应一段时间。将反应后的混合液使 用分液漏斗萃取得到有机相溶液(乙酸乙酯溶液),合并有机相并用无水硫酸 钠干燥,减压浓缩得到残余物,经硅胶柱层析分离(洗脱剂为乙酸乙酯和石油 醚),即得到目标产物3a。
[0059]
目标产物3a的数据表征如下:
[0060]
1-苄基-2,2-二苯基氮丙啶(3a)
[0061][0062]1h nmr(400mhz,chloroform-d)δ7.37
–
7.33(m,2h),7.33
–
7.27(m,9h), 7.27
–
7.20(m,3h),7.20
–
7.14(m,1h),3.51(d,j=14.1,1h),3.13(d,j=14.1,1h), 2.37(s,1h),2.19(s,1h).
[0063]
13
c nmr(101mhz,chloroform-d)δ144.7,140.0,137.4,131.5,128.2,128.1, 128.0,127.8,127.2,126.7,126.5,58.4,50.5,42.2.
[0064]
实施例1-4
[0065]
选用不同的溶剂,于12ml的ika反应单池(electrasyn 2.0)中加入1,1
‑ꢀ
二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109μl),四丁基 碘化铵(0.25mmol,93mg),氯化锂(0.1m,25mg),碳酸铯(0.5mmol, 163mg)。在阴极和阳极均为石墨电极的条件下,恒电流18ma反应6小时。 具体反应结果如表1所示:
[0066]
表1实施例1-4选用不同溶剂的反应结果
[0067][0068][0069]
实施例5-10
[0070]
选用不同体积配比的三氟乙醇和超纯水,于12ml的ika反应单池 (electrasyn 2.0)中加入1,1-二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0 mmol,109μl),四丁基碘化铵
(0.25mmol,93mg),氯化锂(0.1m,25mg), 碳酸铯(0.5mmol,163mg)。在阴极和阳极均为石墨电极的条件下,恒电流 18ma反应6小时。具体反应结果如表2所示:
[0071]
表2实施例5-10选用不同体积配比的三氟乙醇和超纯水的反应结果
[0072][0073]
实施例11-14
[0074]
选用不同的季铵盐,于12ml的ika反应单池(electrasyn 2.0)中加入 1,1-二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109μl),氯化 锂(0.1m,25mg),三氟乙醇和超纯水的混合溶液的溶剂(以1:2的体积比 例,三氟乙醇2ml,超纯水4ml),碳酸铯(0.5mmol,163mg)。在阴极 和阳极均为石墨电极的条件下,恒电流18ma反应6小时。具体反应结果如表 3所示:
[0075]
表3实施例11-14选用不同的季铵盐的反应结果
[0076][0077][0078]
实施例15-20
[0079]
选用不同化学剂量的四丁基碘化铵,于12ml的ika反应单池(electrasyn 2.0)中加入1,1-二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109 μl),氯化锂(0.1m,25mg),三氟乙醇和超纯水的混合溶液的溶剂(以1:2 的体积比例,三氟乙醇2ml,超纯水4ml),碳酸铯(0.5mmol,163mg)。 在阴极和阳极均为石墨电极的条件下,恒电流18ma反应6小时。具体反应结 果如表4所示:
[0080]
表4实施例15-20选用不同化学剂量的四丁基碘化铵的反应结果
[0081][0082]
实施例21-23
[0083]
选用不同的碱,于12ml的ika反应单池(electrasyn 2.0)中加入1,1
‑ꢀ
二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109μl),四丁基 碘化铵(0.25mmol,93mg),氯化锂(0.1m,25mg),三氟乙醇和超纯水 的混合溶液的溶剂(以1:2的体积比例,三氟乙醇2ml,超纯水4ml)。在阴 极和阳极均为石墨电极的条件下,恒电流18ma反应6小时。具体反应结果如 表5所示:
[0084]
表5实施例21-23选用不同的碱的反应结果
[0085][0086]
实施例24-27
[0087]
选用不同化学计量的碳酸铯,于12ml的ika反应单池(electrasyn 2.0) 中加入1,1-二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109μl), 四丁基碘化铵(0.25mmol,93mg),氯化锂(0.1m,25mg),三氟乙醇和 超纯水的混合溶液的溶剂(以1:2的体积比例,三氟乙醇2ml,超纯水4ml)。 在阴极和阳极均为石墨电极的条件下,恒电流18ma反应6小时。具体反应结 果如表6所示:
[0088]
表6实施例24-27选用不同化学计量的碳酸铯的反应结果
[0089][0090]
实施例28-34
[0091]
选用在不同恒电流下,于12ml的ika反应单池(electrasyn 2.0)中加 入1,1-二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109μl),四 丁基碘化铵(0.25mmol,93mg),氯化锂(0.1m,25mg),三氟乙醇和超 纯水的混合溶液的溶剂(以1:2的体积比例,三氟乙醇
2ml,超纯水4ml), 碳酸铯(0.5mmol,163mg)。在阴极和阳极均为石墨电极的条件下,反应6 小时。具体反应结果如表7所示:
[0092]
表7实施例28-34选用在不同恒电流下的反应结果
[0093][0094]
实施例35-40
[0095]
选用在不同反应时间下,于12ml的ika反应单池(electrasyn 2.0)中 加入1,1-二苯基乙烯1a(0.5mmol,88μl),苄胺2a(1.0mmol,109μl), 四丁基碘化铵(0.25mmol,93mg),氯化锂(0.1m,25mg),三氟乙醇和 超纯水的混合溶液的溶剂(以1:2的体积比例,三氟乙醇2ml,超纯水4ml), 碳酸铯(0.5mmol,163mg)。在阴极和阳极均为石墨电极的条件下,恒电流 18ma反应6小时。具体反应结果如表8所示:
[0096]
表8实施例35-40选用在不同反应时间下的反应结果
[0097][0098]
反应底物扩展实验:发明人进一步对该催化反应条件下对不同结构底物的 适应性进行了研究。典型操作如下:
[0099]
向12ml的ika反应单池(electrasyn 2.0)中加入0.5mmol的烯烃, 1.0mmol的胺,四丁基碘化铵(0.25mmol,93mg),氯化锂(0.1m,25mg), 三氟乙醇和超纯水的混合溶液的溶剂(以1:2的体积比例,三氟乙醇2ml,超 纯水4ml),碳酸铯(0.5mmol,163mg)。在阴极和阳极均为石墨电极的条 件下,恒电流18ma反应6小时。将反应后的混合液使用分液漏斗萃取得到有 机相溶液(乙酸乙酯溶液),合并有机相并用无水硫酸钠干燥,减压浓缩得到 残余物经硅胶柱层析分离(洗脱剂为乙酸乙酯和石油醚)即得到目标产物。对 应的氮丙啶类衍生物3b-3x的产率如上文所示,结构及数据表征如下所示:
[0100]
1-苄基-2-苯基氮丙啶(3b)
[0101][0102]1h nmr(400mhz,chloroform-d)δ7.41
–
7.33(m,2h),7.33
–
7.29(m,2h), 7.29
–
7.24(m,5h),7.23
–
7.17(m,1h),3.72
–
3.52(m,2h),2.49(dd,j=6.5,3.4hz, 1h),1.97(d,j=3.4hz,1h),1.83(d,j=6.5hz,1h).
[0103]
13
c nmr(101mhz,chloroform-d)δ140.2,139.2,128.4,128.4,127.9,127.0, 126.9,126.3,64.8,41.6,38.0.
[0104]
1-苄基-2-(3-氟苯基)氮丙啶(3c)
[0105][0106]1h nmr(400mhz,chloroform-d)δ7.39
–
7.28(m,4h),7.27
–
7.17(m,2h), 7.04(dt,j=7.7,1.3hz,1h),6.97(ddd,j=10.1,2.7,1.5hz,1h),6.89(tdd,j=8.4, 2.7,1.0hz,1h),3.72
–
3.52(m,2h),2.48(dd,j=6.5,3.3hz,1h),1.94(d,j=3.3hz, 1h),1.85(d,j=6.4hz,1h).
[0107]
13
c nmr(101mhz,chloroform-d)δ163.1(d,j=245.1hz),143.1(d,j=7.6hz), 138.9,129.7(d,j=8.4hz),128.4,127.9,127.1,122.1(d,j=2.8hz),113.8(d,j=21.3hz), 113.0(d,j=22.1hz),64.6,41.0,38.3.
[0108]
19
f nmr(376mhz,chloroform-d)δ-113.55(td,j=9.4hz,5.8).
[0109]
hrms(esi,m/z):calcd for c
15h15
fn[m+h]
+
228.1189,found 228.1190.
[0110]
1-苄基-2-(4-(三氟甲基)苯基)氮丙啶(3d)
[0111][0112]1h nmr(400mhz,chloroform-d)δ7.53(d,j=8.1hz,2h),7.40
–
7.34(m, 4h),7.34
–
7.29(m,2h),7.25(tt,j=7.1hz,1.7,1h),3.78
–
3.49(m,2h),2.54(dd, j=6.5,3.3hz,1h),1.97(d,j=3.2hz,1h),1.91(d,j=6.5hz,1h).
[0113]
13
c nmr(101mhz,chloroform-d)δ144.5,138.8,129.1(q,j=32.3hz),128.4, 127.8,127.2,126.5,125.2(q,j=3.8hz),124.3(d,j=271.8hz),64.6,40.9,38.6.
[0114]
19
f nmr(376mhz,chloroform-d)δ=-62.33.
[0115]
hrms(esi,m/z):calcd for c
16h15
f3n[m+h]
+
278.1157,found 278.1154.
[0116]
1-苄基-2-(全氟苯基)氮丙啶(3e)
[0117][0118]1h nmr(400mhz,chloroform-d)δ7.37
–
7.33(m,4h),7.33
–
7.25(m,1h), 3.95(d,j=13.1hz,1h),3.38(d,j=13.1hz,1h),2.58(dd,j=6.6,3.5hz,1h), 2.41(d,j=3.5hz,1h),1.90(d,j=6.5hz,1h).
[0119]
13
c nmr(101mhz,chloroform-d)δ147.4(m),144.9(m),141.7(m),139.2 (m),137.9,128.5,128.4,127.5,64.8,34.0,31.5.
[0120]
19
f nmr(376mhz,chloroform-d)δ=-142.97
–‑
143.10(m),-155.74,
ꢀ‑
155.79,-155.85,-162.64
–‑
162.82(m).
[0121]
hrms(esi,m/z):calcd for c
15h11
f5n[m+h]
+
300.0812,found 300.0818.
[0122]
1-苄基-2-(4-氯苯基)氮丙啶(3f)
[0123][0124]1h nmr(400mhz,chloroform-d)δ7.37
–
7.32(m,3h),7.32
–
7.28(m,1h), 7.26(d,j=1.3hz,1h),7.25
–
7.21(m,2h),7.18(d,j=8.5hz,2h),3.87
–
3.46(m, 2h),2.46(dd,j=6.5,3.3hz,1h),1.94(d,j=3.3hz,1h),1.85(d,j=6.5hz,1h).
[0125]
13
c nmr(101mhz,chloroform-d)δ138.9,138.8,132.5,128.4,128.4,127.8, 127.6,127.1,64.6,40.8,38.2.
[0126]
1-苄基-2-(4-溴苯基)氮丙啶(3g)
[0127][0128]1h nmr(400mhz,chloroform-d)δ=7.35
–
7.31(m,2h),7.30
–
7.25(m,3h), 7.23(d,j=7.7hz,1h),7.20
–
7.15(m,1h),7.10
–
7.02(m,2h),3.74
–
3.40(m,2h), 2.38(dd,j=6.5,3.3hz,1h),1.83(dd,j=30.2,4.9hz,2h).
[0129]
13
c nmr(101mhz,chloroform-d)δ139.3,138.9,131.4,128.4,128.0,127.8, 127.1,120.6,64.6,40.9,38.2.
[0130]
1-苄基-2-(4-碘苯基)氮丙啶(3h)
[0131][0132]1h nmr(400mhz,chloroform-d)δ7.58(d,j=8.1hz,2h),7.36
–
7.26(m, 4h),7.26
–
7.20(m,1h),7.00(d,j=8.1hz,2h),3.69(d,j=13.7hz,1h),3.53(d, j=13.8hz,1h),2.41(dd,j=6.5,3.3hz,1h),1.91(d,j=3.3hz,1h),1.84(d, j=6.5hz,1h).
[0133]
13
c nmr(101mhz,chloroform-d)δ140.1,138.9,137.3,128.4,128.3,127.8, 127.1,92.1,64.6,40.9,38.3.
[0134]
hrms(esi,m/z):calcd for c
15h15
in[m+h]
+
336.0249,found 336.0257.
[0135]
1-苄基-2-(4-氟苯基)-2-甲基氮丙啶(3i)
[0136][0137]1h nmr(400mhz,chloroform-d)δ7.42(d,j=7.1hz,1h),7.39
–
7.29(m, 2h),7.31
–
7.19(m,4h),7.04
–
6.91(m,2h),3.83(s,1h),3.12(dd,j=205.8,14.0 hz,1h),2.06(d,j=2.4hz,1h),1.77(d,j=98.1hz,1h),1.58(d,j=17.3hz,3h).
[0138]
13
c nmr(101mhz,chloroform-d)δ163.1(d,j=58.6hz),140.2,134.9(d,j=3.4 hz),131.3,128.3,127.8(d,j=20.2hz),126.7,114.9(d,18.8hz),58.7,44.4,42.7,27.3.
[0139]
19
f nmr(376mhz,chloroform-d)δ-114.57
–‑
114.64(m),-116.81(ddd, j=8.8,5.5,3.4hz).
[0140]
hrms(esi,m/z):calcd for c
16h17
nf[m+h]
+
242.1345,found 242.1346.
[0141]
1-苄基-1a,2,3,7b-四氢-1h-萘并[1,2-b]吖啶(3j)
[0142][0143]1h nmr(400mhz,chloroform-d)δ7.37
–
7.26(m,5h),7.25
–
7.19(m,1h), 7.16(dd,j=5.7,2.9hz,2h),7.09
–
7.02(m,1h),3.88(d,j=14.0hz,1h),3.43(d, j=14.1hz,1h),2.98
–
2.82(m,1h),2.51(dd,j=18.1,5.8hz,2h),2.33
–
2.20(m, 2h),1.55(tdd,j=13.6,5.4,2.2hz,1h).
[0144]
13
c nmr(101mhz,chloroform-d)δ139.6,136.3,135.2,128.8,128.6,128.3, 127.5,126.9,126.8,125.9,63.4,42.0,41.2,26.0,21.0.
[0145]
hrms(esi,m/z):calcd for c
17h18
n[m+h]
+
236.1439,found 236.1445.
[0146]
1-苄基-2-(4-(叔丁基)苯基)氮丙啶(3k)
[0147][0148]1h nmr(400mhz,chloroform-d)δ7.37(d,j=7.2hz,2h),7.34
–
7.27(m, 4h),7.25(d,j=6.8hz,1h),7.19(d,j=8.2hz,2h),3.68
–
3.56(m,2h),2.49(dd, j=6.6,3.4hz,1h),1.98(d,j=3.4hz,1h),1.81(d,j=6.5hz,1h),1.30(s,9h).
[0149]
13
c nmr(101mhz,chloroform-d)δ149.8,139.2,137.1,128.4,127.9,126.9, 125.9,125.3,64.9,41.3,37.8,34.5,31.4.
[0150]
hrms(esi,m/z):calcd for c
19h24
n[m+h]
+
266.1909,found 266.1913.
[0151]
1-苄基-2-(苯基-d5)氮丙啶-2,3,3-d3(3l)
[0152][0153]1h nmr(400mhz,chloroform-d)δ=7.39
–
7.35(m,2h),7.33
–
7.28(m,2h), 7.26
–
7.22(m,1h),3.79
–
3.51(m,2h).
[0154]
13
c nmr(101mhz,chloroform-d)δ139.9,139.1,128.4,127.8,126.9,64.7.
[0155]
hrms(esi,m/z):calcd for c
15
h7d8n[m+h]
+
218.1785,found218.1788.
[0156]
1-丁基-2,2-二苯基氮丙啶(3m)
[0157][0158]1h nmr(400mhz,chloroform-d)δ7.32
–
7.04(m,10h),2.34(dt,j=11.7, 7.2hz,1h),2.08(d,j=41.3hz,2h),1.68(dt,j=11.8,7.1hz,1h),1.47(p,j=7.4 hz,2h),1.23(tt,j=13.6,6.2hz,2h),0.77(t,j=7.3hz,3h).
[0159]
13
c nmr(101mhz,chloroform-d)δ144.9,137.7,131.3,128.1,127.9,127.5, 127.3,126.4,54.7,49.8,41.8,32.2,20.6,14.1.
[0160]
hrms(esi,m/z):calcd for c
18h22
n[m+h]
+
252.1752,found 252.1751.
[0161]
2,2-二苯基-1-(4-(三氟甲氧基)苄基)氮丙啶(3n)
[0162]
[0163]1h nmr(400mhz,chloroform-d)δ7.33(dt,j=5.2,3.1hz,6h),7.28
–
7.23 (m,5h),7.19(d,j=7.2hz,1h),7.13(d,j=8.2hz,2h),3.31(dd,j=119.0,14.3 hz,2h),2.28(d,j=72.4hz,2h).
[0164]
13
c nmr(101mhz,chloroform-d)δ148.0(q,j=1.9hz),144.5,138.7,137.1, 131.4,129.1,128.1,128.0,127.9,127.1,126.6,120.7,120.5(q,j=256.6hz),57.5, 50.5,42.2
[0165]
19
f nmr(376mhz,chloroform-d)δ-57.85.
[0166]
hrms(esi,m/z):calcd for c
22h19
nof3[m+h]
+
370.1419,found 370.1425.
[0167]
2,2-二苯基-1-(3-苯基丙基)氮丙啶(3o)
[0168][0169]1h nmr(400mhz,chloroform-d)δ7.28
–
7.22(m,7h),7.20
–
7.14(m,4h), 7.13
–
7.02(m,4h),2.58(q,j=7.5hz,2h),2.34(dq,j=9.2,4.6hz,1h),2.09(d, j=46.2hz,2h),1.80(dq,j=8.0,3.8hz,3h).
[0170]
13
c nmr(101mhz,chloroform-d)δ144.9,142.4,137.6,131.3,128.4,128.3, 128.1,127.9,127.6,127.3,126.4,125.7,54.2,49.9,41.7,33.7,31.7.
[0171]
hrms(esi,m/z):calcd for c
23h24
n[m+h]
+
314.1909,found 314.1906.
[0172]
1-(4-甲基苯乙基)-2,2-二苯基氮丙啶(3p)
[0173][0174]1h nmr(400mhz,chloroform-d)δ7.40
–
7.29(m,6h),7.29
–
7.22(m,3h), 7.22
–
7.15(m,1h),7.02(d,j=7.7hz,2h),6.94(d,j=8.0hz,2h),2.92
–
2.78(m, 2h),2.58(ddd,j=11.7,9.4,6.0hz,1h),2.28(s,3h),2.23
–
2.03(m,3h).
[0175]
13
c nmr(101mhz,chloroform-d)δ=144.8,137.4,137.1,135.4,131.3, 128.9,128.7,128.2,127.9,127.7,127.3,126.4,77.2,56.8,50.0,41.9,36.2,21.0.
[0176]
hrms(esi,m/z):calcd for c
23h24
n[m+h]
+
314.1909,found 314.1926.
[0177]
1-(3,4-二氟苄基)-2,2-二苯基氮丙啶(3q)
[0178][0179]1h nmr(400mhz,chloroform-d)δ7.37
–
7.30(m,5h),7.26(dt,j=8.0,2.5 hz,
4h),7.23
–
7.12(m,2h),7.12
–
7.05(m,0h),7.05
–
7.00(m,1h),6.97(dp, j=8.8,2.7hz,1h),3.27(ddd,j=103.0,14.4,2.9hz,2h),2.28(dd,j=69.4,2.5 hz,2h).
[0180]
13
c nmr(101mhz,chloroform-d)δ150.9(dd,j=94.1,12.7hz),148.5 (dd,j=93.1,12.9hz),144.4,137.1(d,j=10.0hz),137.0,131.4,128.2,128.1, 128.0,127.1,126.6,123.6(dd,j=6.1,3.4hz),116.8,116.7,57.2,50.5,42.1.
[0181]
19
f nmr(376mhz,chloroform-d)δ-138.41(d,j=21.2hz),-141.06(d, j=21.2hz).
[0182]
hrms(esi,m/z):calcd for c
21h18
nf2[m+h]
+
322.1407,found 322.1417.
[0183]
1-(4-氯苄基)-2,2-二苯基氮丙啶(3r)
[0184][0185]1h nmr(400mhz,chloroform-d)δ7.35
–
7.29(m,5h),7.27
–
7.21(m,8h), 7.21
–
7.16(m,1h),3.27(dd,j=101.8,14.2hz,2h),2.35(s,1h),2.17(s,1h).
[0186]
13
c nmr(101mhz,chloroform-d)δ144.6,138.6,137.1,132.4,131.5,129.3, 128.3,128.2,128.1,127.9,127.2,126.6,57.6,50.6,42.1.
[0187]
hrms(esi,m/z):calcd for c
21h19
ncl[m+h]
+
320.1206,found 320.1206.
[0188]
1-(3-甲氧基苄基)-2,2-二苯基氮丙啶(3s)
[0189][0190]1h nmr(400mhz,chloroform-d)δ7.37
–
7.33(m,2h),7.30(td,j=6.6,6.2, 3.6hz,5h),7.24(d,j=7.0hz,1h),7.22
–
7.19(m,1h),7.19
–
7.14(m,2h), 6.96
–
6.92(m,1h),6.86(dt,j=7.6,1.3hz,1h),6.79
–
6.74(m,1h),3.76(s,3h), 3.30(dd,j=135.7,14.2hz,2h),2.37(s,1h),2.19(s,1h).
[0191]
13
c nmr(101mhz,chloroform-d)δ159.6,144.7,141.7,137.3,131.5,129.1, 128.2,128.0,127.8,127.2,126.5,120.3,113.4,112.4,58.3,55.2,50.4,42.2.
[0192]
hrms(esi,m/z):calcd for c
22h22
no[m+h]
+
316.1701,found 316.1699.
[0193]
1-(3,5-双(三氟甲基)苄基)-2,2-二苯基氮丙啶(3t)
[0194]
[0195]1h nmr(400mhz,chloroform-d)δ7.84
–
7.70(m,3h),7.40
–
7.29(m,5h), 7.23(ddd,j=15.2,12.2,7.2hz,5h),3.41(dd,j=87.4,14.6hz,2h),2.41(s,1h), 2.24(s,1h).
[0196]
13
c nmr(101mhz,chloroform-d)δ=143.9,142.6,136.8,132.5,131.4(q,j =33.1hz),130.1,128.3,128.2,128.1,127.1,126.8,123.5(q,j=272.7hz),120.8 (quintet,j=3.8hz),57.4,50.7,41.9.
[0197]
19
f nmr(376mhz,chloroform-d)δ=-62.78.
[0198]
hrms(esi,m/z):calcd for c
23h18
nf6[m+h]
+
422.1343,found 422.1346.
[0199]
1-(2-氟苯乙基)-2,2-二苯基氮丙啶(3u)
[0200][0201]1h nmr(400mhz,chloroform-d)δ7.36
–
7.28(m,7h),7.27
–
7.19(m,2h), 7.19
–
7.15(m,1h),7.15
–
7.04(m,2h),7.04
–
6.89(m,2h),2.98
–
2.87(m,2h),2.63 (ddd,j=11.8,8.8,6.4hz,1h),2.22(s,1h),2.10(s,1h),2.08
–
1.98(m,1h).
[0202]
13
c nmr(101mhz,chloroform-d)δ161.2(d,j=245.0hz),144.8,137.4,131.3, 131.2,128.2,128.0,127.8,127.8(d,j=8.1hz),127.3,127.1(d,j=16.0hz),126.5,123.9(d,j =3.6hz),115.2(d,j=22.0hz),55.1,50.1,42.0,29.8.
[0203]
19
f nmr(376mhz,chloroform-d)δ-118.46
–‑
118.55(m).
[0204]
hrms(esi,m/z):calcd for c
22h21
fn[m+h]
+
318.1658,found 318.1665.
[0205]
2,2-二苯基-1-(2-(噻吩-2-基)乙基)氮丙啶(3v)
[0206][0207]1h nmr(400mhz,chloroform-d)δ7.33(q,j=3.9,2.8hz,7h),7.27
–
7.22 (m,2h),7.20
–
7.13(m,1h),7.07(dd,j=5.1,1.2hz,1h),6.86(dd,j=5.1,3.4hz, 1h),6.72(d,j=3.3hz,1h),3.08(t,j=7.5hz,2h),2.67(dt,j=11.8,7.3hz,1h), 2.24(s,1h),2.15
–
2.03(m,2h).
[0208]
13
c nmr(101mhz,chloroform-d)δ144.6,142.7,137.3,131.2,128.2,128.0, 127.8,127.3,126.6,126.5,124.8,123.4,56.5,50.1,41.9,30.6.
[0209]
2-氯-5-((2,2-二苯基氮丙啶-1-基)甲基)吡啶(3w)
[0210][0211]1h nmr(400mhz,chloroform-d)δ8.18(d,j=2.4hz,1h),7.67(dd,j=8.2, 2.5hz,1h),7.36
–
7.27(m,5h),7.27
–
7.20(m,5h),7.20
–
7.14(m,1h),3.43
–
3.13 (m,2h),2.39(s,1h),2.18(s,1h).
[0212]
13
c nmr(101mhz,chloroform-d)δ149.8,149.2,144.1,138.7,136.7,134.4, 131.4,128.3,128.2,128.1,127.1,126.7,123.8,54.8,50.7,41.9.
[0213]
3-(2-(2,2-二苯基氮丙啶-1-基)乙基)吡啶(3x)
[0214][0215]1h nmr(400mhz,chloroform-d)δ8.46
–
8.30(m,2h),7.41(dt,j=8.0,2.2 hz,1h),7.36
–
7.28(m,7h),7.27
–
7.21(m,2h),7.20
–
7.10(m,2h),2.85(t,j=7.5 hz,2h),2.69
–
2.47(m,1h),2.20(s,1h),2.14
–
2.00(m,2h).
[0216]
13
c nmr(101mhz,chloroform-d)δ150.2,147.5,144.5,137.2,136.4,135.6, 131.2,129.0,128.2,128.0,127.9,127.2,126.6,123.2,56.0,50.0,42.0,33.7.
[0217]
以上对本发明做了详尽的描述,实施例的说明只是用于帮助理解本发明的 方法及其核心思想,其目的在于让熟悉此领域技术的人士能够了解本发明的内 容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所 作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1