基于生物适配体的催化发夹自组装反应检测水环境中3,3′,4,4′-四氯联苯的方法与流程
本发明涉及核酸检测技术领域,是基于生物适配体的催化发夹自组装反应检测水环境中3,3′,4,4′-四氯联苯的方法。
背景技术:
多氯联苯是无色或淡黄色的油性物质。根据氯原子取代的数量和位置,理论上有209个同系物,已确定结构的有109种。因其化学性质,物理特性和毒性与ddt非常相似,且在自然环境中很难降解,存留时间较长,可以通过大气、水的输送而影响到区域和全球环境。又由于多氯联苯对脂肪具有很强的亲和性,因此可通过食物链浓缩造成对人体的潜在危害,产生积累性中毒,严重影响人类健康。随着多氯联苯的逐步消除、减少和控制,多氯联苯仍然存在于电力、塑料加工、化工、印刷等行业,由于其良好的化学惰性、耐热性、不燃性和高介电常数,在自然界中广泛存在。其中,3,3′,4,4′-四氯联苯(pcb77)是一种典型的共面多氯联苯同系物,具有很强的生物毒性,可引起癌症等不良的健康影响,可做为一种水环境中的重点检测目标。
传统的多氯联苯检测方法通常采用气相色谱-质谱联用和高效液相色谱-质谱联用。色谱分析方法具有灵敏度高、精确性好、重复性高等特点,在当前的仪器分析方法中占据了主导的地位。但是,由于该方法需要昂贵的仪器设备和专业技术人员准确操作,分析成本高,分析周期长,因此大范围使用受到限制。同时,由于环境样品中有机污染物的样品也种类多样需要复杂的前处理,对单一有机污染物的实时定量监测十分困难。还有一类基于免疫的pcb77检测方法,如基于免疫聚合酶链反应检测、基于免疫的表面等离子体共振检测、基于免疫的电化学磁传感器检测等。但是,这些方法的特异性较低,且操作比较复杂。因此,有必要进一步提高pcb77检测传感器的灵敏度和方便性。
中国文献《多氯联苯特异性分子探针筛选和基于适配体的纳米生物传感器研究》(徐升敏,中国科学院大学,博士论文,2012年11月),该论文涉及了基于适配体的金纳米颗粒检测pcb77的研究,公开了通过筛选得到的识别pcb77的dna适配体,结合金纳米颗粒,设计了两种纳米生物探针,基于荧光的恢复法制备的分子探针,再痕量检测pcb77方面有很好的灵敏度,最低检测限为0.5μg/l,该文献公开了识别pcb77的dna适配体,但是并未涉及利用催化发夹自组装反应检测方法用于检测pcb77。
中国文献《dna发夹结构自组装信号放大在产呕吐毒素蜡样芽孢杆菌检测中应用的研究》(俞蓓,南昌大学,硕士论文,2018年5月26日)公开了催化发夹型dna自组装反应(catalyzedhairpinassembly,cha),本文公开dna发夹结构自组装反应,是利用检测底物在蜡样芽孢杆菌中对应的基因序列,设计目标引物,在dna发夹结构自组装反应过程中只是同过目标引物激活探针信号反应,并未涉及引物与检测底物的结合问题;虽然该文献中给出利用dna发夹结构自组装信号放大的方法可以检测多种物质的其它参考文献,通过对比相关文献可以看出,虽然最后都是激活探针信号,但在激活探针信号之前涉及检测底物的关键反应各不相同,有的是直接利用目标引物激活探针信号,在激活探针的反应体系中不含检测底物,有的是利用与底物结合后的适配体激活探针信号等等,在激活探针信号之前的反应检测底物不同,反应原理也各不相同,不同检测底物的反应都有各自的特异性;进一步的由于前期的反应原理不同,相对应的发夹探针也各不相同,并且该文献明确说明了在基于dna发夹结构自组装信号放大策略的生物分子检测中,仍存在一些问题亟待解决,包括如下问题:dna发夹结构自组装信号放大效率与发夹探针的设计有关,目前针对探针对发夹探针设计的具体操作鲜有报道;单独使用dna发夹结构自组装信号放大策略实现高灵敏度检测的并不多。
基于生物适配体的催化发夹自组装反应检测水环境中3,3′,4,4′-四氯联苯的方法在现有技术中没有相关报道。
技术实现要素:
针对现有技术的不足,本发明提供了基于生物适配体的催化发夹自组装反应检测水环境中3,3′,4,4′-四氯联苯的方法,并且设计了几种小分子生物检测探针用于检测水环境中存在的pcb77。
在pcb77检测的特异性识别元件中,抗体是快速检测pcb77的关键识别元件之一。然而,制备过程耗时,小分子化学品的识别是有限的。适配体具有高度灵活的三维结构,对环境中小分子类物质具有良好的选择性、高敏感性和高亲和力,是理想的抗体替代品。催化发夹自组装反应是一种等温循环扩增反应,不产生聚合产物,但产生稳定的dna双链结构,仅通过杂化和顶端链取代反应实现扩增,从而放大化学信号,提高检测灵敏度。本发明在适配体双链进行设计,结合催化发夹自组装反应设计体系,其检测范围广,特异性识别好。并且,这种检测方法可以设计为一种便携式生物传感检测器,使其可应用于真实水环境中pcb77监测,缩短检测时间,简化实际操作。
基于生物适配体的无酶催化发夹自组装反应体系原理:在整个体系中,适配体不仅是识别目标的关键,也是无酶催化发夹自组装反应的起始单元。如图1所示,在pcb77的存在的条件下,适配体与pcb77结合形成一个稳定的结构,并释放引物链,无酶催化发夹自组装反应被激活,引物链与发夹探针h1杂交产生双链结构,打开的发夹探针h1上的单链部分作为一个立足点,启动链置换反应,打开发夹探针h2,产生荧光信号;引物链从发夹探针h1与h2上掉落,循环反应,使荧光信号扩大;引物是结合pcb77适配体并催化发夹自组装反应的关键点,因此设计选择一条合适的引物链至关重要。
本发明的技术方案
基于生物适配体的催化发夹自组装反应检测水环境中pcb77的方法,包括以下几个步骤:
(1)识别探针合成:将pcb77的适配体与引物按照摩尔比1:1的比例加入到1×tbe缓冲液中,混合均匀;将混合液加热至80~95℃,恒温3~5min;然后将混合液缓慢冷却至室温,室温冷却时间为30~60min;
所述步骤(1)中pcb77的适配体序列为:
5′-ggcggggctacgaagtagtgattttttccgatggcccgtggtgccc-3′seqidno.1;
所述步骤(1)的引物序列为:
5′-acgggccatcggaaaaaatcacta-3′seqidno.2;
所述步骤(1)的目的是形成稳定的识别探针。
(2)发夹探针合成:将发夹探针h1与发夹探针h2各自加入到1×tbe缓冲液中,混合均匀,将各自的混合溶液加热至80~95℃,恒温3~5min,然后置于冰上,反应时间为3~5min,最后置于室温,反应时间为30~60min;
所述步骤(2)中的发夹探针h1序列为:
5′-cacgagactgttcacatcggaaaaaatcactaagatgtgtacctagtgattttttccgatggcccgt-3′seqidno.3;
所述步骤(2)中的发夹探针h2序列为:
5′-/cy-5/agatgtgtacctcggaaaaaatcactaggtacacatc/bhq-2/ttagtgatt-3′seqidno.4;
所述步骤(2)的目的是将发夹探针h1和发夹探针h2形成稳定的发夹结构。
(3)荧光测定水样中pcb77含量,包括如下步骤:
①将步骤(1)中的识别探针和步骤(2)中的发夹探针h1与发夹探针h2按照摩尔比1:(1~1.5):(1~1.5)的比例混和均匀制得混合液;
②向步骤①制得的混合液中加入pcb77标准溶液,再用结合缓冲液定容,制备成不同浓度的检测液i,以与检测液i平行的,不含pcb77的空白液作为对照液,然后,将检测液i和对照液加热至30~60℃,反应时间为1~2h;反应完成后,用荧光仪测定检测液i和对照液的荧光强度,获得荧光数据,绘制标准曲线;
所述荧光数据是于激发波长635nm、发射波长660nm下测得的;
所述结合缓冲液包括如下组分:nacl的质量浓度为100~150mm,tris-hcl的质量浓度为10~20mm,mgcl2的质量浓度为1~5mm,kcl的质量浓度为1~5mm,cacl2的质量浓度为1~2mm,余量为双蒸水;
③实际水样中pcb77含量的检测:按照步骤②的步骤进行检测,向步骤①制得的混合液中加入实际水样或者实际水样的稀释液制得检测液ii,代替pcb77标准溶液,获得荧光数据,并根据步骤②制备的标准曲线,计算出实际水样中pcb77的质量浓度;
根据本发明优选的,步骤(1)中的加热温度为80℃,恒温时间为3min,室温冷却时间为30min。
根据本发明优选的,步骤(2)中的加热温度为80℃,恒温时间为3min,置于冰上,反应时间为3min,最后置于室温,反应时间为3min。
根据本发明优选的,步骤①中识别探针和发夹探针h1与发夹探针h2按照摩尔比1:1:1的比例混合。
根据发明优选的,步骤②中结合缓冲液包括如下组分:nacl的质量浓度为100mm,tris-hcl的质量浓度为10mm,mgcl2的质量浓度为1mm,kcl的质量浓度为1mm,cacl2的质量浓度为1mm,余量为双蒸水。
根据本发明优选的,步骤步骤②中反应温度为30℃,反应时间为1h。
根据本发明优选的,步骤②向步骤①制得的混合液中加入pcb77标准溶液,再用结合缓冲液定容,制备成不同浓度的检测液i,以与检测液i平行的,不含pcb77的空白液作为对照液,然后,将检测液i和对照液加热至30~60℃,反应时间为1~2h;反应完成后,用荧光仪测定检测液i和对照液的荧光强度,获得荧光数据,绘制标准曲线;
进一步优选的,步骤②检测液i中pcb77的质量浓度为0.1~100μg/l;
更优选的,步骤②检测液i中pcb77的质量浓度为0.1~20μg/l。
根据本发明优选的,步骤③检测液ii中pcb77的质量浓度为0.1~100μg/l。
根据本发明优选的所述步骤③中检测结果的准确性,采用标准加入法进行验证。
所述发夹探针h1为没有荧光基团与猝灭基团修饰的探针,而发夹探针h2为修饰了荧光基团cy-5与猝灭基团bhq-2的探针。
所述适配体序列、引物序列、发夹探针h1序列以及发夹探针h2序列由宝生物工程(大连)有限公司代理合成。
本发明的有益效果
1、本发明提供了基于生物适配体的催化发夹自组装反应检测水环境中pcb77的方法,通过添加目标检测物并产生荧光信号,测定水体中pcb77的含量,相较于传统的大型仪器检测方法,本发明涉及的检测方法更加简便且易于操作。
2、在实际水体样本测定中,本发明在测定过程中可省略色谱法检测目标物所需的复杂前处理过程,本发明中涉及到的荧光检测仪器使检测时间大大缩短,提高检测的灵敏度,本发明提供的检测方法,最低检测限为0.1μg/l,且测定结果准确有效。
3、本发明提供了能有效结合pcb77适配体并催化dna发夹自组装反应的引物;并设计了发夹探针h1和h2利用dna发夹结构自组装信号放大,有效检测水环境中pcb77的质量浓度。
附图说明
图1、为本发明所述方法的原理图
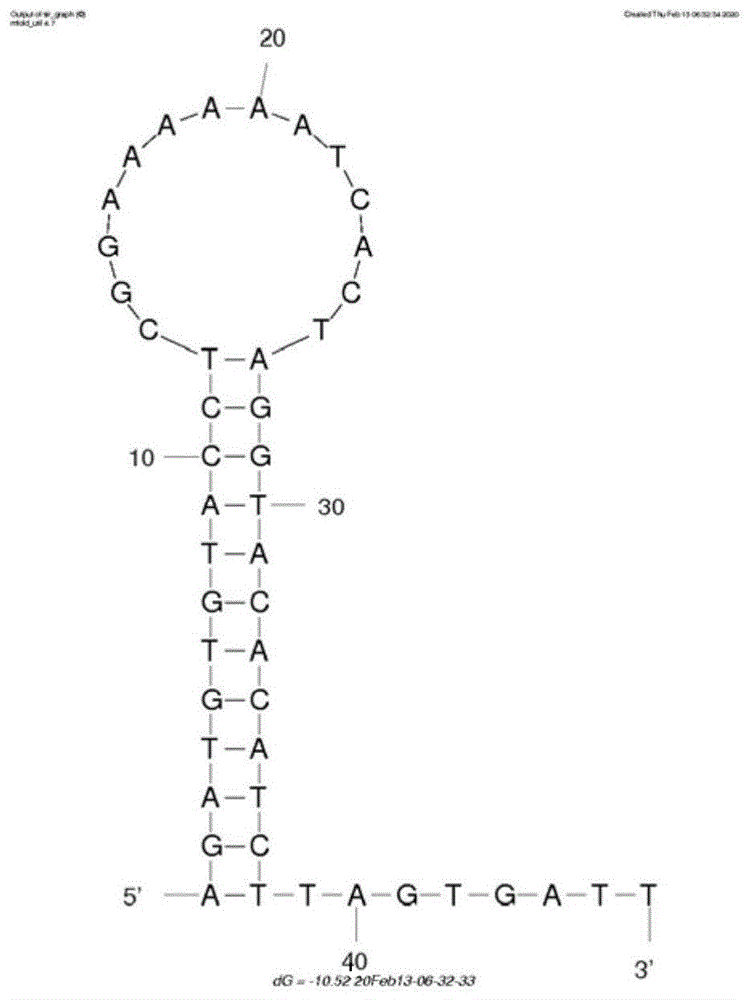
图2、pcb77的适配体预测结构图
图3、发夹探针h1的预测结构图
图4、发夹探针h2的预测结构图
图5、实验例2pcb77定量检测曲线图
图6、实施例1的定量标准曲线图
图7、实施例2的定量标准曲线图
图8、实施例3的定量标准曲线图
具体实施方式
为了更好的理解本发明,下面结合实施例进一步阐述本发明的内容,但本发明涉及的保护范围不限于此。
实验例1
本发明根据适配体的碱基序列设计出如表1所示的引物链序列,并利用primer6软件计算引物链与适配体连之间的δg;选择表1中下划线标记的引物序列作为目标引物,并设计了发夹探针h1和发夹探针h2。
本发明涉及的pcb77的适配体、引物、发夹探针h1和发夹探针h2的序列由宝生物工程(大连)有限公司代理合成,见表2;pcb77的适配体预测结构图见图2;发夹探针h1的预测结构图见图3;发夹探针h2的预测结构图见图4。
表1
表2
由于适配体链形成的茎环与pcb77结合的稳定性直接影响检测pcb77的准确性,本发明选择的引物序列是与pcb77适配体中形成茎环结构序列相对应的序列,选择的引物序列即要与适配体稳定结合又要在检测底物pcb77存在时,能够与适配体分离,使适配体可以与pcb77稳定结合,释放的引物序列还要激活发夹自组装反应,所以并未选择理论上引物链与模板链之间δg的绝对值越大越结合越稳定的引物序列作为目标序列,因此本发明中的目标引物是结合pcb77适配体并催化发夹自组装反应的关键点,因此设计选择一条合适的引物链至关重要。
上述目标引物序列在pcb77适配体链上释放后,能够激活无酶催化发夹自组装反应,引物链与本发明设计的发夹探针h1杂交产生双链结构,打开的发夹探针h1上的单链部分作为一个立足点,启动链置换反应,打开本发明设计的发夹探针h2,产生荧光信号;引物链从发夹探针h1与h2上掉落,循环反应,使荧光信号扩大;用于检测水体中pcb77质量浓度。
本发明提供的检测方法检测结果准确性采用标准加入法进行验证。
实验例2
基于生物适配体的催化发夹自组装反应对pcb77进行定量检测,包括以下步骤:
(1)识别探针合成:将pcb77的适配体与引物按照摩尔比1:1的比例,分别加入1μl,质量浓度为100μm至同一离心管中,加入98μl1×tbe缓冲液,混合均匀;将离心管加热至80℃,恒温时间为3min,然后,将混合液缓慢冷却至室温形成稳定的识别探针,室温冷却时间为30min。
(2)发夹探针合成:将1μl100μm发夹探针h1与1μl100μm的发夹探针h2自加入离心管中,再各自加入1×tbe缓冲液定容至100μl,加热至80℃,恒温时间为3min,然后置于冰上,反应时间为3min,最后置于室温形成稳定的发夹结构,反应时间为30min。
(3)荧光测定标准液中pcb77含量,包括如下步骤:
①将步骤(1)中的识别探针和步骤(2)中的发夹探针h1与发夹探针h2分别加入5μl至同一离心管中制得混合液,制备多个平行的混合液离心管备用;
②向步骤①制得的混合液中加入pcb77标准溶液,加入结合缓冲液定容至50μl,混合均匀,制成平行的、pcb77的最终质量浓度分别为0,2,4,8,12,16,20,50,100,200,300,500μg/l的检测液,上述pcb77质量浓度为0μg/l的检测液作为对照液,然后,将上述检测液离心管置于普通pcr仪上,反应温度为30℃,反应时间为1h;反应完成后,用荧光仪测定混合液的荧光强度,获得荧光数据,荧光数据是于激发波长635nm、发射波长660nm下测得的;绘制pcb77定量检测曲线图,见图5;
所述结合缓冲液包括如下组分:nacl的质量浓度为100mm,tris-hcl的质量浓度为10mm,mgcl2的质量浓度为1mm,kcl的质量浓度为1mm,cacl2的质量浓度为1mm,余量为双蒸水。
由图5可以看出本发明提供的检测方法,荧光最低检测限为0.1μg/l,检测液中pcb77的质量浓度超过100μg/l,随着pcb77的质量浓度增加,荧光数值变化减小,灵敏度降低,所以检测液中pcb77的含量不易过高,影响检测结果的准确性。
实施例1
基于生物适配体的催化发夹自组装反应检测水环境中pcb77的方法,包括以下步骤:
(1)识别探针合成:将pcb77的适配体与引物按照摩尔比1:1的比例,分别加入1μl,质量浓度为100μm至同一离心管中,加入98μl1×tbe缓冲液,混合均匀;将离心管加热至80℃,恒温时间为3min,然后,将混合液缓慢冷却至室温形成稳定的识别探针,室温冷却时间为30min。
(2)发夹探针合成:将1μl100μm发夹探针h1与1μl100μm的发夹探针h2自加入离心管中,再各自加入1×tbe缓冲液定容至100μl,加热至80℃,恒温时间为3min,然后置于冰上,反应时间为3min,最后置于室温形成稳定的发夹结构,反应时间为30min。
(3)荧光测定水体样本1中pcb77含量,包括如下步骤:
①将步骤(1)中的识别探针和步骤(2)中的发夹探针h1与发夹探针h2分别加入5μl至同一离心管中制得混合液,制备多个平行的混合液离心管备用;
②向步骤①制得的混合液中加入pcb77标准溶液,加入结合缓冲液定容至50μl,混合均匀,制成平行的、pcb77的最终质量浓度分别为0,2,4,8,12,16,20μg/l的检测液,上述pcb77质量浓度为0的空白液作为对照液,然后,将上述检测液和对照液离心管置于普通pcr仪上,反应温度为30℃,反应时间为1h;反应完成后,用荧光仪测定混合液的荧光强度,获得荧光数据,荧光数据是于激发波长635nm、发射波长660nm下测得的;绘制出标准曲线y=3.7041x+179.49,见图6;
所述结合缓冲液包括如下组分:nacl的质量浓度为100mm,tris-hcl的质量浓度为10mm,mgcl2的质量浓度为1mm,kcl的质量浓度为1mm,cacl2的质量浓度为1mm,余量为双蒸水;
③水体样本1中pcb77含量的检测:按照步骤②的步骤进行检测,向步骤①制得的混合液中加入水体样本1,代替pcb77标准溶液,获得荧光数据,并根据步骤②制备的标准曲线,计算出水体样本1中pcb77的质量浓度。
实施例2
基于生物适配体的催化发夹自组装反应检测水环境中pcb77的方法,包括以下步骤:
(1)识别探针合成:将pcb77的适配体与引物按照摩尔比1:1比例,分别加入1μl100μm到同一离心管中,加入98μl1×tbe缓冲液,混合均匀;将离心管加热至90℃,恒温时间为4min,然后,将混合液缓慢冷却至室温形成稳定的识别探针,室温冷却时间为45min。
(2)发夹探针合成:将1μl100μm发夹探针h1与1μl100μm发夹探针h2各自加入离心管中,再各自加入1×tbe缓冲液定容至100μl,加热至95℃,恒温时间为5min,然后置于冰上,反应时间为4min,最后置于室温形成稳定的发夹结构,反应时间为60min。
(3)荧光测定水体样本2中pcb77含量,包括如下步骤:
①将步骤(1)中的识别探针和步骤(2)中的发夹探针h1与发夹探针h2,分别加入5、6.25、6.25μl至同一离心管中至同一离心管中制得混合液,制备多个平行的混合液离心管备用;
②向步骤①制得的混合液中加入pcb77标准溶液,加入结合缓冲液定容至50μl,混合均匀,制成平行的、pcb77的最终质量浓度分别为0,2,4,8,12,16,20μg/l的检测液,上述pcb77质量浓度为0μg/l的空白液作为对照液,然后,将上述检测液和对照液离心管置于普通pcr仪上,反应温度为45℃,反应时间为1.5h,反应完成后,用荧光仪测定混合液的荧光强度,获得荧光数据,荧光数据是于激发波长635nm、发射波长660nm下测得的,绘制标准曲线y=3.9362x+177.15,见图7。
所述结合缓冲液包括如下组分:nacl的质量浓度为100mm,tris-hcl的质量浓度为15mm,mgcl2的质量浓度为4mm,kcl的质量浓度为5mm,cacl2的质量浓度为1.5mm,余量为双蒸水;
③水体样本2中pcb77含量的检测:按照步骤②的步骤进行检测,向步骤①制得的混合液中加入水体样本2,代替pcb77标准溶液,获得荧光数据,并根据步骤②制备的标准曲线,计算出水体样本2中pcb77的质量浓度。
实施例3
基于生物适配体的催化发夹自组装反应检测水环境中pcb77的方法,包括以下几个步骤:
(1)识别探针合成:将pcb77的适配体与引物按照摩尔比1:1比例,分别加入1μl100μm到同一离心管中,加入98μl1×tbe缓冲液,混合均匀;将离心管加热至95℃,恒温时间为5min,然后,将混合液缓慢冷却至室温形成稳定的识别探针,室温冷却时间为60min。
(2)发夹探针合成:将1μl100μm发夹探针h1与1μl100μm发夹探针h2各自加入离心管中,再加入1×tbe缓冲液定容至100μl,加热至95℃,恒温时间为5min,然后置于冰上,反应时间为5min,最后置于室温形成稳定的发夹结构,反应时间为60min。
(3)荧光测定水体样本3中pcb77含量,包括如下步骤:
①将步骤(1)中的识别探针和步骤(2)中的发夹探针h1与发夹探针h2,分别加入5、7.5、7.5μl至同一离心管中制得混合液,制备多个平行的混合液离心管备用;
②向步骤①制得的混合液中加入pcb77标准溶液,加入结合缓冲液定容至50μl,混合均匀,制成平行的、pcb77的最终质量浓度分别为0,2,4,8,12,16,20μg/l的检测液,上述pcb77质量浓度为0μg/l的空白液作为对照液,然后,将上述检测液和对照液离心管置于普通pcr仪上,反应温度为60℃,反应时间为2h;反应完成后,用荧光仪测定混合液的荧光强度,荧光数据是于激发波长635nm、发射波长660nm下测得的获得荧光数据,绘制出标准曲线y=3.6103x+182.89见图8。
所述结合缓冲液包括如下组分:nacl的质量浓度为150mm,tris-hcl的质量浓度为20mm,mgcl2的质量浓度为5mm,kcl的质量浓度为5mm,cacl2的质量浓度为2mm,余量为双蒸水;
③水体样本3中pcb77含量的检测:按照步骤②的步骤进行检测,向步骤①制得的混合液中加入水体样本3,代替pcb77标准溶液,获得荧光数据,并根据步骤②制备的标准曲线,计算出水体样本3中pcb77的质量浓度。
效果例
实施例1-3实际水体样本检测结果以及采用标准加入法测定的回收率见表3。
所述采用标准加入法进行验证的原理:测定标准液加入前后样品的浓度,若加入标准溶液后的浓度将比加入前的高,其增加的量应等于加入的标准溶液中所含的待测物质的量;如果样品中存在干扰物质,则浓度的增加值将小于或大于理论值。
采用标准加入法测定实施例1-3实际水体样本检测结果:将10μl的水体样本与10μl16μg/l的pcb77标准溶液混合后进行测定,获得荧光数据,计算回收率。利用回收率验证反应的准确性。
回收率=(检测水样与标准溶液混合后的pcb77浓度-检测水样中pcb77浓度)/在水样中添加pcb77标准品后的终浓度。
表3
由表2中的回收率可以看出本发明涉及的检测方法对水体中pcb77含量的检测效果准确,灵敏度高。
- 还没有人留言评论。精彩留言会获得点赞!