微流控糖类代谢分析检测装置及方法与流程
本申请涉及生物传感器领域,尤其涉及微流控糖类代谢分析检测装置及方法。
背景技术:
味觉是食物在人的口腔内对味觉器官化学感受系统进行刺激而产生的一种感觉,包括甜、酸、苦、咸四种基本味觉。人们平常尝到的各种味道,都是这四种味觉混合的结果。味觉的感受器是舌头上的味蕾,味蕾呈卵圆形,主要由味觉细胞和支持细胞组成,味觉细胞顶部有微绒毛向味孔方向伸展,与唾液接触,细胞基部有神经纤维支配。食物中的化学物质溶解在唾液中,通过味孔与味觉感受器细胞接触,在那里它们与味觉感受器或离子通道相互作用。这些相互作用触发细胞内的信号级联,诱导细胞的动作电位,电信号最终通过神经纤维传递到大脑,形成味觉。味觉细胞表面有许多味觉感受分子,不同物质能与不同的味觉感受分子结合而呈现不同的味道。人的味觉从受食物刺激到感受到滋味仅需1.5-4.0ms,比视觉13-45ms,听觉1.27-21.5ms,触觉2.4-8.9ms都快。一直以来,味觉的分析主要采用人工味觉分析法来判断,具有较大的主观性,难以精准分析评价食品带来的味觉。因此,通过味觉传感器能够实现现场、快速、实时检测,对于食品领域具有重要的意义。尤其需要在进食导致的流动状态下实现动态检测更为必要。
糖是一种重要的调味品,根据所含热量分为高热量甜味剂和低热甜味剂。高热量甜味剂包括蔗糖、蜂蜜等天然甜味剂,所含热量高,长期超量食用容易引起肥胖甚至糖尿病。低热甜味剂是指具有甜味、产生热能低且其营养价值低的物质,常用于控制血糖升高,避免肥胖,控制体重和预防心血管疾病的发生,还用作糖尿病患者食糖代用品。人类和其他哺乳动物的口腔中乳酸菌与食物中的微量糖发酵反应产生有机酸,包括乳酸、乙酸(乙醇)等产物,赋予不同糖类特定的口味。通过生物传感器准确分析乳酸菌对不同糖类的代谢特性,对于食品领域制备低热量且口味趋近蔗糖的甜味剂具有重大意义。
技术实现要素:
本发明的目的是针对现有技术存在的缺点,提出一种微流控糖类代谢分析检测装置及方法,解决现有技术中存在的常规味觉分析检测主观性强、检测物静止带来的准确性差等问题。
本发明提供一种微流控糖类代谢分析检测装置,包括:微流控传感器单元、微量注射泵、废液池、信号电路、激励光源、光源调制电路和控制器;微流控传感器单元的进液通道与微量注射泵连通,微流控传感器单元的出液通道与废液池连通;信号电路与微流控传感器单元连接,对微流控传感器单元施加偏置电压和从微流控传感器单元采集检测信号,信号电路与光源调制电路连接,发送调制控制信号;激励光源朝向微流控传感器单元设置,与光源调制电路连接,向微流控传感器单元发射用于产生光电流的激励光;光源调制电路连接激励光源,根据调制控制信号调制激励光源发射激励光;控制器与信号电路通信连接,进行检测控制、记录并处理采集数据。
优选的,微流控传感器单元包括基板、光寻址电位传感器、微孔膜、进液管、出液管和工作电极;光寻址电位传感器的导电层与工作电极连接,光寻址电位传感器和工作电极设置在基板上;微孔膜设置在光寻址电位传感器上,具有纺垂形微流槽;进液管和出液管设置在微流槽的两端并插入微孔膜。
优选的,进液管和出液管由金属管和聚乙烯微孔管组成,金属管插入微孔膜,聚乙烯微孔管套设在金属管上。金属管用不锈钢、银或铂金制成。进液管的金属管或出水管的金属管用作参考电极。
优选的,光寻址电位传感器从背面到正面由铝层、硅片基底、绝缘体层和保护层顺序构成;铝层连接工作电极,保护层位于微孔膜下方,微流槽露出的保护层朝向激励光源设置。
优选的,信号电路包括微控制器和laps检测电路;laps检测电路包括i/v变换电路、调零及放大电路、低通滤波电路、阻抗检测电路和时钟电路;光寻址电位传感器的光电流信号通过i/v变换电路转换成电压信号;电压信号通过调零及放大电路去除误差且同相放大,再通过低通滤波电路滤除低频噪声,发送给微控制器;阻抗电路向光源调制电路提供高频交流激励源进行阻抗检测,驱动激励光源;时钟电路通过微处理器控制为阻抗电路提供时钟信号。
优选的,在进液通道上设置气泡消除单元,泡消除单元与真空泵连通。气泡消除单元包括上基板、下基板、负压腔、流体腔、真空泵连接口、微流入口、微流出口、真空泵连接管和流体导管;负压腔和流体腔相连通,负压腔和流体腔位于上基板和下基板之间,负压腔邻近上基板,流体腔临近下基板;真空泵连接口位于上基板上,与负压腔连通;微流入口和所属微流出口位于下基板上,与流体腔连通。
糖类代谢分析检测的方法,包括:对微流控传感器单元进行校准,确定偏置电压范围;培养乳酸菌并接种到微流控传感器单元中;向微流控传感器单元输送糖溶液,施加偏置电压和调制激励光;实时记录检测信号,并根据检测信号描绘该糖溶液的乳酸菌代谢曲线。
优选的,偏置电压的范围为-1.5v至-1.0v;乳酸菌的密度为0.5-3×107cfu/ml;糖溶液的输送速度为300-600ml/h;检测温度为35℃-40℃。
优选的,糖溶液包括75mmol/l蔗糖溶液,以及含有三氯蔗糖、赤藓糖醇和麦芽糖醇且甜度与75mmol/l蔗糖溶液一致的混合溶液两种糖溶液。
优选的,糖溶液包括75mmol/l蔗糖溶液,以及含有三氯蔗糖、赤藓糖醇、麦芽糖醇和维生素c的、甜度与75mmol/l蔗糖溶液一致的且酸度为ph3.0-4.0的混合溶液两种糖溶液。
与现有技术相比,本发明实施例的有益效果是:本发明通过将光寻址电位传感器和微流控技术有机结合得到的微流控传感器单元,实现对糖类乳酸菌代谢进行动态定量分析检测;通过采用在进液通道上设置气泡消除单元,泡消除单元与真空泵连通,有效排除检测溶液中的气泡,提高检测精度;基于本发明的分析检测装置,进行糖类代谢检测,精确掌握不同糖类的乳酸菌代谢特性,并在此基础上进行糖类口味模拟检测,准确获得代谢口味与蔗糖接近的复合甜味剂的酸度范围。
附图说明
通过下面结合附图对其示例性实施例进行的描述,本发明上述特征和优点将会变得更加清楚和容易理解。
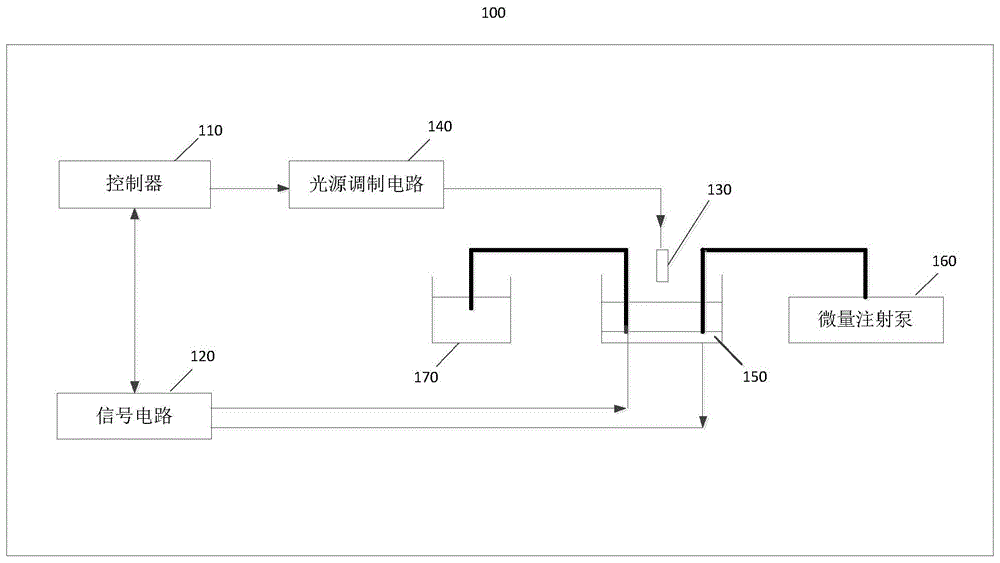
图1是本发明一实施例的微流控糖类代谢分析检测装置的结构示意图。
图2是本发明一实施例的微流控传感器单元的结构示意图。
图3是本发明一实施例的光寻址电位传感器的结构示意图。
图4是本发明一实施例的信号电路的电路结构图。
图5是本发明另一实施例的微流控糖类代谢分析检测装置的机构示意图。
图6是本发明一实施例的气泡消除单元结构示意图。
图7是本发明的微流控糖类乳代谢分析检测方法的流程图。
具体实施方式
下面结合附图对本发明作进一步详细说明,以便于本领域技术人员准确理解本发明。
实施例1
如图1所示,本实施例提供的微流控糖类代谢分析检测装置100,包括:控制器110、信号电路120、激励光源130、光源调制电路140、微流控传感器单元150、微量注射泵160和废液池170。微流控传感器单元150的进液通道与微量注射泵160连接,微流控传感器单元150的出液通道与废液池170连接,微流控传感器单元150与信号电路120连接,实现对微流控传感器单元150施加偏压和信号采集。激励光源130设置于微流控传感器单元150的上方,与光源调制电路140相连,使微流控传感器单元150受到光激励产生光生电流。光源调制电路140与信号电路120连接,受信号电路120控制。信号电路120通过串口与控制器110相连,完成相关控制、数据传输和处理的功能。
微量注射泵160可通过异步接收/发送协议(uart)控制检测溶液的注射量。激励光源130是由定焦可调红外激光二极管模块组成,用于产生电子空穴对。
[微流控传感器单元]
如图2所示,本实施例的微流控传感器单元150包括基板151、光寻址电位传感器152、微孔膜153、进液管154、出液管155和工作电极156。基板151为0.5-1mm的pmma板。光寻址电位传感器152的背面具有导电层,与工作电极156连接,光寻址电位传感器152的背面和工作电极156通过导电胶固定在基板151上。微孔膜153通过生物特性稳定的粘合剂固定在光寻址电位传感器152的正面,微孔膜153带有纺垂形微流槽,进液管154和出液管155设置在微流槽的两端,插入并与微孔膜153固定。微流控传感器单元150的制备工艺流程包括:
步骤s210:选用1mm厚的pmma板,清洗烘干后用激光切割成长径微10mm,短径微3.6mm的纺垂形pmma片,作为微流腔的模具;
步骤s220:用双面胶带将纺垂形pmma片贴合到清洗并烘干的培养皿底部;
步骤s230:在培养皿中进行pdms注塑,将pdms与固化剂按10:1的比例混合均匀,至于真空室中静止20分钟去除气泡,浇铸到培养皿中,在80℃下干燥2小时,形成2-3mm的pdms膜,用于制备微孔膜;
步骤s240:取出成型的pdms膜,用刀具沿pdms膜内包含的纺垂形pmma片边切割形成纺垂形的微流腔;
步骤s250:切割pdms膜为15mm×15mm的正方形,微流腔的中心与正方形的中心对齐;
步骤s260:在pdms膜上,对应纺垂形的微流槽顶端的位置,分别钻孔形成入口和出口,孔的直径为300μm-500μm;
步骤s270:用生物特性稳定的粘合剂将正方形pdms膜贴合到同样大小的光寻址电位传感器的正面;
步骤s280:在pdms膜的入口和出口中,插入与孔过盈配合的金属管,金属管材料选用稳定性高的金属(如不锈钢、pt等),金属管上套设聚乙烯微孔管,分别用做进液管和出液管,同时金属管作为参考电极和辅助电极;
步骤s290:从光寻址电位传感器的背面引出导线和工作电极,用导电胶固定到清洗并干燥的基板上,例如1mm厚的pmma板。
[光寻址电位传感器]
如图3所示,本实施例的光寻址电位传感器152从背面到正面由铝层31、硅片基底32、绝缘体层33和保护层34顺序构成。其具体的加工流程如下:
步骤s310:选用n型单面抛光硅片,硅片厚度为500μm,将硅片切成15mm×15mm正方形硅单片经过rca标准清洗工艺清洗并烘干;
用5%氢氟酸湿化学蚀刻法对硅单片背面的laps对应区域进行光刻减薄处理形成硅片基底32,以提高光激励时响应电流的强度;
步骤s320:用热干燥氧化法(温度为1000℃,时间为40min)在硅片基底32正面的laps对应区域生长一层30nm的sio2,形成绝缘体层33;
步骤s330:采用等离子体增强化学气象沉积(pecvd)方法在sio2表面形成50nm的氮化硅层,作为保护层;
步骤s340:在硅片基底背面的laps对应区域通过热蒸发沉积形成厚度为300nm的铝层,作为导电层。
参考电极与信号电路120连接,和辅助电极配合为光寻址电位传感器152提供直流偏置电压,形成绝缘体/半导体界面上的空间电荷区。激励光源130照射硅片基底32产生电子空穴对,受空间电荷区电场作用会形成光电流,光电流受表面电位影响而具有交变振幅。由于光寻址电位传感器152与分析溶液直接接触,导致表面电位发生变化,改变光电流的强度,从而实现物质的定量分析。光寻址电位传感器152背面的铝层与工作电极连接,用于输出检测信号。
[信号电路]
如图4所示,信号电路120包括微控制器121和laps检测电路122。微控制器121采用16位、低功耗的msp426fg4619处理器,实现检测过程控制。laps检测电路122的结构包括:i/v变换电路41、调零及放大电路42、低通滤波电路43、阻抗电路44和时钟电路45。laps信号检测过程中,光寻址电位传感器152产生的微弱电信号通过i/v变换电路41由光电流转换成电压信号。可设置不同档位的i/v变换电路41,配以电子切换开关实现优化检测。电压信号通过调零及放大电路42进行信号调理,去除系统的直流偏置误差,进行同相放大,提高信噪比,再通过低通滤波电路43滤除低频噪声,提高信号质量,然后发送给微控制器121。阻抗电路44向光源调制电路130提供高频交流激励源进行阻抗检测,共同作用驱动激励光源,并将检测结果传递给微处理器121用于后期处理。时钟电路45通过微处理器121控制为阻抗电路44提供稳定可靠的时钟信号,可使用adf4001时钟信号芯片和16m有源晶振。
实施例2
如图5所示,本实施例的微流控糖类代谢分析检测装置200,包括:控制器210、信号电路220、激励光源230、光源调制电路240、微流控传感器单元250、微量注射泵260、废液池270、气泡消除单元280和真空泵290。微流控传感器单元250的进液通道与微量注射泵260连通,微流控传感器单元250的出液通道与废液池270连通,微流控传感器单元250上与信号电路220连接,实现对微流控传感器单元250施加偏压和信号采集。激励光源230设置于微流控传感器单元250的上方,与光源调制电路240相连,使微流控传感器单元250受到光激励产生光生电流。光源调制电路240与信号电路220连接,受信号电路220控制。信号电路220通过串口与控制器210相连,完成相关控制、数据传输和处理的功能。在微流控传感器单元250与微量注射泵260之间的进液通道上设置气泡消除单元280,泡消除单元280与真空泵连通,用于消除检测溶液中的微小气泡,提高检测精度。
微量注射泵260采用通用异步接收/发送协议(uart)控制注射泵。激励光源230是由定焦可调红外激光二极管模块组成,用于产生电子空穴对。本实施例的微流控糖类代谢分析检测装置200除气泡消除单元280和真空泵290外,其他结构与实施例1相同,故不再赘述。
[气泡消除单元]
如图6所示,本实施例的气泡消除单元280,包括:上基板61、下基板62、负压腔63、流体腔64、真空泵连接口65、微流入口66、微流出口67、真空泵连接管68和流体导管69,负压腔63和流体腔64相连通,位于上基板61和下基板62之间,负压腔63邻近上基板61,流体腔64临近下基板62,真空泵连接口65位于上基板61上,与负压腔63连通,微流入口66、微流出口67位于下基板62上,与流体腔66连通。本实施例的气泡消除单元280的具体制备工艺如下:
步骤s610:选用p型硅片,硅片厚度为540μm,切割得到2片15mm×40mm长方形硅单片,经过rca标准清洗工艺清洗并烘干;
步骤s620:利用负光刻胶对硅片进行刻蚀,在硅单片上刻蚀半径5mm、深100μm的圆形槽,以及在圆形槽两侧沿硅单片长边方向延伸的宽500μm引导槽,在圆形槽内部形成多列不同直径的通孔,例如包括1000μm、500μm和250μm的通孔,每列通孔间距与该列通孔直径相等;两个硅单片上的通孔相互对应(所在位置、直径和间距都相同),引导槽的长度不同,引导槽短的硅单片用于形成负压腔,引导槽长的硅单片用于形成流体腔;
步骤s630:在培养皿中进行pdms注塑,将pdms与固化剂按10:1的比例混合均匀,至于真空室中静止20分钟去除气泡,浇铸到培养皿中,在80℃下干燥2小时,形成200μm的pdms膜;
步骤s640:选用1mm厚的pmma板,切割得到2片20mm×50mm长方形片,分别对应2片硅单片引导槽位置处设置直径为500μm的连接通孔,在边角处设置与固定螺杆适配的固定通孔,清洗烘干后作为上基板61和下基板62;
步骤s650:将上基板61、第一硅单片、pdms膜、第二硅单片、下基板62顺序叠放,对齐第一硅单片的通孔和第二硅单片的通孔,上基板61与下基板61的固定通孔,确保上基板61的连接通孔对准第一硅单片的引导槽,下基板62的连接通孔对准第二硅单片的引导槽,将螺丝杆穿过上基板61与下基板62的固定通孔后用螺帽固定,使得在上基板61和第一硅片的圆形槽之间形成负压腔63,在pdms膜和第二硅片62的圆形槽之间形成流体腔64,上基板61的通孔作为真空泵连接口65通过第一硅片的引导槽与负压腔63连通,下基板62的通孔分别作为微流入口66和微流出口67通过第二硅片的引导槽与流体腔64连通;
步骤s660:将直径为500μm的聚乙烯管分别作为真空泵连接管68和流体导管69,套设在真空泵连接口65、微流入口66和微流出口67中,并在真空泵连接口65、微流入口66和微流出口67涂抹密封胶。
实施例3
乳酸菌对糖的分解代谢主要包括两种途径,即糖酵解途径(同型乳酸发酵)和磷酸解酮酶途径(异型乳酸发酵)。糖酵解途径(embden-meverhef-parnuspathway,emp)是指葡萄糖在无氧条件下酵解生成乳酸和三磷酸腺苷(atp)。磷酸解酮酶途径(phosphoketolasepathway,pk)是指葡萄糖在无氧条件下酵解生成等量的乳酸、乙醇、co2和atp。因此,乳酸菌对糖代谢都会产生对口味有影响的乳酸,采用本发明提供的糖类乳酸菌代谢分析检测装置,通过检测ph的变化来监测乳酸菌对不同糖的分解代谢情况。如图7所示,本实施例提供一种利用实施例1和2的微流控糖类代谢分析检测装置对糖类代谢进行分析检测的方法,具体步骤如下:
步骤s710:对微流控传感器单元进行校准,确定偏置电压范围;
使用ph值在2.0-8.0之间的磷酸缓冲盐水(pbs),施加偏置电压在-2.0v-+0.6v,阶跃电压为10mv。激励光波长为450nm,频率为10khz,检测不同梯度ph溶液中检测微流控传感器单元输出的i-v曲线,选择最大斜率处的光电流值作为工作点,确定微流控传感器单元偏置电压范围为-1.5v至-1.0v。
步骤s720:培养乳酸菌并接种到微流控传感器单元中;
口腔中的乳酸菌种类繁多,主要存在于唾液、牙菌斑和口腔粘膜中,其中具有益生特性的主要是乳酸杆菌,乳酸杆菌约占口腔微生物总数的1%。本试验采用与口腔中种类相同的市售活性乳酸菌进行实验。采用杜尔贝科改良的eagle培养基,10%胎牛血清,100u/ml青霉素,100u/ml链霉素,温度为37℃,培养,计数调整至所需密度,接种到微流控传感器单元的微孔膜153中。乳酸菌的密度为0.5-3×107cfu/ml。
步骤s730:向微流控传感器单元输送糖溶液,施加偏置电压和调制激励光;
糖类可以是天然甜味剂,也可以是人工甜味剂,可以是单一种类甜味剂,也可以是复合种类甜味剂,也可以是添加其他调味剂的功能甜味剂。人工甜味剂包括高甜度甜味剂和甜味缓冲剂。其他调味剂可以为包括有机酸或无机酸在内的酸味添加剂。
高甜度甜味剂是指具有高于蔗糖、果糖或葡萄糖的增甜效能,而且热量较低的物质。非限制性实例包括:环己基氨基磺酸钠(甜蜜素)、环己基氨基磺酸钙、l-α-天冬氨酰-n-(2,2,4,4-四甲基-3-硫化三亚甲基)-d-丙氨酰胺(阿力甜)、天门冬酰苯丙氨酸甲酯乙酰磺胺酸、三氯蔗糖(蔗糖素)、乙酰磺胺酸钾(安赛蜜)、天门冬酰苯丙氨酸甲酯(阿斯巴甜)、糖精、新橘皮苷二氢查酮、n-[n-(3,3-二甲基丁基)]-l-α-天门冬氨-l-苯丙氨酸1-甲酯(纽甜)、莱包迪苷a、莱包迪苷b、莱包迪苷c、莱包迪苷d、莱包迪苷e、杜尔可苷a、甜菊(糖)苷、罗汉果苷ⅳ(罗汉果皂苷)、罗汉果苷ⅴ(罗汉果皂苷)、罗汉果甜味剂(罗汉果甜苷)、赛门苷、甘草酸三钾盐、甘草酸三钠盐、甘草酸单铵盐、甘草酸铵、甘草酸一钾、甘草酸三钾、奇异果甜蛋白(索马甜)、仙茅甜蛋白、应乐果甜蛋白(莫奈林)、马槟榔甜蛋白、博灵(巴西甜蛋白)、荷南度辛、甘茶素、奥斯来丁、聚婆朵苷、培它丁、环拉酸盐、甘草皂苷、乙酰舒泛钾、阿司帕坦等。
甜味缓冲剂包括具有低于蔗糖、果糖或葡萄糖或与其相当的增甜效能,而且热量较低的物质,例如糖类还原形式的糖醇、多醇或聚醇,其中该羰基(醛或酮,还原性糖类)已被还原成初级或次级羟基。本发明甜味缓冲剂的非限制性实例包括:木糖醇、山梨糖醇、d-甘露糖醇、麦芽糖醇、异麦芽糖醇、赤藓糖醇、半乳糖醇、乳糖醇(4-β-d吡喃半乳糖-d-山梨醇);棉籽糖、乳糖、麦芽糖、异麦芽酮糖、α-d-葡萄糖、α-d-甘露糖、α-d-木糖、α-d-半乳糖、β-d-呋喃果糖、β-d-麦芽糖、β-d-乳糖;明胶,酪蛋白酸钠,阿拉伯胶、罗望子胶、田菁胶、琼脂、海藻酸钠、海藻酸钾,卡拉胶、果胶、黄原胶、β-环糊精、羧甲基纤维素钠、淀粉磷酸酯钠、羧甲基淀粉钠、羟丙基淀粉或海藻酸丙二醇酯。
有机酸添加剂包括任何含有-cooh基团之化合物,包括但不限于c2-c30羧酸类、取代的羟基c1-c30羧酸类、取代的肉桂酸类、羟基酸类、取代的羟基苯甲酸类、取代的环己基羧酸类、鞣酸、乳酸、酒石酸、柠檬酸、延胡索酸、葡萄糖酸、羟基柠檬酸、苹果酸、富马酸、马来酸、琥珀酸、水杨酸、肌酸、醋酸、抗坏血酸、己二酸、乙酸、乙二酸、正丁酸、甲酸、聚谷氨酸、盐酸葡萄糖胺、葡萄糖酸-δ-内酯及其碱金属或碱土金属盐类衍生物。
无机酸添加剂包括但不限于磷酸、亚磷酸、聚磷酸、碳酸、磷酸二氢钠、及其对应之碱金属或碱土金属盐类(如六磷酸肌醇镁/钙)。
糖溶液的输送速度为300-600ml/h。
步骤s740:实时记录检测信号,并根据检测信号描绘该糖溶液的乳酸菌代谢曲线。
在恒压模式下,工作温度为35℃-40℃,连续记录光电流信号3-10分钟,氮化硅作为ph值换能器材料的灵敏度为335.5na/ph,根据该特性描绘时间-ph曲线。
在两种糖溶液检测之间需要用去离子水冲洗测试腔三遍。
[糖类乳酸菌代谢检测实例]
偏压范围为-1.3v,采集时间为5分钟,用电阻率为15mω·cm以上的超纯水制备测试用的溶液,乳酸菌用量为1.0×107cfu/ml,温度为37℃。测量并记录各糖类溶液的伏安特性数据,分析得到糖类乳酸菌代谢特性曲线,以时间为横坐标,ph变化率为纵坐标。测试的糖类溶液包括:
测试例1:75mmol/l蔗糖溶液。
测试例2:三氯蔗糖、赤藓糖醇和麦芽糖醇的重量比为3:800:300,甜度与75mmol/l蔗糖溶液一致的混合溶液;
最终得到的测试曲线结果显示随着时间的推移,蔗糖溶液与乳酸菌发生发酵溶液ph逐渐下降,随着反应生成乳酸的量增多,ph值下降速率增大。40-60秒后,ph值开始快速下降速率,120-180秒ph下降逐渐减缓,ph值稳定在3-4之间。相对而言,人工甜味剂溶液与乳酸菌发酵反应较小,ph仅有小幅下降。
[糖类代谢口味模拟实例]
偏压范围为-1.3v,采集时间为5分钟,用电阻率为15mω·cm以上的超纯水制备测试用的溶液,乳酸菌用量为1.0×107cfu/ml,温度为36℃。测量并记录各糖类溶液的伏安特性数据,分析得到糖类乳酸菌代谢特性曲线,以时间为横坐标,ph变化率为纵坐标。测试的糖类溶液包括:
标准液:75mmol/l蔗糖溶液。
酸度梯度测试液各成分的具体含量如表1所示。
表1:测试液成分含量
使用数字防水ph计,hmdigitalph计ph-200,测量样品ph值。ph计用generalhydroponics生产的标准ph7.0参比溶液进行校准。该设备在测量前校准。
结果显示随着时间的推移,蔗酸度范围在3.0-4.0之间的测试液,在120-180秒间与蔗糖代谢吻合度更高。
以上通过实施例对于本发明的发明意图和实施方式进行详细说明,但是本发明所属领域的一般技术人员可以理解,本发明以上实施例仅为本发明的优选实施例之一,为篇幅限制,这里不能逐一列举所有实施方式,任何可以体现本发明权利要求技术方案的实施,都在本发明的保护范围内。
需要注意的是,以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施方式仅限于此,在上述实施例的指导下,本领域技术人员可以在上述实施例的基础上进行各种改进和变形,而这些改进或者变形落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!