一种牙鲆弹状病毒病感染态与免疫态的快速诊断试纸的制作方法
本发明涉及一种诊断试纸条及其制备方法,特别涉及一种对牙鲆弹状病毒病感染态与免疫态快速诊断试纸及其制备方法,属于免疫学、微生物学及诊断试剂交叉技术领域。
背景技术:
牙鲆弹状病毒(hiramenovirhabdovirus,hirrv)是一种具有囊膜不分段的单股负链rna病毒,同时引起牙鲆疾病的主要病毒,所引起的牙鲆弹状病毒病具有传播性强,病程短,致死率高的特点,是牙鲆养殖过程中最常见的疾病之一,成为牙鲆养殖业发展的重大障碍,给全球的牙鲆养殖业造成了严重的经济损失。对牙鲆弹状病毒进行快速的诊断、尽早的控制病原的传播、进行有效的疫苗免疫是有效防控该病的关键。
hirrv的基因组全长约为11000bp,含有6个开放阅读框(openreadingframe,orfs),从3’端到5’端依次编码核蛋白(nucleoprotein,n)、磷蛋白(phosphoprotein,p)、基质蛋白(matrixprotein,m)、糖蛋白(glycoprotein,g)、依赖rna的rna聚合酶(rnapolymeraseprotein,l)和非结构蛋白(non-virionprotein,nv)。其中m蛋白在囊膜的最内层且含量最高,易于抗m蛋白抗体识别并结合。然而,目前对病毒非结构蛋白(non-virionprotein,nv)在病毒感染情况下以及在成熟病毒粒子中的表达特性仍不清楚。
目前针对hirrv的检测方法主要有细胞培养分离病毒法、组织病理切片法、电镜观察法)、聚合酶链式反应(pcr)、实时定量pcr、环介导等温扩增技术(lamp)以及酶联免疫反应(elisa)等。以上检测方法有各自的优点并且均能有效、准确的检测牙鲆弹状病毒,但是它们都受限于需要专业的设备和复杂的操作技术,难以在生产养殖现场实现快速检测。并且这些方法不能应用于亲鱼疾病的检测,因为需要将鱼杀死进行取样完成检测。
公开号为cn111537729a的中国专利申请公开了一种牙鲆弹状病毒病快速诊断试纸及其制备方法,适用于牙鲆养殖现场对牙鲆弹状病毒的快速诊断。但其仅能利用鱼体病毒靶器官检测牙鲆弹状病毒的有无,而无法通过牙鲆的血清样品检测鱼体是处于病毒感染态还是免疫态。
因此,亟需建立一种能应用于养殖生产现场的快速、准确、灵敏的检测方法,而且对该疾病感染状态进行检测。
技术实现要素:
针对上述问题,本发明的目的是提供一种快速、简便、特异性强、灵敏度高的牙鲆弹状病毒病感染态与免疫态快速诊断试纸,用于牙鲆养殖现场对牙鲆弹状病毒的快速诊断,其检测结果肉眼可见,不需要专业仪器设备和复杂的操作技术。
本发明的另一个目的是提供一种上述牙鲆弹状病毒病感染态与免疫态快速诊断试纸的制备方法。
本发明基于牙鲆弹状病毒m蛋白和nv蛋白的在感染条件下的表达特性,制备牙鲆弹状病毒病感染态与免疫态快速诊断试纸。由于在病毒感染条件下,牙鲆血清中可诱导产生特异性抗m蛋白及nv蛋白的抗体,但在免疫接种灭活病毒疫苗的情况下仅诱导牙鲆产生抗m蛋白抗体。因而,以抗牙鲆免疫球蛋白(igm)单克隆抗体为金标抗体,以重组纯化的m蛋白和nv蛋白为检测抗原,制备胶体金检测试纸,可以通过检测牙鲆的血清判定鱼体是处于感染态还是免疫态,以用于hirrv灭活疫苗免疫效果的评估和养殖生产现场对牙鲆弹状病毒病进行快速诊断。
本发明通过聚丙烯酰胺凝胶电泳、间接免疫荧光鉴定了牙鲆弹状病毒非机构蛋白的特性以及选取牙鲆弹状病毒结构蛋白中基质蛋白作为特异性抗原,克服了抗原免疫交叉反应对结果判定的干扰问题,并利用胶体金间接免疫层析技术实现对牙鲆弹状病毒病感染态与免疫态的快速诊断。
本发明的目的是由以下具体技术方案实现的:
一种牙鲆弹状病毒病感染态与免疫态的快速诊断试纸,包括载体板、样品垫、金标垫、硝酸纤维素膜和吸水垫,所述样品垫和吸水垫位于所述载体板的两端,所述硝酸纤维素膜位于所述载体板的中部;所述样品垫与硝酸纤维素膜交界处设有载有金标鼠抗牙鲆免疫球蛋白(igm)单克隆抗体的金标垫,所述金标垫一端边缘重叠在样品垫之下,另一端边缘重叠在硝酸纤维素膜之上;所述硝酸纤维素膜上设有依次排列的两条检测线t2、t1和一条质控线c,所述质控线c靠近吸水垫;其特征在于,所述检测线t1包被重组纯化的nv蛋白,所述检测线t2包被重组纯化的m蛋白,所述质控线c包被羊抗小鼠igg。
所述的鼠抗牙鲆免疫球蛋白(igm)单克隆抗体能特异性结合牙鲆igm的重链,抗体类型为igg,是由杂交瘤细胞株jf-igm-h分泌所得,杂交瘤细胞株的保藏号为cctcc-c200631,保藏单位为中国典型培养物保藏中心,保藏日期为2006年7月6日。所述杂交瘤细胞株jf-igm-h已被cn107607718a专利申请所公开。
所述重组纯化的非结构蛋白(non-virionprotein,nv)为牙鲆弹状病毒非结构蛋白能特异性结合感染牙鲆弹状病毒的牙鲆血清抗体,但不能结合免疫牙鲆弹状病毒的牙鲆血清抗体。
所述重组纯化的牙鲆弹状病毒基质蛋白(matrixprotein,m)为牙鲆弹状病毒结构蛋白,能特异性结合牙鲆抗牙鲆弹状病毒血清抗体。
一种上述牙鲆弹状病毒病感染态与免疫态快速诊断试纸的制备方法,包括以下步骤:
(1)鼠抗牙鲆免疫球蛋白单克隆抗体的腹水生产与纯化:
复苏并培养分泌抗牙鲆igm单抗的杂交瘤细胞株jf-igm-h,腹腔注射balb/c小鼠,采集腹水,辛酸-硫酸铵法提纯获得单抗;
(2)牙鲆弹状病毒nv蛋白和m蛋白的制备与纯化:
通过聚丙烯酰胺凝胶电泳、间接免疫荧光,选定牙鲆弹状病毒非结构蛋白和牙鲆弹状病毒基质蛋白,通过原核表达技术和his标签蛋白纯化技术制备抗原以及nv蛋白多克隆抗体和m蛋白单克隆抗体;
(3)金标垫的制备:
采用柠檬酸三钠还原法制成颗粒大小为20-30nm的胶体金,再以碳酸钾溶液调节胶体金ph值到8.2;将抗牙鲆igm单抗加入胶体金中,再加入牛血清白蛋白(bsa),离心纯化后用金标保存液悬起,即为金标单抗液体;将制成的金标单抗液体喷涂到玻璃纤维上,冷冻干燥,即为载有金标单抗的金标垫;
(4)硝酸纤维素膜的制备:
分别将重组纯化的牙鲆弹状病毒nv蛋白和m蛋白按一定浓度、间距、顺序喷涂于硝酸纤维素膜作为检测线t1、t2,将羊抗小鼠igg喷涂于硝酸纤维素膜作为质控线,晾干,于封闭液中浸泡,pbst漂洗,干燥;
(5)牙鲆弹状病毒病感染态与免疫态快速诊断试纸的制作:
在载体板上依次贴上硝酸纤维素膜、吸水垫、金标垫和样品垫,放入切条机槽内切割成3.7mm宽的试纸,将切好的试纸放入装有干燥剂的铝箔袋内封口,装入包装卡壳,密封于铝箔袋中保藏,即为本发明试纸。
所述牙鲆弹状病毒非结构蛋白多克隆抗体能够特异性识别受感细胞中nv蛋白存在。
所述牙鲆弹状病毒结构蛋白基质蛋白单克隆抗体能够特异性识别hirrv。
利用本发明试纸对牙鲆弹状病毒病进行检测的方法,其步骤如下:
平放本发明试纸检测卡,向样品孔中滴加经过处理的检测样品液100μl,等待10-15min,肉眼观察检测结果,根据检测线t1、t2显色情况来判断鱼体患病情况。
所述待检样品的前处理方法如下:
从牙鲆尾静脉采取1ml血液,血样室温静置,待血清自然析出后,吸取上清,即为待测鱼血清;将血清稀释10倍,即为检测样品液。
本发明采用间接免疫层析原理:当样品扩散至金标垫时,金标单抗将与样品中的牙鲆igm结合,形成大量的金标单抗-igm复合物,由于虹吸作用,该复合物随着样品液进入硝酸纤维素膜,如果样品中含有抗牙鲆弹状病毒的抗体,当样品液到达检测线t2时,一部分金标单抗-igm复合物与包被在此处的m蛋白发生特异性结合,形成金标单抗-igm-m的复合结构,单抗上标记的胶体金颗粒在此处固定并累积使得检测线t2显现肉眼可见的红色。剩余的金标单抗-igm复合物继续随样品液沿膜前行,到达检测线t1时,另一部分金标单抗-igm复合物与包被在此处的nv蛋白发生特异性结合,检测线t1也出现肉眼可见的红色。最后样品液前行至质控线时,未与血清中igm结合的游离金标单抗和未与检测线上抗原反应的金标单抗-igm复合物将会结合在预先包被羊抗小鼠igg的质控线上,形成金标单抗-羊抗小鼠igg复合物或金标单抗-igm-羊抗小鼠igg复合物,在质控线处也出现由胶体金颗粒固定并累积显现肉眼可见的红色。若检测样品中不含牙鲆弹状病毒抗体或抗体浓度,两条检测线不同时红色,质控线显现红色;若质控线和检测线处都不显示红色,说明试纸失效,检测结果无效。
本发明具有以下优点:检测快速,10min左右出现肉眼直视结果;操作简便,不需要专业人员;检测成本低,无需专业仪器设备,适合养殖现场检测;灵敏度高,特异性强,具可重复性;储存方便,稳定性好,室温下有效期6个月,4℃下有效期12个月;适用于牙鲆养殖过程中牙鲆弹状病毒病感染态与免疫态的检测与鉴别。
附图说明
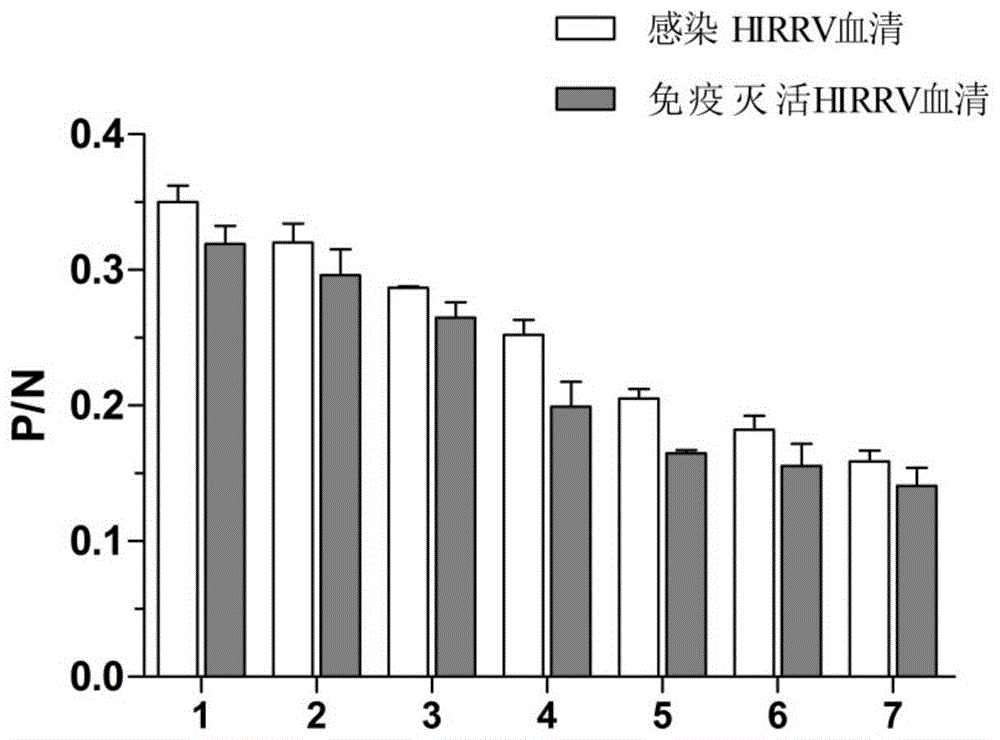
图1是elisa测定感染和免疫hirrv的牙鲆血清效价结果图。
图2是sds-page分析纯化的hirrv结构蛋白结果图。
其中,m:蛋白质分子量标准;1:纯化hirrv。
图3是间接免疫荧光检测牙鲆弹状病毒nv蛋白和m蛋白在病毒感染epc细胞中的表达结果。
其中,a:hirrv感染24h后的epc细胞免疫荧光检测结果;b:未感染hirrv的epc细胞检测结果。
图4是westernblotting分析感染和免疫hirrv的牙鲆血清分别与nv蛋白及m蛋白的免疫反应特性结果图。
其中,m:蛋白质分子量标准;1:m蛋白与感染hirrv的牙鲆血清反应结果;2:m蛋白与免疫灭活hirrv的牙鲆血清反应结果;3:m蛋白与健康牙鲆血清反应结果;4:nv蛋白与感染hirrv的牙鲆血清反应结果;5:nv蛋白与免疫灭活hirrv的牙鲆血清反应结果;6:nv蛋白与健康牙鲆血清反应结果。
图5是本发明的快速诊断试纸的结构示意图。
其中,1、样品垫;2、金标垫;3、硝酸纤维素膜;4、吸水垫;5、载体板;6、检测线t2;7、检测线t1;8、质控线。
图6是本发明的快速诊断试纸对牙鲆样品的检测结果示意图。
其中,ⅰ:牙鲆感染牙鲆弹状病毒;ⅱ、ⅲ:牙鲆未感牙鲆弹状病毒,但存在与抗原n蛋白或m蛋白存在免疫交叉反应的其他病原体的抗体;ⅳ:牙鲆未感染牙鲆弹状病毒;ⅴ和ⅵ:试纸失效或本次操作出现问题。
图7是本发明的快速诊断试纸对不同稀释度的感染hirrv的牙鲆血清样品实际检测结果图。
其中,ⅰ-ⅵ:稀释度分别为1:10、1:20、1:40、1:80、1:160、1:200的血清;ⅶ:健康牙鲆血清。
图8是本发明的快速诊断试纸对不同稀释度的免疫灭活hirrv的牙鲆血清样品实际检测结果图。
其中,ⅰ-ⅵ:稀释度分别为1:10、1:20、1:40、1:80、1:160、1:200的血清;ⅶ:健康牙鲆血清。
图9是本发明的快速诊断试纸对牙鲆血清样品的实际检测结果图。
ⅰ:牙鲆抗hirrv血清试纸条检测为阳性;(ⅱ、ⅲ)牙鲆抗传染性造血器官坏死病病毒(ihnv)血清、抗病毒性出血败血症病毒(vhsv)血清检测结果为弱阳性;(ⅳ-ⅶ)牙鲆抗淋巴囊肿病毒血清、健康牙鲆血清、牙鲆抗迟缓爱德华氏菌、鳗弧菌检测结果均为阴性。
具体实施方式
下面结合附图并通过具体实施例来进一步说明本发明。
以下实施例所用材料及仪器:
实验牙鲆购自山东日照某牙鲆养殖场,体长15cm-17cm,在水温为20-22℃的环境下暂养1周,每天定时换水一次、投喂颗粒饲料,保证养殖期间连续充氧。
牙鲆弹状病毒(cnpo2015),传染性造血器官坏死病病毒(ihnv)、病毒性出血败血症病毒(vhsv)、牙鲆淋巴囊肿病毒(lcdv)、迟缓爱德华氏菌、鳗弧菌病毒株和菌株由发明人所在实验室鉴定并保藏。
荧光显微镜(购自zeiss公司);倒置显微镜(购自olympus公司);超速离心机(购自hitachi公司);高速冷冻离心机(sigma公司);nanodrop8000(购自thermo公司);pcr仪、琼脂糖糖凝胶电泳系统、sds-page凝胶电泳系统和电转印系统(购自bio-rad公司);酶标仪(购自tecan);蛋白纯化系统(购自ge公司);喷膜仪xyz3060、半自动贴膜仪lm5000、切条仪(购自bidot公司);bca蛋白浓度测定试剂盒(购自beyotime公司);extaq、dntpmix、感受态细胞bl21、琼脂糖凝胶回收试剂盒、pcr产物回收试剂盒(购自transgen公司);iptg、尿素、透析袋(购自solarbio公司);histraptmhap亲和层析柱(5ml)、柠檬酸三钠、氯金酸、羊抗小鼠igg、牛血清白蛋白、tween-20(购自sigma公司);硝酸纤维素膜(购自whatman公司);alexafluor488标记的羊抗兔ig(购自dylight公司);alexafluor647标记的羊抗鼠ig(购自dylight公司)。
实施例1:牙鲆弹状病毒蛋白的筛选
1.抗血清的制备
取保存的牙鲆弹状病毒病毒悬液接种于铺满单层epc细胞的细胞培养瓶中,75cm2细胞单层接种1mlhirrv病毒悬液。将细胞培养液(含10%胎牛血清)替换为细胞维持液(含2%胎牛血清),将感染病毒的细胞培养瓶转移到20℃培养箱中。定期观察细胞形态变化,等到第3-4天后,cpe病变完全,收集培养瓶内的细胞悬液,保存在-80℃的冰箱内。取感染hirrv的细胞悬液,使用前置于冰上融化,细胞悬液离心用终浓度为0.5%的福尔马林溶液在4℃条件下灭活72h;用超速离心机于4℃下,120000g对病毒液离心3h,收集沉淀,浓缩10倍进行重悬,病毒的拷贝数为106.3tcid50/100ul。按1:1的比例将hirrv病毒与弗氏完全佐剂混合,腹腔注射100ul免疫牙鲆,同时腹腔注射hirrv拷贝数为106.3tcid50/100ul感染牙鲆,对照组注牙鲆注射等量的pbs。免疫后每隔一周进行尾静脉采血,采集牙鲆血液。将血液样品先在室温下倾斜放置1h,再放入4℃冰箱过夜,次日,将离心机温度设置为4℃,以5000g的离心力离心15min,小心地吸取上清。将血清置于-20℃冰箱内冻存,待后续实验使用。
2.间接elisa测定抗血清效价
取96孔酶标板,每孔加入100μl经超速离心浓缩的hirrv病毒悬液在4℃包被过夜。次日,弃去包被液,每孔加入200μl的pbst洗涤3次,每次5min,洗涤结束后,加入5%bsa的每孔200μl,放置于37℃培养箱1h进行封闭。每孔弃去封闭液,用pbst洗涤3次,每次5min。将牙鲆抗hirrv血清进行梯度稀释10倍、20倍、40倍、80倍、160倍、320倍、640倍,每孔加入100μl,在37℃培养箱孵育1.5h,用等量pbs作为对照。用pbst洗涤3次,每次5min,每孔加入100μl的鼠抗牙鲆igm单抗在37℃条件下孵育1h,pbst洗涤3次,每次5min。每孔加入100μl的ap二抗(ap标记的羊抗鼠igg),37℃放置45min,pbst洗三次,每次5min。配制的pnppna发色液于每孔中加入100μl,置于酶标仪中,405nm处读取od值,计算阳性值与阴性对照吸光值之比(p/n),p/n≥2.1时,结果为阳性。p/n≥2.1的最大稀释度即为血清效价,稀释倍数分别为10倍、20倍、40倍、80倍、160倍、320倍、640倍elisa结果(图1)显示感染和免疫hirrv的牙鲆血清效价分别为1:160,1:80,可以用于后续实验。
3.hirrv提纯
将100ml的感染hirrv的细胞悬液从-80℃的冰箱内取出,进行反复3次的冻融,超声波破碎30min,在4℃的条件下以6000g的离心力进行20min的离心,收集上清,去除细胞碎片。使用离心机,在4℃的条件下以12000g的离心力进行30min的离心,去除细胞碎片,收集上清液。在4℃下,120000g超速离心3h,收集沉淀,加入适量tne(10mmol/ltris-hcl,1mmol/lnacl,1mmol/ledta,ph7.4)缓冲液浓缩10倍进行重悬。配制出20%、30%、40%和50%的蔗糖溶液,将浓度为20%、30%、40%和50%的蔗糖溶液小心地依次铺入离心管中。可以观察到明显的密度梯度差异形成的界面(一条明亮的条带),将病毒浓缩液缓慢并且轻柔地加至20%蔗糖界面上。将离心管组装到超速离心机配套的水平转子中,开启超速离心机,在4℃条件下、以120000g的离心力进行3h的离心。离心结束后,超速离心机进行去真空,打开离心机,动作轻缓地拆卸离心管,快速地收集在30%和40%蔗糖界面层之间出现的的浑浊溶液(hirrv溶液密度大约等于37%蔗糖密度)。向收集的液体中加入适量的pbs缓冲液,用超速离心机以4℃、120000g离心3h,去除蔗糖,收集沉淀。将沉淀溶于适量的pbs缓冲液中,进行检测,置于-20℃冰箱内冻存,待后续实验使用。
4.聚丙烯酰胺凝胶电泳实验
取15μl纯化的病毒液,加入适量的的5×sdsbuffer,在沸水中加热15min,冷却备用。制备由3%(v/v)的浓缩胶和12%(v/v)的分离胶组成的sds-page凝胶;进行加样,每孔内加样品15ul,接通电源,设置恒流30ma,当sdsbuffer的蓝色指示剂到达底部边缘溢出时,立即关闭电源,停止电泳。轻轻地撬开玻璃,小心地取出凝胶,在考马斯亮蓝r250然液中染色40min,然后放置在洗液中在摇床上脱色过夜。在(图2)中可以看到4条清楚的蛋白条带,分别是g蛋白(60kda)、n蛋白(42kda)、p蛋白(29kda)和m蛋白(24kda)。l蛋白分子量大小为224kda,l蛋白由于含量最少且分子量较大,在电泳结果图片中没有显示出来,nv蛋白分子量为13kda,也没有发现其存在于成熟病毒粒子中。
5.重组抗原的制备及特异性分析
(1)目的片段的克隆:根据ncbi数据库公布的牙鲆弹状病毒nv蛋白和m蛋白的基因组序列,利用primer5.0软件设计特异性引物,选择限制性内切酶为salⅰ、eorⅰ和bamhi、sali,引物序列如下所示:
hirrv-nvf:5′-atgaactcaaaaaccccaagc-3′
hirrv-nvr:5′-tctggggagagggaggaac-3′
hirrv-m-f:5’-cgggatccatgtctctcttcaagcgaac-3’
hirrv-m-r:5’-gcgtcgactttcccctttttggttg-3’
它们的酶切位点分别为bamhi、sali和bamhi、sali。
pcr反应体系(25μl体系):depc水17μl,10×extaqbuffer2.5μl,dntpmixture(2.5mmol/l)2μl,f-primer1μl,r-primer1μl,模板((反转录hirrv的dna)1μl,extaq0.5μl。扩增程序为:95℃5min,1个循环;95℃30s,55℃30s,72℃1min,35个循环;72℃10min。用1.0%琼脂糖凝胶电泳鉴定pcr产物,使用琼脂糖凝胶回收试剂盒回收纯化的dna片段。并进行双酶切实验,具体反应体系为:回收pcr产物:1μg,kbuffer:2μl,sali:1μl,bamhi:1μl,加ddh2o至终体积20μl,37℃酶切5h,取出后直接利用pcr产物纯化试剂盒对酶切产物进行纯化,经琼脂糖电泳确定纯度,用nanodrop8000测定浓度。纯化产物-20℃冻存备用。
(2)双酶切、连接、转化及阳性菌检测:以限制性内切酶sali和bamhi分别对产物和pet-28a、pet-32a质粒进行双酶切,根据目的基因浓度和pet-28a、pet-32a质粒浓度,调整两者的浓度比例。最终的反应体系如下:目的基因6μl,t4dnaligase:2μl,pet-28a、pet-32a质粒:2μl,t4dnaligasebuffer:2μl,ddh2o:8μl,连接体系于16℃连接过夜。从-80℃取出1管dh5α感受态细胞(200μl),立即置于冰上7min使其解冻;超净工作台中加入连接产物(<50ng)弹匀后冰上放置30min;42℃热激50s后立即冰浴2min;然后向管中加入890μl不含氨苄青霉素的lb液体培养基混匀后37℃恒温培养箱中振荡培养1h;培养结束后,4000r离心2min,超净台中留200μl上清混匀沉淀后均匀涂布于在含50μg/ml氨苄青霉素的lb固体培养基上,正面放置3min后做好标记置于37℃恒温培养箱中倒置培养过夜。次日随机挑选平板上的单菌落置于新的平板中,做好标记。然后作为模板,以目的基因的上游引物和t7下游引物置于pcr反应体系中混匀后进行pcr反应。pcr产物经琼脂糖电泳,条带单一且大小一致的为阳性菌,挑选阳性菌至含有1mllb液体培养基的1.5ml离心管中37℃培养至对数期后送至擎科生物公司进行测序。将测序的结果用ncbi中进行blast在线比对,挑测序结果和目的基因匹配正确的菌落作为阳性菌落。将在平板上相对应的阳性菌落转接到含氨苄青霉素的液体培养基中,37℃振荡培养过夜。用质粒小量提取试剂盒,对培养过夜的阳性菌液里所含目的基因的质粒进行提取,转化至bl21(de3)感受态细胞中,转化及阳性菌检测步骤同上。将阳性菌接种于含氨苄青霉素抗生素的lb液体培养基,37℃振荡培养过夜,取500μl菌液与等体积30%的甘油混匀,保存于-80℃冰箱。
(3)重组菌诱导表达及纯化:
将重组表达菌接种到含0.1氨苄青霉素抗生素的500mllb液体培养基中,37℃振荡培养6h,待od600达到0.6左右时,收集1ml菌体,然后加入终浓度为1.0mmol/liptg诱导表达12h后,再收集1ml菌体。剩下的培养物于8000g离心10min后,再加入50mlbindingbuffer(8mol/l尿素,0.5mol/lnacl,20mmol/lna3po4,30mmol/l咪唑,调整ph值至7.4)。经过超声破碎之后,12000g离心5min。样品需要用0.45µm的滤膜过滤,然后加入镍琼脂糖亲和层析柱,经bindingbuffer平衡后,以elutionbuffer(8mol/l尿素,0.5mol/lnacl,20mmol/lna3po4,500mmol/l咪唑,调整ph值至7.4)作为洗脱液,把洗脱下来的蛋白分步进行收集,然后分步透析,透析液中尿素浓度从8mol/l、6mol/l、4mol/l、2mol/l至0mol/l依次降低,中间间隔12h更换透析液,最后以pbs透析。sds-page检测iptg诱导前后和纯化后的样品。透析完成的样品首先需要通过电泳检测纯度,高纯度的蛋白可以进行后续试验,并保存在-80℃冰箱中备用。
(4)兔抗nv蛋白多克隆抗体的制备:
将重组表达的nv蛋白浓度调至1mg/ml,选取适龄的新西兰大白兔进行免疫。免疫的具体程序如下:将nv蛋白与弗氏完全佐剂进行1:1的混合,第一次进行皮下六点注射0.6ml;2周后进行加强免疫,将蛋白悬液混合弗氏不完全佐剂(1:1),皮下六点注射0.6ml;每间隔一周,再加强免疫2次,每次进行耳缘静脉注射蛋白液1.2ml;最后一次加强免疫后第7天进行心脏采血;将血液室温放置1h,在4℃冰箱过夜。次日,以5000g离心20min,吸取上清液,分装保存于-20℃冰箱备用。
(5)鼠抗m蛋白单克隆抗体的制备:
将已纯化m蛋白免疫适龄balb/c小鼠,免疫小鼠脾细胞和p3u1瘤细胞融合后筛选杂交瘤细胞,获得稳定分泌hirrv-m蛋白的杂交瘤细胞株。收集杂交瘤细胞,用无菌rpmi1640清洗5次,并用适量rpmi1640重悬。取8-12周龄的balb/c小鼠,腹腔注射0.5ml无菌液体石蜡。一周后腹腔注射0.5ml杂交瘤细胞悬液,约含5×105-1×106个细胞。每天观察小鼠腹部情况,如观察到小鼠腹部明显膨大,用手触摸时皮肤有紧张感,即可采集腹水。将获得的腹水于4℃冰箱内静置过夜,次日4℃,3000rpm,离心10min,吸去上层脂类物质,除去下层细胞沉淀物,收集中间层腹水。测量腹水的体积,按1:2的体积比加入ph4.8的0.06mol/l乙酸缓冲液,用0.1mol/l的hcl调ph值至4.5。按照每毫升腹水加入33ul的正辛酸,吸取适量的正辛酸,一滴一滴地缓慢的滴加。搅拌30min后,可以看到有白色沉淀出现。将其放置在4℃冰箱过夜,第二天用离心机以12000r/min、离心30min,取上清。上清用0.45um滤膜进行过滤,加入1/10体积的含0.2mmol/ledta的10×pbs(200ml的10×pbs加入0.015gedta。用1mol/l的naoh调节ph值至7.4。在4℃的冰浴条件下,边搅拌边缓慢地向每毫升液体中加入0.258g的硫酸铵粉末,持续搅拌30min,液体中会不断地产生沉淀,然后静置2h。用离心机在4℃条件下以12000r/min、离心30min,按每毫升腹水加200ulpbs,使离下的沉淀溶于相对应的pbs中。将溶液倒入透析袋中,放于4℃冰箱,在超纯水中进行透析,每隔4h更换一次透析液,大约更换3-4次。将透析好的溶液放在冻干机中进行冻干,变成粉末后,溶于超纯水。用bca蛋白浓度测定试剂盒测得抗牙鲆弹状病毒m单抗的蛋白浓度为6mg/ml。放于-80℃冰箱备用。
6.间接免疫荧光实验
将感染hirrv24hepc细胞与未感染epc细胞,进行滴片,沉降3h,用2%多聚甲醛固定15min,固定后的细胞,pbst洗三次,每次5min,孵育一抗nv兔多抗(1:2500)与m鼠单抗抗(1:1000)等体积混合,37℃孵育90min,pbst洗三次,每次5min。孵育二抗,alexafluor647标记的羊抗鼠ig(1:500)与alexafluor488标记的羊抗兔ig(1:500)等体积混合孵育m鼠单抗与nv兔多抗组37℃孵育1h后,同上清洗,细胞核用dapi衬染20min,pbs清洗后,甘油封片,荧光显微镜下观察拍照,结果显示(如图3),感染hirrv的epc细胞存在红色荧光与绿色荧光共定位,未感染细胞不存在,说明nv蛋白在hirrv感染细胞状态下可以正常表达。
7.免疫印迹实验分析重组抗原特异性
将分子量分别为16.3kda和42kda的重组nv蛋白和重组m蛋白进行电泳、转膜,具体操作步骤同2。一抗用制备的感染hirrv的牙鲆血清、免疫hirrv的牙鲆血清、健康血清,二抗鼠抗牙鲆igm单克隆抗体2d8,37℃孵育60min,同上步洗涤后加入ap标记的羊抗鼠igg抗体,洗涤完成后,加入现配的nbt/bcip发色液,避光发色3-5min,观察到条带立即终止发色。结果显示(图4),重组牙鲆弹状病毒nv蛋白只与感染hirrv的牙鲆血清发生反应,不与免疫灭火hirrv的牙鲆血清及健康牙鲆血清发生反应。m蛋白可与感染和免疫hirrv的牙鲆血清和均发生反应,不与健康牙鲆血清反应。
实施例2:牙鲆弹状病毒病感染态与免疫态快速诊断试纸的制备
1.鼠抗牙鲆igm单抗的腹水制备和纯化
从-80℃超低温冰箱中取出杂交瘤细胞株jf-igm-h,随后立即放入37℃水浴锅中,快速摇晃,使细胞在1min以内解冻。解冻后的细胞于200g,离心4min,无菌条件下弃上清。向冻存管中加入500μlgit培养基重悬细胞。方法同牙鲆弹状病毒m蛋白单克隆抗体制备。
2.胶体金标记鼠抗牙鲆igm单抗的制备
(1)胶体金的制备:量取20ml超纯水,倒进预先处理干净的烧杯中;加入浓度为1%的氯金酸溶液,使其终浓度为0.01%,每20ml超纯水中加入200ul的氯金酸溶液,盖好保鲜膜减少水分的蒸发;将烧杯放在磁力搅拌器上搅拌并且加热,当溶液开始沸腾后,迅速地加入300ul的浓度为1%的柠檬酸钠溶液;继续搅拌加热2-3min,此时可以观察到溶液颜色发生明显变化,由无色变为灰黑色,再变为紫红色,最后变成红色或橙红色,此时停止加热;继续保持搅拌3min,在室温下避光静置,进行冷却;根据反应前在烧杯处做的标记,加入超纯水,补足加热过程中蒸发掉的超纯水。冷却后,边搅拌边滴加0.1mol/l的k2co3溶液调ph值到8.2;用肉眼观察,品质优良的胶体金为清亮透明的红色液体,光线可以透过,表面无漂浮物并且溶液无混浊,于4℃保存。
(2)胶体金标记鼠抗牙鲆igm单抗的制备:1ml胶体金中加入18μg单抗为最适标记比例,取胶体金按此比例加入单抗,搅拌20min,静置10min。向20ml胶体金加入5ml的5%bsa,使bsa的终浓度为1%,继续搅拌15min,静置10min,4℃4000r/min离心20min,弃沉淀,取上清液,4℃13500r/min离心30min,留取沉淀,弃上清。沉淀用金标抗体洗涤液重悬,4℃13500r/min离心30min,弃上清。将胶体金进行10倍浓缩,沉淀用2ml的金标抗体保存液(含1%蔗糖,1%bsa,0.1%tween-20和0.02%叠氮钠的0.01mol/lpbs,ph7.4)中进行重悬,4℃保存,20ml胶体金最后获得2ml的金标抗体。
3.金标垫2的制备
将金标单抗液体均匀喷涂到玻璃纤维上,冷冻干燥,避光密封低温保存。
4.硝酸纤维素膜4的制备
用无菌pbs将重组纯化的nv蛋白和重组纯化的m蛋白浓度分别调整为2.0mg/ml和1.0mg/ml,用喷膜仪将浓度为2.0mg/ml的nv喷涂于硝酸纤维素膜上作为t1,将浓度为1.0mg/ml的m喷涂于硝酸纤维素膜上作为检测线t2,检测线t1、t2之间相距3mm;调整羊抗小鼠igg的浓度为250µg/ml,将其喷涂于硝酸纤维素膜上作为质控线8,质控线8和检测线t1相距10mm,质控线8靠近吸水垫4,检测线靠近样品垫1。将包被好的硝酸纤维素膜干燥后,于37℃封闭液(含2%bsa的0.01mol/lpbs,ph7.4)中浸泡60min,pbst漂洗,干燥。
5.本发明的牙鲆弹状病毒病感染态与免疫态快速诊断试纸的制作
戴上手套,在载体板5的一侧顺次粘贴上硝酸纤维素膜3、金标垫2、样品垫1和吸水垫4,组装成试纸板。其中硝酸纤维素膜3的上边缘重叠在吸水垫4下边缘之下,硝酸纤维素膜3下边缘重叠在金标垫2上边缘之下,样品垫1的上边缘重叠在金标垫2下边缘之上(如图5)。将组装的试纸板放入切条机槽内切割成3.7mm宽的试纸,装入包装卡壳,并密封于装有干燥剂的铝箔袋,即为本发明试纸。
实施例3:牙鲆弹状病毒病感染态与免疫态快速诊断试纸的检测方法
1.检测样品的制备
取患病牙鲆,从尾静脉采取1ml血液,血样室温静置1h后吸取上清,即为待测鱼血清;将血清稀释10倍,即为检测样品液。
2.牙鲆弹状病毒病血清学快速诊断试纸的应用
平放本发明试纸检测卡,向样品孔中滴加经过处理的检测样品液100μl,等待约10min,肉眼观察检测结果,根据检测线t1、t2显色情况来判断牙鲆患病情况。
3.结果判断
ⅰ:检测线t、t2和质控线都显现红色,为阳性结果,表明感染过牙鲆弹状病毒,存在牙鲆弹状病毒抗体。
ⅱ:检测线t1不显色,t2和质控线显现红色,结果表明牙鲆处于免疫牙鲆弹状病毒状态。
ⅲ:检测线t1和质控线显现红色,为阴性结果,表明不存在牙鲆弹状病毒抗体,但存在与抗原nv蛋白存在交叉反应的其他病原体的抗体。
ⅳ:只有质控线显现红色,为阴性结果,表明不存在牙鲆弹状病毒抗体。
ⅴ、ⅵ:检测线呈红色,质控线不呈红色或者检测线和质控线都不呈现红色,为无效结果,表明试纸失效或操作有问题(如图6)。
实施例4:牙鲆弹状病毒病感染态与免疫态快速诊断试纸的灵敏度、特异性、重复性、稳定性测试
1.灵敏度
将感染牙鲆弹状病毒的牙鲆血清用pbs进行梯度稀释(1:10、1:20、1:40、1:80、1:160、1:200),用试纸条进行检测。检测结果显示:稀释度为1:10、1:20、1:40、1:80、1:100的牙鲆血清使试纸条的检测线t1、t2和质控线处均出现红线(ⅰ-ⅵ),结果为阳性。稀释度为1:200的牙鲆血清只有质控线显色,结果为阴性(ⅶ)(如图7)。
将免疫牙鲆弹状病毒的牙鲆血清用pbs进行梯度稀释(1:10、1:20、1:40、1:80、1:100、1:200),用试纸条进行检测。检测结果显示:稀释度为1:10、1:20、1:40、1:80的牙鲆血清使试纸条的检测线t2和质控线处均出现红线(ⅰ-ⅵ),结果为阳性。稀释度为1:100,1:200的牙鲆血清只有质控线显色,结果为阴性(ⅶ)(如图8)。
2.特异性
选择7组样品,样品分别是牙鲆抗牙鲆弹状病毒(hirrv)血清、牙鲆抗抗传染性造血器官坏死病病毒(ihnv)血清、抗病毒性出血败血症病毒(vhsv)血清、牙鲆抗淋巴囊肿病毒(lcdv)血清、健康牙鲆血清、迟缓爱德华氏菌抗血清、鳗弧菌抗血清。
检测结果显示:第1组样品使t1、t2和质控线均显现十分明显的红色(ⅰ),第2、3组牙鲆抗传染性造血器官坏死病病毒(ihnv)血清、抗病毒性出血败血症病毒(vhsv)血清检测结果显现很浅的红色(ⅱ、ⅲ),第4-7组样品只有质控线显现红色(ⅳ-ⅶ)(如图9)。
3.重复性
用不同批次的试纸检测以上7组样品,每个批次试纸重复检测5次,结果无明显差异。
4.稳定性
将试纸放入室温与4℃下,每15天用试纸检测(1)中12组样品。结果表明:室温下保存时有效期为6个月,4℃下保存时有效期为12个月。
本领域的普通技术人员都会理解,在本发明的保护范围内,对于上述实施例进行修改、添加和替换都是可能的,其都没有超出本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!