鉴别蛋白质中的游离巯基的方法与流程
本发明总体涉及表征蛋白质中,特别是抗体中的游离巯基基团的系统和方法。
相关申请交叉引用
本申请要求2019年1月16日提交的美国临时专利申请no.62/792,994的权益和优先权,将其全文以引用方式并入。
背景技术:
在将单克隆抗体(mab)从候选药物开发为上市产品的过程中,可能会出现与稳定性、翻译后修饰或抗体的其他变化相关的问题。抗体结构和功能的改变可导致问题,诸如保质期差或甚至在患者中的免疫原性差。因此,正确表征抗体结构并在整个生产过程中对其进行监测很重要。抗体质量控制和质量保证对于mab产品的纯度和安全性至关重要。
二硫键对于mab的结构完整性、稳定性和生物学功能很重要。非原生的二硫键可导致mab的结构和稳定性发生变化。如果二硫键不完全,mab与抗原的结合亲和力可受到高达50%的影响(xiang,t.等人,analchem,81:8101-8108(2009))。二硫键的低解离能和铰链区的高柔性经常导致在铰链区处的修饰和裂解(moritz,b.和stracke,j.o.,electrophoresis,36:769-785(2017))。另外,给人施用带非原生二硫键的结构可能会触发不需要的免疫应答。因此分析二硫键对于mab的质量控制评估很重要。当前分析mab二硫键的方法既费时又费力。
因此,本发明的目的是提供表征抗体,特别是单克隆抗体中的二硫键的系统和方法。
另一个实施方案提供了鉴别蛋白质药物产品中的二硫键异质性的方法。
本发明的另一个目的是提供鉴别蛋白质(包括但不限于抗体)中的游离巯基的方法和组合物。
技术实现要素:
提供了鉴别游离巯基(也称为游离硫氢基)的组合物和方法。由于二硫键形成不完全或二硫键断裂,游离巯基可能存在于蛋白质(例如mab)中。游离巯基的存在可降低mab产品的热稳定性,以及影响其结构完整性、稳定性和生物学功能。因此在mab生产中表征游离巯基很重要。本文公开了鉴别蛋白质药物产品中的位点特异性游离巯基的方法。示例性的方法包括用鉴别游离巯基的标签和鉴别原生二硫键的标签标记肽并使用靶向ms2分析所述标签。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
一个实施方案提供了鉴别蛋白质例如抗体或其片段中游离巯基的存在的方法。用于鉴别蛋白质药物产品中的游离巯基的示例性方法包括以下步骤:用第一标记物标记含有所述蛋白质药物产品的样品,所述第一标记物含有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第一ms/ms报告子。可移除过量的标记物并使所述样品变性和还原。然后用第二标记物标记所述样品,所述第二标记物具有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第二ms/ms报告子。该方法包括将所述样品用酶消化并使用质谱法来分析所述样品,所述质谱法为例如超高效液相色谱串联质谱系统(uplc-ms2系统),该系统包括表面带电杂化颗粒柱(chargedsurfacehybridcolumn)和甲酸缓冲液流动相。接下来,该方法包括对所述第一ms/ms报告子和所述第二ms/ms报告子进行定量,其中所述第一ms/ms报告子的量与所述蛋白质药物产品中的游离巯基的量相关,而所述第二ms/ms报告子的量与所述蛋白质药物产品中的结合巯基的量相关。在一个实施方案中,第一ms/ms报告子的质量为128,第二ms/ms报告子的质量为131。所述蛋白质药物产品通常是抗体,例如单克隆抗体或嵌合抗体。游离巯基的存在可能是二硫键形成不完全或二硫键降解的结果。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
另一个实施方案提供了鉴别蛋白质药物产品中的二硫键异质性的方法,该方法包括以下步骤:用第一标记物标记含有所述蛋白质药物产品的样品,所述第一标记物含有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第一ms/ms报告子。可移除过量的标记物并使所述样品变性和还原。然后用第二标记物标记样品,所述第二标记物具有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第二ms/ms报告子。该方法包括将所述样品用酶消化并使用质谱法来分析样品,所述质谱法为例如超高效液相色谱串联质谱系统(uplc-ms2系统),该系统包括表面带电杂化颗粒柱和甲酸缓冲液流动相。接下来,该方法包括对所述第一ms/ms报告子和所述第二ms/ms报告子进行定量,其中所述第一ms/ms报告子的量与所述蛋白质药物产品中的游离巯基的量相关,而所述第二ms/ms报告子的量与所述蛋白质药物产品中的结合巯基的量相关。如果该测定法检测到蛋白质药物产品中的游离巯基,则该蛋白质药物产品含二硫键异质性。这些游离巯基的存在可能是二硫键形成不完全或二硫键降解的结果。在一个实施方案中,第一ms/ms报告子的质量为128,第二ms/ms报告子的质量为131。蛋白质药物产品通常是抗体,例如单克隆抗体、嵌合抗体、双特异性抗体或其抗原结合片段。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
用于选择蛋白质药物产品的方法包括以下步骤:用第一标记物标记含有所述蛋白质药物产品的样品,所述第一标记物含有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第一ms/ms报告子。可移除过量的标记物并使所述样品变性和还原。然后用第二标记物标记所述样品,所述第二标记物具有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第二ms/ms报告子。该方法包括将所述样品用酶消化并使用超高效液相色谱串联质谱系统(uplc-ms2系统)来分析所述样品,该系统包括表面带电杂化颗粒柱和甲酸缓冲液流动相。接下来,该方法包括对所述第一ms/ms报告子和所述第二ms/ms报告子进行定量,其中所述第一ms/ms报告子的量与所述蛋白质药物产品中的游离巯基的量相关,而所述第二ms/ms报告子的量与所述蛋白质药物产品中的结合巯基的量相关。如果检测到游离巯基,则该蛋白质药物产品具有二硫键异质性。该方法包括选择不显示二硫键异质性的蛋白质药物产品。在一个实施方案中,第一ms/ms报告子的质量为128,第二ms/ms报告子的质量为131。蛋白质药物产品通常是抗体,例如单克隆抗体、嵌合抗体、或双特异性抗体、或其抗原结合片段。另一个实施方案提供了药物组合物,该药物组合物含有使用上述方法选择的蛋白质药物产品。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
附图说明
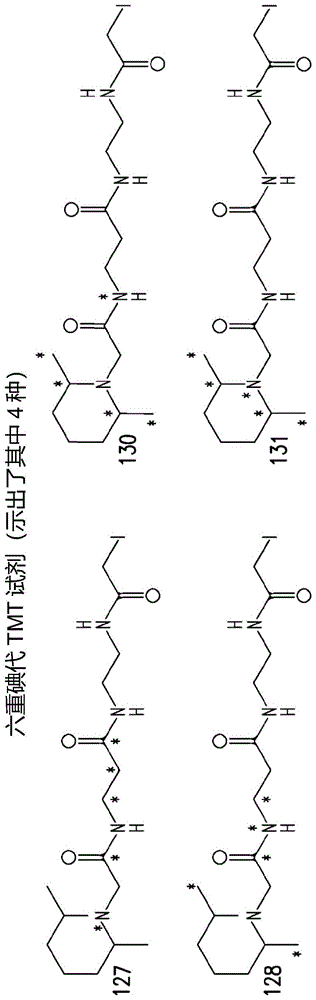
图1a是四种六重碘代tmt(iodotmtsixplex)试剂的示意图。
图1b是用碘代tmt标记物标记肽的示例性工作流程的示意图。
图2是使用靶向ms2分析碘代tmt标记的肽的示例性工作流程的示意图。
图3a-3b是碘代tmt标记的肽运行的ms2分析的谱图结果,含数据依赖的运行(图3a)或带包含列表的靶向ms2(图3b)。x轴代表时间,y轴代表相对丰度。
图4a-4b是碘代tmt标记的肽的ms2分析(特别是寻找tmt标签128/131)的谱图结果。图4a是完整的谱图,图4b是关于tmt标签128/131的放大图。x轴代表时间,y轴代表相对丰度。
图5a-5g是碘代tmt标记的肽的ms2分析的谱图结果,所述肽来自不同批次的抗体。x轴代表时间,y轴代表相对丰度。
图6是柱状图,示出了来自加标(spike-in)研究的各个半胱氨酸残基的相对丰度,在所述加标研究中将10%、5%、1%、0.5%或0.1%的蛋白质样品1添加到蛋白质样品2中。
图7是柱状图,示出了生产工艺a的抗体批次1-3和生产工艺b的抗体批次4-6中各个半胱氨酸二硫键对的相对丰度。二硫键对由连接两个半胱氨酸的曲线表示。
具体实施方式
i.定义
应当理解,本公开不限于本文描述的组合物和方法以及描述的实验条件,因为它们可能会有所不同。还应当理解本文所用的术语仅用于描述某些实施方案的目的,并且并非旨在进行限制,因为本公开的范围将仅由随附的权利要求书限制。
除非另外定义,否则本文使用的所有科技术语的含义与本公开所属领域的普通技术人员通常理解的一致。尽管与本文描述的那些相似或等同的任何组合物、方法和材料都可以用于本发明的实践或测试中。所提及的所有出版物均以引用的方式全文并入本文。
在描述当前要求权利保护的本发明的上下文中(特别是在权利要求的上下文中)使用术语“一个”、“一种”、“该(所述)”和类似指代应被解释为涵盖单数和复数,除非本文另有说明或明确与上下文相矛盾。
除非本文另有说明,否则本文中对数值范围的描述仅旨在用作单独提及落入该范围内的每个单独值的缩略方法,并且将每个单独的值并入本说明书中,就如同其在本文中单独引用一样。
术语“约”的使用旨在描述在大约+/-10%的范围内高于或低于所述值的值;在其它实施方案中,值的数值范围可以在大约+/-5%的范围内高于或低于所述值;在其它实施方案中,值的数值范围可以在大约+/-2%的范围内高于或低于所述值;在其它实施方案中,值的数值范围可以在大约+/-1%的范围内高于或低于所述值。前面的范围旨在通过上下文解释清楚,并且不暗示进一步的限制。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。除非另有说明,否则本文提供的任何和所有实例或示例性语言(如“诸如”)的使用仅旨在更好地说明本发明,而不是对本发明的范围进行限制。说明书中的任何语言都不应被解释为表明任何未要求权利保护的要素对于本发明的实施是必不可少的。
“蛋白质”是指包含通过肽键彼此连接的两个或更多个氨基酸残基的分子。蛋白质包括多肽和肽,并且可还包括修饰,诸如糖基化、脂质连接、硫酸化、谷氨酸残基的γ羧化、烷基化、羟基化和adp-核糖基化。蛋白质可以具有科学价值或商业价值,包括基于蛋白质的药物,并且蛋白质尤其包括酶、配体、受体、抗体和嵌合蛋白或融合蛋白。蛋白质是使用众所周知的细胞培养方法通过各种类型的重组细胞产生的,并且通常通过基因工程技术(例如,诸如编码嵌合蛋白的序列,或者密码子优化的序列、无内含子序列等)引入细胞中,其中其可以作为附加体存在或整合到细胞基因组中。
“抗体”是指由通过二硫键相互连接的四条多肽链(两条重链(h)和两条轻链(l))组成的免疫球蛋白分子。每条重链具有重链可变区(hcvr或vh)和重链恒定区。重链恒定区含有三个结构域即ch1、ch2和ch3。每条轻链具有轻链可变区和轻链恒定区。轻链恒定区由一个结构域(cl)组成。vh区和vl区可以进一步细分为高变区,称为互补决定区(cdr),散布有更保守的称为框架区(fr)的区域。每个vh和vl由三个cdr和四个fr组成,从氨基末端到羧基末端按照以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。术语“抗体”包括指任何同种型或亚型的糖基化和非糖基化免疫球蛋白。术语“抗体”包括通过重组手段制备、表达、产生或分离的抗体分子,诸如从经转染以表达抗体的宿主细胞分离的抗体。术语抗体也包括双特异性抗体,其包括可结合至不止一个不同表位的异四聚免疫球蛋白。双特异性抗体在美国专利no.8,586,713中进行了一般性描述,该专利申请以引用方式并入本申请中。
“铰链区”是指igg和iga免疫球蛋白类型的重链的中心部分中的柔性氨基酸链段,其通过二硫键连接这两条链。在igg免疫球蛋白中,铰链区位于ch1和ch3恒定结构域之间。铰链区为抗体提供了柔性,并使与抗原的结合更容易。
“fc融合蛋白”包含在自然界中原本不在一起的两种或更多种蛋白质的一部分或全部,其中一种是免疫球蛋白分子的fc部分。已经描述了包含与抗体衍生的多肽的各个部分(包括fc结构域)融合的某些异源多肽的融合蛋白的制备,例如由以下进行了描述:rath,t.等人,critrevbiotech,35(2):235-254(2015);levin,d.等人,trendsbiotechnol,33(1):27-34(2015)。“受体fc融合蛋白”包含与fc部分偶联的受体的一个或多个胞外结构域,在一些实施方案中,所述fc部分包含免疫球蛋白的铰链区、随后的ch2和ch3结构域。在一些实施方案中,fc融合蛋白包含可结合至一种或多种配体的两条或更多条独特的受体链。例如,fc融合蛋白是陷阱蛋白(trap),诸如il-1陷阱蛋白或vegf陷阱蛋白。
术语“二硫键”是指通过两个各自连接至半胱氨酸的sh基团的氧化而形成的键。二硫键在许多蛋白质的折叠和稳定性中起着重要作用。igg包括通过总共16个分子间或分子内二硫键共价连接的两条重链(hc)和两条轻链(lc)。iggmab含有32个半胱氨酸残基,每条lc上5个半胱氨酸残基,每条hc上11个半胱氨酸残基。每条lc含有具有二硫键连接的一个可变结构域和一个恒定结构域。lc上的第5个半胱氨酸连接至hc的第3个或第5个半胱氨酸以形成链间二硫键。重链包括一n端可变结构域(vh)和三个恒定结构域(ch1、ch2和ch3),在ch1与ch2之间具有铰链区(vidarsson,g.等人,frontimmunol,5:520(2014))。每条hc上的第6个和第7个半胱氨酸键合从而形成铰链区。免疫球蛋白的铰链区有助于形成免疫球蛋白分子的y形结构。y形使得免疫球蛋白分子的抗原结合所需的柔性成为可能。
术语“lc-ms”是指液相色谱–质谱,其是将液相色谱(或hplc)的物理分离能力与质谱(ms)的质量分析能力相结合的分析化学技术。术语ms/ms或ms2是指串联质谱。
术语“游离巯基”和“游离硫氢基”可互换使用。
ii.鉴别游离巯基的方法
提供了鉴别蛋白质(包括但不限于抗体)中的游离巯基的方法。巯基或硫氢基通常是指含有-sh基团的有机化合物。在蛋白质中,任何两个紧邻的半胱氨酸都将会形成共价键,即使不是天然配对在一起的半胱氨酸也是如此。两个半胱氨酸之间的这种共价键称为二硫键。二硫键对于igg的三级结构、稳定性和生物学功能至关重要。游离巯基或游离硫氢基是指蛋白质中不是二硫键的一部分的半胱氨酸,并且可以指示蛋白质中不正确的结构形成,这可能对蛋白质药物的效价、半衰期、稳定性产生不利影响,或者使蛋白质药物无效。游离硫氢基(也称为游离巯基)也可能由于二硫键形成不完全或二硫键降解而出现。游离硫氢基增加可导致较低的热稳定性,并可影响抗体与抗原的结合亲和力,最高可达50%。本文公开的是鉴别游离硫氢基或游离巯基的方法。
a.鉴别位点特异性游离巯基的方法
由于二硫键形成不完全或二硫键断裂,mab中可存在游离巯基。游离巯基的存在会降低mab产品的热稳定性,以及影响其结构完整性、稳定性和生物学功能。因此,在mab生产中表征游离巯基很重要。本文公开了用于鉴别蛋白质药物产品中的位点特异性游离巯基的方法。示例性方法包括用鉴别游离巯基的标签和鉴别原生二硫键的标签标记肽并使用靶向ms2分析所述标签。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
一个实施方案提供了用于鉴别蛋白质例如抗体或其片段中游离巯基的存在的方法。用于鉴别蛋白质药物产品中的游离巯基的示例性方法包括以下步骤:用第一标记物标记含有蛋白质药物产品的样品,所述第一标记物含有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第一ms/ms报告子。可移除过量的标记物并使所述样品变性和还原。然后用第二标记物标记样品,所述第二标记物具有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第二ms/ms报告子。该方法包括将样品用酶消化并使用质谱法来分析样品,所述质谱法为例如超高效液相色谱串联质谱系统(uplc-ms2系统),该系统包括表面带电杂化颗粒柱和甲酸缓冲液流动相。接下来,该方法包括对第一ms/ms报告子和第二ms/ms报告子进行定量,其中第一ms/ms报告子的量与蛋白质药物产品中的游离巯基的量相关,而第二ms/ms报告子的量与蛋白质药物产品中的结合巯基的量相关。在一个实施方案中,第一ms/ms报告子的质量为128,第二ms/ms报告子的质量为131。所述蛋白质药物产品通常是抗体,例如单克隆抗体或嵌合抗体。游离巯基的存在可能是二硫键形成不完全或二硫键降解的结果。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
另一个实施方案提供了鉴别蛋白质药物产品中的二硫键异质性的方法,该方法包括以下步骤:用第一标记物标记含有蛋白质药物产品的样品,所述第一标记物含有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第一ms/ms报告子。可移除过量的标记物并使所述样品变性和还原。然后用第二标记物标记样品,所述第二标记物具有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第二ms/ms报告子。该方法包括将样品用酶消化并使用质谱法来分析样品,所述质谱法为例如超高效液相色谱串联质谱系统(uplc-ms2系统),该系统包括表面带电杂化颗粒柱和甲酸缓冲液流动相。接下来,该方法包括对第一ms/ms报告子和第二ms/ms报告子进行定量,其中第一ms/ms报告子的量与蛋白质药物产品中的游离巯基的量相关,而第二ms/ms报告子的量与蛋白质药物产品中的结合巯基的量相关。如果该测定法检测到蛋白质药物产品中的游离巯基,则该蛋白质药物产品含二硫键异质性。这些游离巯基的存在可能是二硫键形成不完全或二硫键降解的结果。在一个实施方案中,第一ms/ms报告子的质量为128,第二ms/ms报告子的质量为131。蛋白质药物产品通常是抗体,例如单克隆抗体、嵌合抗体、双特异性抗体或其抗原结合片段。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
用于选择蛋白质药物产品的方法包括以下步骤:用第一标记物标记含有蛋白质药物产品的样品,所述第一标记物含有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第一ms/ms报告子。可移除过量的标记物并使所述样品变性和还原。然后用第二标记物标记样品,所述第二标记物具有硫氢基反应性碘代乙酰基基团、ms中性间隔臂和具有独特报告子离子质量的第二ms/ms报告子。该方法包括将样品用酶消化并使用超高效液相色谱串联质谱系统(uplc-ms2系统)来分析样品,该系统包括表面带电杂化颗粒柱和甲酸缓冲液流动相。接下来,该方法包括对第一ms/ms报告子和第二ms/ms报告子进行定量,其中第一ms/ms报告子的量与蛋白质药物产品中的游离巯基的量相关,而第二ms/ms报告子的量与蛋白质药物产品中的结合巯基的量相关。如果检测到游离巯基,则该蛋白质药物产品具有二硫键异质性。该方法包括选择不显示二硫键异质性的蛋白质药物产品。在另一个实施方案中,所选择的蛋白质药物产品是含有少于5个游离巯基、少于4个游离巯基、少于3个游离巯基、少于2个游离巯基的igg。在一些实施方案中,游离巯基是在igg分子的轻链中。在一些实施方案中,游离巯基是在igg分子的重链中。在一些实施方案中,在igg分子的轻链中存在至少一个游离巯基,并且在igg分子的重链中存在至少一个游离巯基。在一个实施方案中,第一ms/ms报告子的质量为128,第二ms/ms报告子的质量为131。蛋白质药物产品通常是抗体,例如单克隆抗体、嵌合抗体、或双特异性抗体、或其抗原结合片段。另一个实施方案提供了药物组合物,该药物组合物含有使用上述方法选择的蛋白质药物产品。在一个实施方案中,该方法提供对igg分子中所有32个半胱氨酸残基的完全覆盖。在其他实施方案中,该方法覆盖igg分子中的重链和轻链上的16个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条轻链上的5个半胱氨酸残基。在另一个实施方案中,该方法覆盖igg分子的每条重链上的11个半胱氨酸残基。
1.碘代乙酰基标签
在一个实施方案中,可以用标签标记肽以鉴别原生二硫键和游离巯基残基。标签可以是标记含半胱氨酸的肽的碘代乙酰基标签。示例性的标签包括但不限于thermoscientifictmiodoacetyltandemmasstagtm(碘代乙酰基串联质量标签)(iodotmttm)。碘代乙酰基标签不可逆地标记半胱氨酸残基上的游离巯基。该标签包括硫氢基反应性碘代乙酰基基团、质量标准化基团(massnormalizer)臂和ms/ms报告子。由13c和15n组合组成的总共五个同位素原子被掺入到每种试剂中的质量标准化基团臂和ms/ms报告子区域,但分布在不同的位置,如图1a中的星号所标记的。因此,每种试剂具有相同的标称母体质量,但ms/ms报告子区域的质量却独特,其可以在ms/ms谱图上区分:127da、128da、130da和131da。在一个实施方案中,用质量为126、127、128、129、130或131da的标记物给游离巯基加标签。在另一个实施方案中,用质量不同于用于检测游离巯基的质量标记物的标记物给原生二硫键加标签。非限制性实例包括用质量为127da的标记物给游离巯基加标签和用质量为130da的标记物给原生二硫键加标签。
图1b中提供了示例性的工作流程。在一个实施方案中,将肽样品的等分试样与第一标签混合并温育。可以将过量的试剂从样品中移除,并且可使样品变性和还原。在一个实施方案中,在使样品变性之后将第二质量标签添加至该样品。可在添加第二标签后用酶消化样品。上面论述了酶消化的示例性方法。在另一个实施方案中,可将两种样品加在一起,然后进一步分析。在一些实施方案中,在一次运行中可分析最多三对标签。
2.ms/ms
在一个实施方案中,使用质谱法,例如超高效液相色谱法(uplc)-ms/ms,对碘代乙酰基标签标记的肽进行分析。在一个实施方案中,在亚乙基桥杂化颗粒(beh)柱或表面带电杂化颗粒(csh)柱上进行uplc。缓冲液可以是三氟乙酸(tfa)缓冲液或甲酸(fa)缓冲液。液相色谱可以运行约90分钟至约150分钟。应当理解,可以针对所分析的特定样品优化缓冲液和运行时间。在一些实施方案中,运行包括约40分钟的再平衡步骤。在一个优选的实施方案中,uplc在150mmcsh柱上使用fa缓冲液运行150分钟,再平衡步骤为40分钟。
使用uplc分离肽后,可以使用质谱法对其进行分析。在一优选的实施方案中,使用靶向ms2质谱法。质谱仪可以是例如thermoscientificqexactive混合四极杆
在一个实施方案中,将包含质量包括在ms2扫描中。例如,可以将关注的或关心的特定半胱氨酸的质量编程到包含列表中。在一个实施方案中,包含列表的使用可以更强烈地定量所关注的残基。在另一个实施方案中,将排除质量从ms2扫描中排除。例如,可以从扫描中排除已知稳定的或很少形成错接的键的特定半胱氨酸的质量。
c.所关注的蛋白质
在一个实施方案中,所关注的蛋白质是蛋白质药物产品或是适于在原核或真核细胞中表达的所关注的蛋白质。例如,所述蛋白质可以是抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、scfv或其片段、fc融合蛋白或其片段、生长因子或其片段、细胞因子或其片段、或细胞表面受体的胞外结构域或其片段。复合物中的蛋白质可为由单个亚基组成的简单多肽或为由两个或更多个亚基组成的复杂多亚基蛋白质。所关注的蛋白质可是生物医药产品、食品添加剂或防腐剂或任何受纯化和质量标准约束的蛋白质产品。
在一些实施方案中,所关注的蛋白质是抗体、人抗体、人源化抗体、嵌合抗体、单克隆抗体、多特异性抗体、双特异性抗体、抗原结合抗体片段、单链抗体、双链抗体、三链抗体或四链抗体、双特异性四价免疫球蛋白g样分子(称为双可变结构域免疫球蛋白(dvd-ig))、igd抗体、ige抗体、igm抗体、igg抗体、igg1抗体、igg2抗体、igg3抗体或igg4抗体。在一个实施方案中,抗体是igg1抗体。在一个实施方案中,抗体是igg2抗体。在一个实施方案中,抗体是igg4抗体。在另一个实施方案中,抗体包含嵌合铰链。在又其他实施方案中,抗体包含嵌合fc。在一个实施方案中,抗体是嵌合igg2/igg4抗体。在一个实施方案中,抗体是嵌合igg2/igg1抗体。在一个实施方案中,抗体是嵌合igg2/igg1/igg4抗体。
在一些实施方案中,该抗体选自抗程序化细胞死亡1抗体(例如,如美国专利申请公开no.us2015/0203579a1中所述的抗pd1抗体)、抗程序化细胞死亡配体1(例如,如美国专利申请公开no.us2015/0203580a1中所述的抗pd-l1抗体)、抗dll4抗体、抗血管生成素2抗体(例如,如美国专利no.9,402,898中所述的抗ang2抗体)、抗血管生成素样3抗体(例如,如美国专利no.9,018,356中所述的抗angptl3抗体)、抗血小板衍生生长因子受体抗体(例如,如美国专利no.9,265,827中所述的抗pdgfr抗体)、抗erb3抗体、抗催乳素受体抗体(例如,如美国专利no.9,302,015中所述的抗prlr抗体)、抗补体5抗体(例如,如美国专利申请公开no.us2015/0313194a1中所述的抗c5抗体)、抗tnf抗体、抗表皮生长因子受体抗体(例如,如美国专利no.9,132,192中所述的抗egfr抗体或如美国专利申请公开no.us2015/0259423a1中所述的抗egfrviii抗体)、抗前蛋白转化酶枯草溶菌素kexin-9抗体(例如,如美国专利no.8,062,640或美国专利no.9,540,449中所述的抗pcsk9抗体)、抗生长和分化因子8抗体(例如,抗gdf8抗体,也称为抗肌生长抑制素抗体,如美国专利no.8,871,209或no.9,260,515中所述)、抗胰高血糖素受体(例如,如美国专利申请公开no.us2015/0337045a1或no.us2016/0075778a1中所述的抗gcgr抗体)、抗vegf抗体、抗il1r抗体、白介素4受体抗体(例如,如美国专利申请公开no.us2014/0271681a1或美国专利no.8,735,095或no.8,945,559中所述的抗il4r抗体)、抗白介素6受体抗体(例如,如美国专利no.7,582,298、no.8,043,617或no.9,173,880中所述的抗il6r抗体)、抗il1抗体、抗il2抗体、抗il3抗体、抗il4抗体、抗il5抗体、抗il6抗体、抗il7抗体、抗白介素33(例如,如美国专利no.9,453,072或no.9,637,535中所述的抗il33抗体)、抗呼吸道合胞病毒抗体(例如,如美国专利申请公开no.9,447,173中所述的抗rsv抗体)、抗分化簇3(例如,如在美国专利no.9,447,173和no.9,447,173以及在美国申请no.62/222,605中所述的抗cd3抗体)、抗分化簇20(例如,如美国专利no.9,657,102和no.us20150266966a1以及在美国专利no.7,879,984中所述的抗cd20抗体)、抗cd19抗体、抗cd28抗体、抗分化簇48(例如,如美国专利no.9,228,014中所述的抗cd48抗体)、抗feld1抗体(例如,如美国专利no.9,079,948中所述的)、抗中东呼吸综合征病毒(例如,如美国专利申请公开no.us2015/0337029a1中所述抗mers抗体)、抗埃博拉病毒抗体(例如,如美国专利申请公开no.us2016/0215040中所述的)、抗寨卡病毒抗体、抗淋巴细胞活化基因3抗体(例如,抗lag3抗体或抗cd223抗体)、抗神经生长因子抗体(例如,如美国专利申请公开no.us2016/0017029以及美国专利no.8,309,088和no.9,353,176中所述的抗ngf抗体)和抗蛋白y抗体。在一些实施方案中,双特异性抗体选自抗cd3×抗cd20双特异性抗体(如美国专利申请公开no.us2014/0088295a1和no.us20150266966a1中所述的)、抗cd3×抗粘蛋白16双特异性抗体(例如,抗cd3×抗muc16双特异性抗体)和抗cd3×抗前列腺特异性膜抗原双特异性抗体(例如,抗cd3×抗psma双特异性抗体)。在一些实施方案中,所关注的蛋白质选自阿昔单抗(abciximab)、阿达木单抗(adalimumab)、阿达木单抗-atto(adalimumab-atto)、ado-曲妥珠单抗(ado-trastuzumab)、阿仑单抗(alemtuzumab)、阿利库单抗(alirocumab)、阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)、巴利昔单抗(basiliximab)、贝利木单抗(belimumab)、贝那利珠单抗(benralizumab)、贝伐珠单抗(bevacizumab)、贝洛托单抗(bezlotoxumab)、博纳吐单抗(blinatumomab)、本妥昔单抗(brentuximabvedotin)、布罗达单抗(brodalumab)、康纳单抗(canakinumab)、卡罗单抗喷地肽(capromabpendetide)、peg化塞妥珠单抗(certolizumabpegol)、西米普利单抗(cemiplimab)、西妥昔单抗(cetuximab)、地诺单抗(denosumab)、地努妥昔单抗(dinutuximab)、度匹鲁单抗(dupilumab)、得瓦鲁单抗(durvalumab)、依库珠单抗(eculizumab)、埃罗妥珠单抗(elotuzumab)、艾米希组单抗(emicizumab-kxwh)、厄塔毒素-阿利珠单抗偶联物(emtansinealirocumab)、依维库人单抗(evinacumab)、依洛尤单抗(evolocumab)、fasinumab单抗(fasinumab)、戈利木单抗(golimumab)、塞库单抗(guselkumab)、替伊莫单抗(ibritumomabtiuxetan)、依达赛珠单抗(idarucizumab)、英夫利昔单抗(infliximab)、英夫利昔单抗-abda(infliximab-abda)、英夫利昔单抗-dyyb(infliximab-dyyb)、伊匹单抗(ipilimumab)、伊西贝单抗(ixekizumab)、美泊利单抗(mepolizumab)、耐昔妥珠单抗(necitumumab)、雷珠单抗(nesvacumab)、纳武单抗(nivolumab)、奥必托昔单抗(obiltoxaximab)、奥滨尤妥珠单抗(obinutuzumab)、奥瑞珠单抗(ocrelizumab)、奥法木单抗(ofatumumab)、奥拉单抗(olaratumab)、奥马珠单抗(omalizumab)、帕尼单抗(panitumumab)、派姆单抗(pembrolizumab)、帕妥珠单抗(pertuzumab)、雷莫芦单抗(ramucirumab)、兰尼单抗(ranibizumab)、瑞西巴库单抗(raxibacumab)、瑞利珠单抗(reslizumab)、利努单抗(rinucumab)、利妥昔单抗(rituximab)、沙利鲁单抗(sarilumab)、塞库单抗(secukinumab)、西妥昔单抗(siltuximab)、塔西单抗(tocilizumab)、塔西单抗(tocilizumab)、曲妥珠单抗(trastuzumab)、特伐单抗(trevogrumab)、乌司他单抗(ustekinumab)和维多珠单抗(vedolizumab)。
在一些实施方案中,所关注的蛋白质是含有fc部分和另一个结构域的重组蛋白质(例如fc融合蛋白)。在一些实施方案中,fc融合蛋白是受体fc融合蛋白,其含有与fc部分偶联的受体的一个或多个胞外结构域。在一些实施方案中,fc部分包含igg的铰链区、随后的ch2和ch3结构域。在一些实施方案中,受体fc融合蛋白含有可结合至单种配体或多种配体的两条或更多条独特的受体链。例如,fc融合蛋白是陷阱蛋白,诸如例如il-1陷阱蛋白(例如,rilonacept,其含有与融合至higg1的fc的il-1r1胞外区融合的il-1racp配体结合区;参见美国专利no.6,927,004,该专利全文以引用的方式并入本文)或vegf陷阱蛋白(例如,aflibercept或ziv-aflibercept,其包含与融合至higg1的fc的vegf受体flk1的ig结构域3融合的vegf受体flt1的ig结构域2;参见美国专利no.7,087,411和no.7,279,159)。在其他实施方案中,fc融合蛋白是scfv-fc融合蛋白,其含有与fc部分偶联的抗体的一个或多个抗原结合结构域(诸如可变重链片段和可变轻链片段)中的一者或多者。
d.生产具有极少或没有二硫键异质性的mab
一个实施方案提供了生产含有很少或不含游离巯基的蛋白质药物产品的方法。一种示例性的方法包括:在合适的条件下在细胞培养物中培养产生抗体的细胞以产生抗体;在合适的条件下纯化抗体以提取抗体;在合适的条件下将抗体与赋形剂混合以稳定抗体;从细胞培养物获得抗体的样品、在从细胞培养物纯化抗体后获得抗体的样品、或在将赋形剂添加至经纯化抗体后获得抗体的样品;根据所公开的方法表征抗体的二硫键;以及修饰一种或多种细胞培养、纯化或赋形剂条件以减少抗体的交叉的铰链二硫键的数量。
待改变以减少抗体中游离巯基的量的一种或多种细胞培养、纯化或赋形剂条件包括但不限于温度、ph、氧水平、反应性氧物质、表面活性剂或它们的组合。在一个实施方案中,无氨基酸的细胞培养策略可影响二硫键形成。
在一个实施方案中,产生抗体的细胞是中国仓鼠卵巢细胞。在另一个实施方案中,细胞是杂交瘤细胞。在一个实施方案中,蛋白质药物产品是igg单克隆抗体或其片段。
在一个实施方案中,蛋白质药物产品不含游离巯基。在另一个实施方案中,蛋白质药物产品在igg分子中含有少于5个游离巯基、少于4个游离巯基、少于3个游离巯基、少于2个游离巯基。在一些实施方案中,游离巯基是在igg分子的轻链中。在一些实施方案中,游离巯基是在igg分子的重链中。在一些实施方案中,在igg分子的轻链中存在至少一个游离巯基,并且在igg分子的重链中存在至少一个游离巯基。
实施例
实施例1:位点特异性游离巯基的分析
方法
半胱氨酸标记
遵循图1b的工作流程。简而言之,用碘代-tmt试剂(图1a)标记对照样品和抗体样品。移除过量的试剂,用0.5mtcep使样品变性和还原并温育1小时。变性和还原后,将第二标记物添加至样品中。然后将样品合并,用酶消化并使用uplc-ms/ms进行分析。uplc条件如下:将样品在150mmcsh柱上运行150分钟,包括40分钟的再平衡步骤。使用fa缓冲液。
加标研究
对于加标研究,准备了相同蛋白质的两种不同样品的等分试样。使用guanhcl使蛋白质变性并还原。用两种不同的碘代tmt标签标记样品。然后准备加标浓度梯度。将10%、5%、1%、0.5%或0.1%的蛋白质样品1添加至蛋白质样品2的等分试样中。然后用酶消化样品并使用uplc/ms-ms进行分析(图2)。
结果:
表1示出了对用碘代-tmt标签标记的regeneron抗体进行靶向ms2分析以鉴别位点特异性的游离巯基的结果。如表中所见,鉴别了全部十六个半胱氨酸残基。
图3a-3b示出了针对同一样品的数据依赖型ms2运行与靶向ms2运行(带包含列表)的比较。如图所示,使用特定半胱氨酸的包含列表的靶向ms2运行可以帮助更强烈地定量特定的半胱氨酸残基。另外,将碘代-tmt标签与靶向ms2结合使用使得能更好地分离标记的半胱氨酸。图4a-4b示出了128da标记的半胱氨酸和131da标记的半胱氨酸的清晰分离。所公开的方法具有非常清晰的分离,而无需担心当前方法(诸如标记的iaa方法)中所见的重叠的同位素模式。
为了进一步显示所公开方法的实用性,比较了不同批次的相同抗体产品。图5a-5g示出了不同批次的相同抗体中游离巯基和成二硫键的半胱氨酸的相对丰度。
使用加标研究对方法进行了额外的验证。将各种百分比的标记的蛋白样品1添加至标记的蛋白样品2中。图6示出了“加标”研究的结果。大多数半胱氨酸显示出预期的游离巯基量,该预期量可以通过掺入到蛋白质样品2中的蛋白质样品1的量来预测,从而表明该方法可有效预测游离巯基的相对丰度。
表1.靶向ms2结果
表2汇总了regeneron抗体产品的游离巯基和二硫键丰度的结果。对每个半胱氨酸位点计算位点特异性游离巯基的百分比。鉴别并定量了全部十六个半胱氨酸。设定阈值为5%-6%游离巯基,低于该阈值的任何值都不会显示出二硫键断裂的可能性。图7示出了不同批次的regeneron抗体产品中的二硫键对的相对丰度。
所公开的方法和结果可用于位点特异性的总游离巯基定量,并且可用作二硫键错接位置的潜在指示。另外,其可用于鉴别导致半分子或聚集体的链内二硫键。
表2.工艺可比性.
尽管在前面的说明书中已关于本发明的某些实施方案描述了本发明,并且出于说明的目的已经提出了许多细节,但是对于本领域技术人员来说显而易见的是,本发明容易受其他实施方案的影响,并且在不脱离本发明的基本原理的情况下,本文所述的某些细节可以进行相当大的改变。
本文引用的所有参考文献均以引用的方式全文并入本文。在不脱离本发明的`精神或本质属性的情况下,本发明可以以其他特定形式来体现,并且因此,应参考所附权利要求,而不是前述说明书,来指示本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!