嵌合蛋白和筛选与GPCR结合的化合物和配体的方法与流程
嵌合蛋白和筛选与gpcr结合的化合物和配体的方法
1.本发明涉及可用于发现和开发与gpcr结合的化合物和配体的嵌合蛋白。
2.本发明还涉及其中使用所述嵌合蛋白的方法和装置。
3.特别地,本发明涉及可用于鉴定可与gpcr结合的化合物和配体的嵌合蛋白、方法和装置,以及可用于测试可与gpcr结合的配体的嵌合蛋白、方法和装置。
4.本发明提供的筛选和测定技术可特别用于鉴定、产生、优化和/或开发可结合gpcr并且可用作和/或开发成治疗剂、预防剂和诊断剂的化合物和配体。如本文进一步描述的,此类化合物或配体可以是任何所需和/或合适的化合物或配体,包括但不限于小分子、小肽、生物分子或其他化学实体,并且基于本文的进一步公开此类化合物的实例对技术人员而言是清楚的。
5.例如,使用本发明的嵌合蛋白、方法和装置鉴定和/或产生的小分子或分子片段(即来自此类筛选的“命中”)可用作进一步药物发现和开发努力的起点(例如,使用公知的所谓“命中至先导(hits-to-leads)”化学技术),并且这种进一步的努力还可以涉及使用测定(例如功能测定或用于质量控制目的的测定),其中使用本发明的嵌合蛋白。使用本发明的方法和技术鉴定的化合物(即作为“命中”),以及使用此类命中作为起点产生或开发的任何化合物,在本文中也统称为“本发明的化合物”并形成本发明的进一步方面。技术人员将清楚,此类化合物可以是例如所谓的“命中”、“先导”、“开发候选物”、“临床前化合物”、“临床候选物”或商业化合物或产品,这取决于它们的发展阶段以及开发和/或商业化它们的公司或实体使用的特定术语。
6.此外,如本文进一步描述的,本发明的方法和测定可允许鉴定和/或表征变构激动剂、拮抗剂和/或反向激动剂(取决于所使用的特定靶标和测定)。
7.本发明的其他特征、方面、实施方案、用途和优点将从本文的进一步描述中变得清楚。
8.gpcr的测定和筛选技术是本领域公知的。据估计,超过一半的现代药物靶向膜蛋白,大约三分之一的现代药物靶向gpcr。参考标准手册以及本文引用的其他现有技术。/在这方面,应该注意的是,一般在该领域内,术语“7tm受体”和“7tm”经常与“gpcr”互换使用,尽管根据iuphar数据库,有一些7tm受体没有通过g蛋白发信号。出于本说明书和权利要求的目的,术语“gpcr”和“7tm”在本文中可互换使用以包括具有7个跨膜结构域的所有跨膜蛋白(尤其是跨膜受体),而不管它们的细胞内信号传导级联或信号转导机制,尽管在整个说明书和权利要求中应该理解,通过g蛋白发信号的7tm是本发明的优选方面]。
9.正如众所周知的那样,gpcr不是其功能仅由它们的一级、二级或三级结构决定的静态物体,但通常是可以在不同构象状态之间经历转变(也称为“构象变化”)的柔性结构,使得gpcr可以在这些不同状态之间平衡存在。这些状态中的一些可能是功能性的和/或活性的,而另一些可能是基础状态(可能会或可能不会展示出一定水平的组成型活性)、是基本上无活性状态和/或与更多功能性或活性状态相比是活性较低的状态。此外,可能存在于gpcr中或gpcr上的不同表位、结合位点(包括配体结合位点)和/或催化位点的几何学在这些不同构象之间可能不同,例如使得在一些构象状态中,结合位点可能不可用于配体结合/
对于配体结合是不可及的,和/或使得与活性较高的构象状态相比,结合位点和相关配体之间相互作用的亲和力降低。
10.还已知配体与gpcr的结合能够改变其构象(例如从无活性/活性较低的构象变为有活性的/活性较高的构象)和/或将其平衡从无活性/活性较低的构象转移至有活性的/活性较高的构象。配体与gpcr的一个结合位点的结合也可能使gpcr上的另一结合位点对于其相关配体更可及,和/或可能导致所述其他结合位点对于所述配体的亲和力增加,和/或将平衡从其中所述其他结合位点对所述配体具有较低亲和力的构象转移至其中所述其他结合位点对所述配体具有更好亲和力的构象。例如,细胞外配体与gpcr上的细胞外结合位点的结合可能会导致细胞质侧上的的构象变化,该构象变化例如可能会增加细胞内结合位点对细胞内配体的亲和力(例如,增加g-蛋白和g蛋白结合位点之间相互作用的亲和力),反之亦然。细胞外配体结合后对细胞间配体的结合亲和力的这种变化,以及随后细胞内配体与细胞内结合位点的结合,是gpcr转导细胞外信号的机制的一部分。
11.通常,如本文进一步描述的,可以说对于gpcr,gpcr的“激动剂”将构象平衡从无活性状态(或一种或多种活性较低的状态)转移至活性状态(或一种或多种活性较高的状态),而gpcr的“反向激动剂”将相反。
12.不限于任何特定的假设或机制,也假设gpcr与细胞外配体(与gpcr上的细胞外结合位点结合)和细胞内配体(与gpcr上的细胞内结合位点结合)形成复合体,并且gpcr与每个配体之间的相互作用通过另一配体的结合而稳定(换句话说,所述复合体通过两个配体的结合而稳定)。同样,在这种情况下,一个或两个配体的结合也可能使gpcr的构象平衡转移至该复合体(的形成和/或稳定)。例如参考以下引用的wo2012/007593。
13.鉴于gpcr的感知“整体”状态在很大程度上受gpcr在其各种可能构象上的(统计学)分布控制,并且因此受这些构象状态之间存在的平衡控制,应该理解的是在本说明书或权利要求中,当称gpcr经历构象变化至某种构象(即从一种或多种其他构象)时,这将包括gpcr的构象平衡向所述构象转移(即在所使用的特定条件下,例如用于筛选或相关测定的条件)的机制或情况。类似地,当据说配体引发gpcr的构象变化至某种构象(即从一个或多个其他构象)时,这包括其中配体的结合使蛋白质的构象平衡向所述构象转移(即在所使用的特定条件下,例如用于筛选或相关测定的条件)的机制或情况。
14.然而,还应注意的是,尽管本文描述的任何一种机制(或其任何组合)可能在任何给定时间参与本发明的实践(也取决于,例如,应用本发明的特定gpcr和/或配体),本发明在最广泛的意义上不限于任何特定的机制、解释或假设,只要将本发明应用于特定的gpcr会产生本文概述的技术效果即可。
15.筛选针对gpcr的化合物的挑战之一是,如果gpcr在与其天然环境隔离的情况下表达或使用,则gpcr的正确构象可能会丢失(如果表达gpcr并确保其在细胞环境外部正确折叠甚至是可行的或可能的)。此外,在用于筛选的条件下确保gpcr处于其所需的构象(通常是功能性构象,例如其活性构象)可能具有挑战性。也可能需要或有利于实现gpcr的构象平衡向更适合筛选或测定目的的构象状态(例如活性状态或其中相关结合位点更可及和/或对于测定或筛选目的具有更优的几何形状的状态)的转移。如本文进一步描述的,这种构象也称为“可成药的”构象,并且根据本发明的优选方面,应用手段(如本文进一步描述的)以确保提供预期的gpcr的可成药形式。
16.例如,wo2012/007593,wo2012/007594,wo2012/175643,wo2014/118297,wo2014/122183和wo2014/118297涉及可用于稳定gpcr特定构象状态的蛋白质结合结构域,用于确定其结构以及用于药物筛选和发现目的。在这些参考文献中,使用vhh结构域可以将gpcr稳定在期望的构象,特别是(更)可成药的构象,例如功能性状态和/或活性状态,例如在激活配体(激动剂)与gpcr的细胞外侧结合从而使gpcr激活异源三聚体g蛋白时出现的构象。例如还参考了pardon等人,angew chem int ed engl.2018,57(19):5292-5295;che等人,cell.2018,172(1-2):55-67;manglik等人,annu rev pharmacol toxicol.2017;57:19-37;pardon等人,nat protoc.2014,674-93;kruse等人,nature,2013,504(7478);steyaert和kobilka,curr opin struct biol,2011,567-72;eglen和reisine,pharmaceuticals 2011,4,244-272;和rasmussen等人,nature,2011,469(7329):175-180以及其中引用的其他参考文献。可用于稳定膜蛋白如gpcr的期望构象的vhh结构域在本文中也称为confobody[confobody
tm
是confo therapeutics,ghent,belgium的注册商标]。
[0017]
能够与gpcr的细胞内表位结合并能够用于将gpcr稳定在所需构象(并且也可用于本发明)的confobody的一些具体但非限制性实例是称为ca2764,ca3431,ca3413,ca2780,ca2765,ca2761,ca3475,ca2770,ca3472,ca3420,ca3433,ca3434,ca3484,ca2760,ca2773,ca3477,ca2774,ca2768,ca3424,ca2767,ca2786,ca3422,ca2763,ca2772,ca2771,ca2769,ca2782,ca2783和ca2784的vhh(参见例如wo 2012/007593,表1和2和seq id no:1至29);称为ca5669,nb9-1,nb9-8,xa8633和ca4910的vhh(参见例如wo 2014/118297,表1和2和seq id no:15,16,17,19和20);称为nb9-11,nb9-7,nb9-7,nb9-22,nb9-17,nb9-24,nb9-9,nb9-14,nb9-2,nb9-20,nb_c3,nbh-4,nb-e1,nb_a2,nb_b4,nb_d3,nb_d1和nb_h1的vhh(参见例如wo 2014/122183,表1和2和seq id no:1-19);和称为xa8639,xa8635,xa8727和xa9644的vhh(参见例如wo 2015/121092,表2和3和seq id no:2至6和74)。
[0018]
能够与g蛋白结合的vhh的一些具体但非限制性实例是ca4435,ca4433,ca4436,ca4437,ca4440和ca4441(参见例如wo 2012/175643007593,表2和3以及seq id no:1至6).
[0019]
通常,在所述现有技术中描述的产生这种vhh的方法需要能够以合适的构象(即,针对要产生的vhh的构象)提供和使用所需的gpcr。这不仅适用于免疫目的(即生成免疫文库),也适用于选择和筛选的目的(其需要在用于筛选免疫文库的噬菌体、核糖体或其他展示系统上正确表达gpcr的所需构象),也用于使用原始的(naive)文库或合成文库进行筛选和选择。如果这些限制导致无法针对gpcr的所需构象获得合适的vhh的情况,则这些现有技术方法在应用于所述gpcr时的用途可能有限。
[0020]
通常,本发明旨在提供一种替代方法,以提供可与gpcr一起使用的测定技术和化合物/配体筛选方法。特别地,本发明旨在提供这样的方法,其避免产生对天然gpcr的所需构象特异的vhh的需要,从而避免可能与之相关的任何困难或限制。
[0021]
更具体地,本发明旨在提供可用于测定和筛选技术的针对所述gpcr的gpcr和vhh的组合。
[0022]
本发明提供的测定和筛选技术可用于发现和开发(例如鉴定、产生、测试和优化)针对相关gpcr(即对一种或多种gpcr具有特异性和/或旨在靶向一种或多种gpcr,例如用于治疗、预防和/或诊断目的)的化合物。优选地,与其他(密切相关的)gpcr相比,此类化合物对一种特定的gpcr具有特异性(即对一种特定的gpcr具有选择性)。
[0023]
使用本发明提供的测定和筛选技术鉴定和/或开发的化合物可用于调节(如本文所定义的)相关的gpcr、其信号传导和/或所述gpcr或其信号传导在其中涉及的生物学功能、途径和/或机制。例如,本发明可用于发现和开发作为gpcr和/或其中涉及gpcr的信号传导、途径和/或生理和/或生物学机制的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构调节剂)的化合物。
[0024]
通常,使用本发明发现和/或开发的化合物将针对由存在于受试者体内的细胞表达的或在该细胞上表达的gpcr,其中所述受试者将用已经使用本发明的方法和技术发现或开发的化合物或配体进行治疗。
[0025]
本发明可用于发现和/或开发适合其预期用途的任何种类的化合物,其通常用作治疗剂、诊断剂或预防剂。因此,这些化合物可以是小分子、肽、生物分子或其他化学实体。合适的生物分子的实例可以包括例如抗体和抗体片段(例如fab、vh、vl和vhh结构域)和基于抗体片段的化合物(例如scfv和双抗体以及包含一个或多个vh、vl和/或vhh结构域的其他化合物或构建体)、基于其他蛋白质支架的化合物,例如alphabodies
tm
和基于avimer的支架、pdz结构域、蛋白a结构域(例如affibodies
tm
)、锚蛋白重复序列(例如darpins
tm
)、纤连蛋白(例如adnectins
tm
)和脂质运载蛋白(lipocalin)(例如anticalins
tm
)以及基于dna或rna的结合部分,包括但不限于dna或rna适体。参考本文的进一步描述,以及例如simeon和chen,protein cell 2018,9(1):3-14,binz等人,nat.biotech 2005,vol 23:1257和ulrich等人,comb chem high throughput screen 20069(8):619-32。
[0026]
本发明的方法和技术可例如用于筛选此类化合物的文库以鉴定对相关的gpcr(尤其是gpcr的所需构象,和/或能够诱导gpcr的所需构象例如配体结合特别是激动剂结合的构象)特异性的一个或多个“命中”,和/或用作策略的一部分的测定,以改善针对gpcr的化合物的亲和力和/或效力和/或以其他方式改善此类化合物的(药理学和/或其他特性)(例如,在小分子的情况下,作为“命中至先导”活动的一部分)。
[0027]
本发明的嵌合蛋白、方法和技术还可用于所谓的“基于片段的药物发现”或“fbdd”(也称为“基于片段的先导发现”或“fbld”)的目的。例如,参考lamoree和hubbard,essays in biochemistry(2017)61,453-464,以及标准手册例如jahnke和erlanson,“fragment-based approaches in drug discovery”,2006;zartler和shapiro,“fragment-based drug discovery:a practical approach”,2008;和kuo“fragment based drug design:tools,practical approaches,and examples”,2011。
[0028]
本发明将在本文中关于特定实施方案并参考某些非限制性实施例和附图进行描述。权利要求中的任何附图标记不应被解释为限制范围。所描述的附图只是示意性的并且是非限制性的。在附图中,为了说明的目的,一些元件的尺寸可能被扩大并且未按比例绘制。在本说明书和权利要求中使用术语“包含”时,它不排除其他元件或步骤。如果在提及单数名词时使用不定冠词或定冠词,例如“a”或“an”、“the”,则除非另有明确说明,否则包括该名词的复数形式。此外,说明书和权利要求中的术语第一、第二、第三等用于区分相似的元件,并不一定用于描述顺序或时间次序。应当理解,如此使用的术语在适当的情况下是可互换的,并且本文描述的本发明的实施方案能够以不同于本文描述或图示的其他顺序进行操作。
[0029]
除非本文另有定义,否则与本发明相关使用的科学和技术术语和短语应具有本领
域普通技术人员通常理解的含义。通常,与本文所述的分子和细胞生物学、结构生物学、生物物理学、药理学、遗传学以及蛋白质和核酸化学相关的术语和技术是本领域众所周知和常用的。singleton,等人,dictionary of microbiology and molecular biology,第二版,john wiley和sons,new york(1994),以及hale&marham,the harper collins dictionary of biology,harper perennial,ny(1991)向技术人员提供本公开中使用的许多术语的通用词典。除非另有说明,否则本发明的方法和技术通常根据本领域众所周知的常规方法进行,并如在本说明书全文中引用和讨论的各种通用和更具体的参考文献中所述。例如,参见sambrook等人molecular cloning:a laboratory manual,第三版,cold spring harbor laboratory press,cold spring harbor,n.y(2001);ausubel等人,current protocols in molecular biology,greene publishing associates(1992,和supplements to 2002);up,biomolecular crystallography:principles,practice and applications to structural biology,第一版,garland science,taylor&francis group,llc,an informa business,n.y.(2009);limbird,cell surface receptors,第三版,springer(2004)。
[0030]
如本文所用,术语“多肽”、“蛋白质”、“肽”在本文中可互换使用,并且指任何长度的氨基酸的聚合形式,其可包括编码的和非编码的氨基酸,经化学或生物化学修饰的或衍生的氨基酸,以及具有修饰的肽骨架的多肽。在整个申请中,将使用氨基酸的标准单字母符号。通常,术语“氨基酸”将指“蛋白质氨基酸”,即天然存在于蛋白质中的那些氨基酸。最特别地,氨基酸是l异构体形式,但也设想了d氨基酸。
[0031]
如本文所用,术语“核酸分子”、“多核苷酸”、“多核酸”、“核酸”可互换使用,并且是指任何长度的核苷酸(脱氧核糖核苷酸或核糖核苷酸,或其类似物)的聚合形式。多核苷酸可以具有任何三维结构,并且可以执行任何已知或未知的功能。多核苷酸的非限制性实例包括基因、基因片段、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、核酶、cdna、重组多核苷酸、分支多核苷酸、质粒、载体、任何序列的分离的dna,控制区、任何序列的分离的rna、核酸探针和引物。核酸分子可以是线性的或环状的。
[0032]
本文公开的任何肽、多肽、核酸、化合物等可以是“分离的”或“纯化的”。“分离的”在本文中用于表示所指的材料(i)与其在自然界中与其一起存在的一种或多种物质分离(例如,与至少一些细胞材料分离,与其他多肽分离,与其天然序列前后分离),和/或(ii)由涉及人工的过程产生,例如重组dna技术、蛋白质工程、化学合成等;和/或(iii)具有自然界中未发现的序列、结构或化学成分。“分离的”意在包括样品内的化合物,其基本上富含目的化合物和/或其中目的化合物被部分或基本上纯化。如本文所用,“纯化的”表示所指的材料从其自然环境中去除并且至少60%、至少75%或至少90%不含其天然相关的其他组分,也称为“基本纯的”。
[0033]
如本文所用,术语“序列同一性”是指在比较窗口内,在逐个核苷酸或逐个氨基酸的基础上序列相同的程度。
[0034]
因此,“序列同一性百分比”是通过以下计算的:在比较窗口内比较两个最佳比对序列,确定相同核酸碱基(例如,a、t、c、g、i)或相同的氨基酸残基(例如,ala,pro,ser,thr,gly,val,leu,lie,phe,tyr,trp,lys,arg,his,asp,glu,asn,gin,cys和met)出现在两个序列中的位置数量,以产生匹配位置的数量,将匹配位置的数量除以比较窗口中的位置总数
(即窗口大小),并将结果乘以100以产生序列同一性的百分比。确定序列同一性百分比可以手动完成,或者通过使用本领域可用的计算机程序来完成。有用算法的实例是pileup(higgins&sharp,cabios 5:151(1989),blast和blast 2.0(altschul等人j.mol.biol.215:403(1990)。执行blast分析的软件可通过国家生物技术信息中心(national center for biotechnology information)(http://www.ncbi.nlm.nih.gov/)公开获得。
[0035]“相似性”是指相同或构成保守置换的氨基酸的百分比数。可以使用序列比较程序如gap(deveraux等人1984)来确定相似性。以这种方式,可以通过将空位插入比对中来比较与本文引用的那些具有相似或实质不同长度的序列,例如通过gap使用的比较算法来确定这样的空位。如本文所用,“保守置换”是用侧链具有相似生化特性(例如,脂肪族、芳香族、带正电荷等)的其他氨基酸来置换氨基酸,并且是技术人员众所周知的。非保守置换则是用侧链不具有类似生化特性的其他氨基酸来置换氨基酸(例如用极性残基替换疏水性残基)。保守置换通常会产生不再相同但仍高度相似的序列。保守置换意指组合如gly,ala;val,ile,leu,met;asp,glu;asn,gin;ser,thr;lys,arg;cys,met;和phe,tyr,trp。
[0036]“缺失”在本文中定义为与亲本多肽或核酸的氨基酸序列或核苷酸序列相比其中一个或多个氨基酸或核苷酸残基分别缺失的氨基酸或核苷酸序列的变化。在蛋白质的上下文中,缺失可涉及约2、约5、约10、直至约20、直至约30或直至约50个或更多个氨基酸的缺失。蛋白质或其片段可包含多于一个缺失。在gpcr的上下文中,缺失也可以是环缺失,或n-和/或c-末端缺失。如本领域技术人员所清楚的,gpcr的n-和/或c-末端缺失也称为gpcr氨基酸序列的截短或截短的gpcr。
[0037]“插入”或“添加”是氨基酸或核苷酸序列的变化,与亲本蛋白质的氨基酸序列或核苷酸序列相比,分别导致一个或多个氨基酸或核苷酸残基的添加。“插入”通常是指在多肽的氨基酸序列内添加一个或多个氨基酸残基,而“添加”可以是插入或指在n-或c-末端或两个末端添加的氨基酸残基。在蛋白质或其片段的上下文中,插入或添加通常是约1、约3、约5、约10、直至约20、直至约30或直至约50个或更多个氨基酸。蛋白质或其片段可包含多于一个插入。
[0038]
如本文所用,“置换”是由以下产生的:与亲本蛋白质或其片段的氨基酸序列或核苷酸序列相比,分别用不同的氨基酸或核苷酸替换一个或多个氨基酸或核苷酸。应当理解,蛋白质或其片段可以具有对蛋白质活性基本上没有影响的保守氨基酸置换。保守置换意指组合如gly,ala;val,ile,leu,met;asp,glu;asn,gin;ser,thr;lys,arg;cys,met;和phe,tyr,trp。
[0039]“突变”在本文中定义为氨基酸或核苷酸序列的变化,如本文所述的缺失、插入或置换。当氨基酸或核苷酸序列包含两个或更多个这样的突变时,这些突变中的每一个都可以独立地是缺失、插入或置换。
[0040]
术语“氨基酸差异”是指与起始或参考序列相比,序列中已经改变(即通过置换、插入和/或缺失)的氨基酸残基的总数。序列和参考序列之间氨基酸差异的数量通常可以通过比较这些序列来确定,例如通过比对。
[0041]
术语“直向同源物”在用于提及来自给定物种的氨基酸或核苷酸/核酸序列时是指来自不同物种的相同氨基酸或核苷酸/核酸序列。应当理解,当两个序列通过线性遗传
(descent)源自共同祖先序列和/或以其他方式在它们的序列和它们的生物学功能方面密切相关时,它们是彼此的直向同源物。直向同源物通常具有高度的序列同一性,但可能不会(并且通常不会)共享100%的序列同一性。
[0042]
术语“重组”当用于指细胞、核酸、蛋白质或载体时,表示细胞、核酸、蛋白质或载体已通过引入异源核酸或蛋白质或改变天然核酸或蛋白质而被修饰,或者该细胞源自如此修饰的细胞。因此,例如,重组细胞表达在细胞的天然(非重组)形式中未发现的核酸或多肽,或表达以其他方式异常表达、表达不足、过表达或根本不表达的天然基因。
[0043]
如本文所用,术语“表达”是指基于基因的核酸序列产生多肽的过程。该过程包括转录和翻译。
[0044]
如本文所用,术语“可操作地连接”是指其中调控序列与目的基因邻近以控制目的基因的连接,以及反式或远距离作用以控制目的基因的调控序列。例如,当dna序列在启动子的转录起始位点下游连接到启动子并允许转录延伸通过dna序列进行时,dna序列与启动子可操作地连接。如果信号序列的dna被表达为参与多肽转运的前蛋白,则信号序列的dna与编码多肽的dna可操作地连接。dna序列与调控序列的连接通常是通过使用本领域技术人员已知的限制性内切核酸酶在合适的限制性位点或衔接头或代替其插入的接头处连接来实现的。
[0045]
如本文所用,术语“调控序列”,也称为“控制序列”,是指影响与其可操作连接的编码序列的表达所必需的多核苷酸序列。调控序列是控制核酸序列的转录、转录后事件和翻译的序列。调控序列包括适当的转录起始、终止、启动子和增强子序列;高效的rna处理信号,如剪接和聚腺苷酸化信号;稳定细胞质mrna的序列;增强翻译效率的序列(例如,核糖体结合位点);增强蛋白质稳定性的序列;以及在需要时,增强蛋白质分泌的序列。此类控制序列的性质因宿主生物而不同。术语“调控序列”旨在至少包括其存在对于表达必不可少的所有成分,并且还可以包括其存在是有利的额外成分,例如前导序列和融合配偶体序列。
[0046]
如本文所用,术语“载体”旨在指能够转运与其连接的另一种核酸分子的核酸分子。载体可以是任何合适的类型,包括但不限于噬菌体、病毒、质粒、噬菌粒、粘粒、杆粒或甚至人工染色体。某些载体能够在它们被引入的宿主细胞中自主复制(例如,具有在宿主细胞中起作用的复制起点的载体)。其他载体可以在引入宿主细胞后整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些优选的载体能够指导某些目的基因的表达。此类载体在本文中称为“重组表达载体”(或简称为“表达载体”)。合适的载体根据需要并根据特定宿主生物体(例如细菌细胞、酵母细胞)具有调控序列,例如启动子、增强子、终止子序列等。通常,根据本发明的重组载体包含至少一个“嵌合基因”或“表达盒”。表达盒通常是dna构建体,优选地包括(在转录方向上的5’至3’):启动子区、与转录起始区可操作地连接的本发明的多核苷酸序列、同源物、变体或其片段,和包括rna聚合酶的终止信号和聚腺苷酸化信号的终止序列。应当理解,所有这些区域都应该能够在待转化的生物细胞例如原核或真核细胞中运行。包含转录起始区的启动子区(其优选地包括rna聚合酶结合位点)以及聚腺苷酸化信号对于待转化的生物细胞可以是天然的,或者可以源自备选来源,其中该区域在生物细胞中是有功能的。
[0047]
如本文所用,术语“宿主细胞”旨在指已引入重组载体的细胞。应当理解,这些术语不仅是指特定的受试细胞,而且是指这种细胞的后代。由于某些修饰可能由于突变或环境
影响而在后代中发生,因此此类后代实际上可能与亲本细胞不同,但仍包括在本文所用术语“宿主细胞”的范围内。宿主细胞可以是在培养物中生长的分离的细胞或细胞系,或者可以是存在于活组织或生物体中的细胞。特别地,宿主细胞是细菌或真菌来源的,但也可以是植物或哺乳动物来源的。措辞“宿主细胞”、“重组宿主细胞”、“表达宿主细胞”、“表达宿主系统”、“表达系统”旨在具有相同的含义并且在本文中可互换使用。
[0048]
在本发明中,如本领域中常见的,使用从n-末端开始并在c-末端结束的单字母氨基酸代码给出氨基酸序列。此外,在本说明书和权利要求中,如果所述首先提到的位置或残基比给定的位置或残基更靠近n-末端,则该位置或残基被称为在给定位置或残基的“上游”,并且如果所述首先提到的位置或残基比给定的位置或残基更靠近c末端,则为“下游”。
[0049]“g-蛋白偶联受体”或“gpcr”是共享共同结构基序的多肽,具有细胞外氨基末端(n-末端)、细胞内羧基末端(c-末端)和7个疏水性跨膜(形成七个d螺旋的22到24个疏水氨基酸的七个区域),每个疏水性跨膜都跨越膜。每个跨度由数字标识,即跨膜-1(tm1)、跨膜-2(tm2)等。跨膜螺旋通过细胞膜的外部或“细胞外”侧上的跨膜-2和跨膜-3、跨膜-4和跨膜-5以及跨膜-6和跨膜-7之间的氨基酸区域连接,分别称为“细胞外”区域1、2和3(ec1、ec2和ec3)。跨膜螺旋还通过细胞膜的内部或“细胞内”侧的跨膜-1和跨膜-2、跨膜-3和跨膜-4以及跨膜-5和跨膜-6之间的氨基酸区域连接,分别称为“细胞内”区域1、2和3(ic1、ic2和ic3)。受体的“羧基”(“c”)末端位于细胞内的细胞内空间,并且受体的“氨基”(“n”)末端位于细胞外的细胞外空间。gpcr结构和分类在本领域中通常是众所周知的,并且gpcr的进一步讨论可发现于:cvicek等人,plos comput biol.2016年3月30日;12(3):e1004805.doi:10.1371/journal.pcbi.1004805;ventakakrishnan,current opinion in structural biology,2014,27∶129-137;isberg,trends pharmacol.sci.,2015年1月,22-13,probst,dna cell biol.1992 11:1-20;marchese等人genomics 23:609-618,1994;和以下书籍:jurgen wess(ed)structure-function analysis of g protein-coupled receptors,由wiley liss出版(第1版;1999年10月15日);kevin r.lynch(ed)identification and expression of g protein-coupled receptors,由john wiley&sons出版(1998年3月)和tatsuya haga(ed),g protein-coupled receptors,由crc press出版(1999年9月24日);和steve watson(ed)g-protein linked receptor factsbook,由academic press出版(第1版;1994)。如所述现有技术和其他科学文献所述,在天然存在的gpcr中,n末端和c末端部分、tm结构域、细胞内环和细胞外环通常排列如下(从n末端到c末端):
[0050]
[n末端序列]-[tm1]-[ic1]-[tm2]-[ec1]-[tm3]-[ic2]-[tm4]-[ec2]-[t m5]-[ic3]-[tm6]-[ec3]-[tm7]-[c末端序列]
[0051]
国际基础和临床药理学联盟(international union of basic and clinical pharmacology)(iuphar)维护着受体(包括gpcr)及其已知内源性配体和信号传导机制的数据库(http://www.guidetopharmacology.org/targets.jsp)。根据该数据库,截至2019年1月,已在人类中鉴定出大约800个gpcr,其中大约一半具有感官功能(例如嗅觉、味觉、光感和信息素信号传导),并且大约一半介导与配体(范围包括大小从小分子到肽再到大蛋白质)相关的信号传导。截至2019年1月的iuphar数据库描述了两种对gpcr进行分类的系统,其中一种基于gpcr的六类,如下所示:a类(视紫质样)、b类(胰泌素受体家族)、c类(代谢型谷氨酸)、d类(真菌交配信息素受体,在脊椎动物中未发现)、e类(环amp受体,也未在脊椎动
物中发现)和f类(卷曲/平滑的)。iuphar数据库还提到了一种称为“grafs”的备选分类方案,它将脊椎动物gpcr分为五类(与a-f命名法重叠),如下所示:谷氨酸家族(与上述“c类”重叠),其尤其包括代谢型谷氨酸受体、钙敏感受体和gabab受体;视紫质家族(与上述“a类”重叠),其包括各种小分子、神经递质、肽和激素的受体,以及嗅觉受体、视觉色素、2型味觉受体和五种信息素受体(v1受体);粘附家族gpcr(在系统发育上与b类受体相关);卷曲家族,其由10种卷曲蛋白(fzd(1-10))和平滑(smo)组成;和胰泌素家族,其是具有27-141个氨基酸残基的肽配体/激素的受体,包括高血糖素、高血糖素样肽(glp-1、glp-2)、葡萄糖依赖性促胰岛素多肽(gip)、胰泌素、血管活性肠肽(vip)、垂体腺苷酸环化酶激活多肽(pacap)和生长激素释放激素(ghrh)。在本说明书和所附权利要求中,除非另有明确说明,否则将使用a到f型分类。进一步参考本文引用的cvicek等人。
[0052]
就gpcr而言,术语“生物活性”是指具有天然存在的gpcr的生化功能(例如结合功能、信号转导功能或由于配体结合而改变构象的能力)的gpcr。
[0053]
一般而言,关于gpcr的术语“天然存在的”是指(例如,由野生型哺乳动物,例如人)天然产生的gpcr。这种gpcr在自然界中被发现。关于gpcr的术语“非天然存在的”是指非天然存在的gpcr。通过突变而具有组成型活性的天然存在的gpcr和天然存在的跨膜受体的变体(例如表位标记的gpcr和缺乏其天然n末端的gpcr)是非天然存在的gpcr的实例。天然存在的gpcr的非天然存在版本通常由与天然存在的gpcr相同的配体激活。本文进一步提供了本发明上下文中天然存在或非天然存在的gpcr的非限制性实例。
[0054]
如本文所用,“表位”是指多肽的抗原决定簇。表位可以在空间构象中包含3个氨基酸,这是表位所独有的。通常表位由至少4、5、6、7个这样的氨基酸组成,更通常地,由至少8、9、10个这样的氨基酸组成。确定氨基酸空间构象的方法是本领域已知的,包括例如x射线晶体学和多维核磁共振。如本文所用,“构象表位”是指包含空间构象中的氨基酸的表位,所述空间构象对于多肽的折叠3维构象是独特的。通常,构象表位由线性序列中不连续的氨基酸组成,这些氨基酸在蛋白质的折叠结构中聚集在一起。然而,构象表位也可由氨基酸的线性序列组成,该序列采用对多肽的折叠3维构象(并且不以变性状态存在)是独特的构象。
[0055]
术语蛋白质(例如gpcr)的“构象”或“构象状态”通常是指蛋白质在任何时刻可能采用的空间布置、结构或结构范围。本领域技术人员将认识到,构象或构象状态的决定因素包括反映在蛋白质氨基酸序列(包括修饰的氨基酸)的蛋白质一级结构和蛋白质周围环境。蛋白质的构象或构象状态还涉及结构特征,例如蛋白质二级结构(例如,α-螺旋、β-折叠等)、三级结构(例如,多肽链的三维折叠)和四级结构(例如,多肽链与其他蛋白质亚基的相互作用)。多肽链的翻译后和其他修饰,例如配体结合、磷酸化、硫酸化、糖基化或疏水基团的附接等,都可影响蛋白质的构象。此外,环境因素,如ph值、盐浓度、离子强度和周围溶液的渗透压,以及与其他蛋白质和辅助因子的相互作用等,都可影响蛋白质构象。蛋白质的构象状态可以通过活性或与另一分子结合的功能测定或通过物理方法例如x射线晶体学、nmr或自旋标记等方法来确定。对于蛋白质构象和构象状态的一般讨论,可以参考cantor和schimmel,biophysical chemistry,第一部分:the conformation of biological.macromolecules,w.h.freeman and company,1980,和creighton,proteins:structures and molecular properties,w.h.freeman and company,1993。
[0056]
如本文所用,“功能性构象”或“功能性构象状态”是指蛋白质(例如gpcr)拥有具有
动态活性范围(特别是从无活性到最大活性)的不同构象状态的事实。需要清楚的是,“功能性构象状态”是指蛋白质的具有任何活性(包括无活性)的任何构象状态,并不包括蛋白质的变性状态。功能性构象的非限制性实例包括活性构象、无活性构象或基础构象(如本文所进一步定义的)。如上所述,特定类别的功能性构象被定义为“可成药构象”并且通常是指蛋白质的治疗相关构象状态。例如参考johnson和karanicolas,plos comput biol 9(3):e1002951.doi:10.1371/journal.pcbi.1002951和例如wo2014/122183,其描述了毒蕈碱乙酰胆碱受体m2的激动剂结合活性构象对应于与疼痛和成胶质细胞瘤(gliobastoma)相关的该受体的可成药构象,并描述了能够稳定所述可成药构象以用于测定和筛选目的的vhh。因此应理解,成药性限于取决于治疗适应症的特定构象。本文进一步提供了更多细节。
[0057]
对于作为受体的蛋白质(例如gpcr),如本文所用,术语“活性构象”更具体地指允许信号转导至细胞内效应器系统(例如g蛋白依赖性信号传导和/或g蛋白非依赖性信号传导(例如β-抑制蛋白信号传导))的构象或受体构象的谱。因此,“活性构象”涵盖了一系列配体特异性构象,包括激动剂特异性活性状态构象、部分激动剂特异性活性状态构象或偏向性激动剂特异性活性状态构象,以便其诱导细胞内效应蛋白的协同结合。
[0058]
除上述之外,对于gpcr,本文所用的术语“活性构象”和“活性形式”是指以某种方式折叠以具有(功能)活性的gpcr。可以使用受体的激活配体(激动剂)将gpcr置于活性构象中,并且这种构象变化通常使受体能够激活异源三聚体g蛋白。例如,处于活性构象的gpcr与异源三聚体g蛋白结合并催化g蛋白的核苷酸交换以激活下游信号传导途径。激活的gpcr与无活性的gdp结合形式的异源三聚体g蛋白结合,并导致g蛋白释放其gdp,因此gtp能够结合。这一过程产生了瞬时的“无核苷酸”状态,使gtp能够结合。一旦gtp结合,受体和g蛋白解离,使gtp结合的g蛋白激活下游信号传导途径,例如腺苷酸环化酶、离子通道、ras/mapk等。术语“无活性构象”和“无活性形式”是指以某种方式折叠以便无活性的gpcr。可以使用受体的反向激动剂将gpcr置于无活性构象中。例如,处于无活性构象的gpcr不以高亲和力与异源三聚体g蛋白结合。术语“活性构象”和“无活性构象”将在本文中进一步说明。如本文所用,术语“基础构象”是指以这样的方式折叠的gpcr,即使在不存在激动剂的情况下它也展示出针对特定信号传导途径的活性(也称为基础活性或组成型活性)。反向激动剂能抑制这种基础活性。因此,在不存在配体或辅助蛋白的情况下,gpcr的基础构象对应于稳定的构象或突出的结构种类。
[0059]
类似地,对于作为受体的蛋白质(例如gpcr),本文所用的术语“无活性构象”是指不允许或阻断信号转导至细胞内效应器系统的受体构象的谱。因此,“无活性构象”涵盖一系列配体特异性构象,包括反向激动剂特异性无活性状态构象,从而防止细胞内效应蛋白的协同结合。应当理解,配体的结合位点对于获得活性或无活性构象不是关键的。因此,正构(orthosteric)配体以及变构调节剂同样能够稳定处于活性或无活性构象的受体。
[0060]
如本文所用,术语“结合剂”是指能够使用特定分子间相互作用与膜蛋白(例如gpcr)结合的蛋白质(蛋白质、蛋白质样或含蛋白质)分子的全部或部分。在特定的实施方案中,术语“结合剂”并不意在包括相关膜蛋白的天然存在的结合配偶体,例如g蛋白、抑制蛋白、内源性配体;或其变体或衍生物(包括片段)。更具体地,术语“结合剂”是指多肽,更具体地是蛋白质结构域。合适的蛋白质结构域是整体蛋白质结构的元件,它是自稳定的并且独立于蛋白质链的其余部分折叠并且通常被称为“结合结构域”。这种结合结构域的长度从约
25个氨基酸直至500个氨基酸和更多之间变化。许多结合结构域可以分类为折叠并且是可识别的、可鉴定的、3-d结构。一些折叠在许多不同的蛋白质中非常常见,以至于它们被赋予了具体的名称。非限制性实例是选自以下的结合结构域:3或4螺旋束、犰狳重复结构域、富含亮氨酸的重复结构域、pdz结构域、sumo或sumo样结构域、钙粘蛋白结构域、免疫球蛋白样结构域、磷酸酪氨酸结合结构域、普列克底物蛋白同源结构域、src同源2结构域等。因此,结合结构域可以源自天然存在的分子,例如,来自先天性或适应性免疫系统的组分,或者它可以是完全人工设计的。
[0061]
通常,结合结构域可以是基于免疫球蛋白的或其可以基于存在于蛋白质中的结构域,包括但不限于微生物蛋白质、蛋白酶抑制剂、毒素、纤连蛋白、脂质运载蛋白(lipocalin)、单链反平行卷曲螺旋蛋白或重复基序蛋白。本领域已知的结合结构域的具体实例包括但不限于:抗体、重链抗体(hcab)、单结构域抗体(sdab)、微型抗体、源自骆驼科重链抗体的可变结构域(vhh或纳米抗体),源自鲨鱼抗体的新抗原受体的可变结构域(vna)、alphabody、蛋白a、蛋白g、设计的锚蛋白重复结构域(darpin)、纤连蛋白iii型重复序列、anticalin、knottin、工程化ch2结构域(纳米抗体)、工程化sh3结构域、亲和体(affibody)、肽和蛋白质、脂肽(例如pepducin)(参见,例如gebauer&skerra,2009;skerra,2000;starovasnik等人,1997;binz等人,2004;koide等人,1998;dimitrov,2009;nygren等人2008;wo2010066740)。通常,当使用选择方法生成特定类型的结合结构域时,使用包含含有随机潜在相互作用残基的共有序列或构架序列的组合文库来筛选与目的分子(例如蛋白质)的结合。
[0062]
根据优选的实施方案,特别设想本发明的结合剂源自先天性或适应性免疫系统。优选地,所述结合剂源自免疫球蛋白。优选地,根据本发明的结合剂源自抗体或抗体片段。术语“抗体”(ab)通常是指由免疫球蛋白基因编码的多肽或其功能片段,其特异性结合并识别抗原,并且是本领域技术人员已知的。抗体旨在包括常规四链免疫球蛋白,其包含两对相同的多肽链,每对具有一条“轻”链(约25kda)和一条“重”链(约50kda)。通常,在常规免疫球蛋白中,重链可变结构域(vh)和轻链可变结构域(vl)相互作用以形成抗原结合位点。术语“抗体”意在包括完整抗体,包括单链完整抗体和抗原结合片段。在一些实施方案中,抗原结合片段可以是抗原结合抗体片段,包括但不限于fab、fab’和f(ab’)2、fd、单链fv(scfv)、单链抗体、二硫键连接的fv(dsfv)和包含vl或vh结构域或由其组成的片段,以及那些或能够结合靶抗原的免疫球蛋白肽的任何其他功能部分的任何组合。术语“抗体”还意在包括重链抗体或其片段,包括免疫球蛋白单可变结构域,如本文所进一步定义的。
[0063]
术语“免疫球蛋白单可变结构域”或“isvd”定义了这样的分子,其中抗原结合位点存在于单免疫球蛋白结构域上并由其形成(不同于常规免疫球蛋白或其片段,其中通常两个免疫球蛋白可变结构域相互作用以形成抗原结合位点)。然而,应当清楚的是,术语“免疫球蛋白单可变结构域”确实包含常规免疫球蛋白的片段,其中抗原结合位点由单可变结构域形成。优选地,本发明范围内的结合剂是免疫球蛋白单可变结构域。
[0064]
通常,免疫球蛋白单可变结构域是包含4个构架区(fr1至fr4)和3个互补决定区(cdr1至cdr3)的氨基酸序列,优选根据下式(1):fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4(1),或其任何合适的片段(其通常含有至少一些形成至少一个互补决定区的氨基酸残基)。包含4个fr和3个cdr的isvd是本领域技术人员已知的,并且作为非限制性示例描述于wesolowski
等人2009中。免疫球蛋白单可变结构域的典型但非限制性实例包括轻链可变结构域序列(例如vl结构域序列)或其合适的片段,或重链可变结构域序列(例如vh结构域序列或vhh结构域序列)或其合适的片段,只要它能够形成单抗原结合单元即可。因此,根据优选的实施方案,结合剂是免疫球蛋白单可变结构域,所述免疫球蛋白单可变结构域为轻链可变结构域序列(例如vl结构域序列)或重链可变结构域序列(例如vh结构域序列);更具体地,免疫球蛋白单可变结构域是源自常规四链抗体的重链可变结构域序列或源自重链抗体的重链可变结构域序列。免疫球蛋白单可变结构域可以是结构域抗体,或单结构域抗体,或“dab”或dab,或纳米抗体(如本文所定义),或另一免疫球蛋白单可变结构域,或其任一者的任何合适的片段。对于单结构域抗体的一般描述,参考以下书籍:“single domain antibodies”,methods in molecular biology,eds.saerens and muyldermans,2012,第911卷。免疫球蛋白单可变结构域通常包含单个氨基酸链,其可以被认为包含4个“构架序列”或fr和3个“互补决定区”或cdr(如上文所定义)。应该清楚的是,免疫球蛋白单可变结构域的构架区也可能有助于其抗原的结合(desmyter等人2002;korotkov等人2009)。
[0065]
如本文进一步所述,vhh、纳米抗体或confobody中的氨基酸残基总数可在110-120的范围内,优选为112-115,最优选为113。然而,应注意的是,vhh或纳米抗体的部分、片段、类似物或衍生物(如本文进一步描述的)在其长度和/或大小方面没有特别限制,只要此类部分、片段、类似物或衍生物满足本文概述的进一步要求并且还优选地适用于本文所述的目的即可。
[0066]
在本技术中,免疫球蛋白重链可变结构域中的氨基酸残基/位置将用根据kabat的编号表示(“sequence of proteins of immunological interest”,us public health services,nih bethesda,md,publication no.91),如riechmann和muyldermans,j.immunol.methods 2000年6月23日;240(1-2):185-195的文章中(例如参见该出版物的图2)应用于骆驼科动物的v
hh
结构域。例如,还参考国际申请wo2108/134235的图1,其给出了一个表格,列出了vhh中的一些氨基酸位置及其根据一些备选编号系统(例如aho和imgt,注意:除非另有明确说明,对于本说明书和权利要求,kabat编号对于vhh、纳米抗体或confobody中的氨基酸残基/位置是决定性的;其他编号系统仅供参考)的编号。
[0067]
关于cdr,如本领域众所周知的,存在着多种规则以定义和描述vh或vhh片段的cdr,例如kabat定义(其基于序列可变性并且是最常用的)和chothia定义(其基于结构环区域的位置)。例如,参考网站http://www.bioinf.org.uk/abs/。为了本说明书和权利要求的目的,即使也可提及根据kabat的cdr,但是cdr最优选基于abm定义(其基于oxford molecular的abm抗体建模软件)而被定义,原因在于这被认为是kabat和chothia定义之间的最优折衷。再次参考网站http://www.bioinf.org.uk/abs/。
[0068]
因此,在本说明书和权利要求中,除非本文另有明确说明,否则所有cdr或vhh、纳米抗体或confobody均根据abm规则来定义。
[0069]
应当指出,作为结合剂的免疫球蛋白单可变结构域在其最广泛的意义上不限于特定的生物来源或特定的制备方法。术语“免疫球蛋白单可变结构域”或“isvd”涵盖不同来源的可变结构域,包括小鼠、大鼠、兔、驴、人、鲨鱼、骆驼科可变结构域。根据具体的实施方案,免疫球蛋白单可变结构域源自鲨鱼抗体(所谓的免疫球蛋白新抗原受体或ignar),更具体地源自天然存在的重链鲨鱼抗体(没有轻链),并且被称为vnar结构域序列。优选地,免疫球
蛋白单可变结构域源自骆驼科抗体。更优选地,免疫球蛋白单可变结构域源自天然存在的重链骆驼科抗体(没有轻链),并且被称为vhh结构域序列或纳米抗体。
[0070]
根据特别优选的实施方案,本发明的结合剂是免疫球蛋白单可变结构域,所述免疫球蛋白单可变结构域为纳米抗体(如本文进一步定义的,并且包括但不限于vhh)。如本文所用,术语“纳米抗体”(nb)是单结构域抗原结合片段。它特别指源自天然存在的重链抗体的单可变结构域并且是本领域技术人员已知的。纳米抗体通常源自骆驼科动物中发现的仅重链抗体(没有轻链)(hamers-casterman等人,1993年;desmyter等人,1996年),并且因此通常被称为vhh抗体或vhh序列。骆驼科动物包括旧世界骆驼科动物(双峰驼(camelusbactrianus)和单峰驼(camelusdromedarius))和新世界骆驼科动物(例如羊驼(lamapaccos)、大羊驼(lamaglama)、南美驼马(lamaguanicoe)和小羊马它(lamavicugna))。和是ablynx nv(比利时)的注册商标。对于vhh或纳米抗体的进一步描述,请参考书籍“single domain antibodies”,methods in molecular biology,saerens和muyldermans编辑,2012年,第911卷,特别是vincke和muyldermans的章节(2012),以及作为一般
背景技术:
提及的专利申请的非限制性列表,包括:vrije universiteit brussel的wo 94/04678,wo 95/04079,wo 96/34103;unilever的wo 94/25591,wo 99/37681,wo 00/40968,wo 00/43507,wo 00/65057,wo 01/40310,wo 01/44301,ep 1 134 231和wo 02/48193;vlaams instituut voor biotechnologie(vib)的wo 97/49805,wo 01/21817,wo 03/035694,wo 03/054016和wo 03/055527;ablynx n.v.的wo 04/041867,wo 04/041862,wo 04/041865,wo 04/041863,wo 04/062551,wo 05/044858,wo 06/40153,wo 06/079372,wo 06/122786,wo 06/122787和wo 06/122825,和ablynx n.v.进一步公布的专利申请。如本领域技术人员已知的,纳米抗体的特征特别在于在一个或多个构架序列(根据kabat编号)中存在一个或多个骆驼科“标志性残基”,例如在wo08/020079第75页表a-3(通过引用并入本文)中所描述的。应当注意,本发明的纳米抗体在其最广泛的意义上不限于特定的生物来源或特定的制备方法。例如,纳米抗体通常可以通过以下方式获得:(i)分离天然存在的重链抗体的vhh结构域;(ii)表达编码天然存在的vhh结构域的核苷酸序列;(iii)“人源化”天然存在的vhh结构域或表达编码此类人源化vhh结构域的核酸;(iv)“骆驼化”来自任何动物物种,特别是来自哺乳动物物种,例如来自人类的天然存在的vh结构域,或表达编码此类骆驼化vh结构域的核酸;(v)“骆驼化”本领域所述的“结构域抗体”或“dab”,或表达编码这种骆驼化vh结构域的核酸;(vi)使用用于制备蛋白质、多肽或其他本身已知的氨基酸序列的合成或半合成技术;(vii)通过使用本身已知的核酸合成技术来制备编码纳米抗体的核酸,然后表达由此获得的核酸;和/或(8)上述一项或多项的任何组合。纳米抗体的进一步描述,包括纳米抗体的人源化和/或骆驼化,可发现于例如wo08/101985和wo08/142164中,以及本文的进一步说明。结合天然靶标的构象表位的纳米抗体的特定类别称为xaperones,并且这里是特别设想的。xaperone
tm
是vib和vub(比利时)的商标。xaperone
tm
是一种骆驼科单结构域抗体,其可将药物靶标限制为独特的、与疾病相关的可成药构象。
[0071]
在本发明的范围内,术语“免疫球蛋白单可变结构域”还涵盖“人源化”或“骆驼化”的可变结构域,特别是“人源化”或“骆驼化”的纳米抗体。例如,“人源化”和“骆驼化”都可以通过以下进行:提供分别编码天然存在的vhh结构域或vh结构域的核苷酸序列,然后以本身
已知的方式改变所述核苷酸序列中的一个或多个密码子,其中所述改变密码子是以这样的方式:新的核苷酸序列分别编码本发明的“人源化”或“骆驼化”免疫球蛋白单可变结构域。然后可以以本身已知的方式表达该核酸,以提供本发明的所需的免疫球蛋白单可变结构域。或者,分别基于天然存在的vhh结构域或vh结构域的氨基酸序列,可以分别设计本发明的所需人源化或骆驼化免疫球蛋白单可变结构域的氨基酸序列,然后使用用于本身已知的肽合成的技术从头合成。此外,分别基于天然存在的vhh结构域或vh结构域的氨基酸序列或核苷酸序列,可以分别设计编码本发明的所需人源化或骆驼化免疫球蛋白单可变结构域的核苷酸序列,然后使用用于本身已知的核酸合成的技术从头合成,然后可以以本身已知的方式表达由此获得的核酸,以提供本发明的所需免疫球蛋白单可变结构域。用于从天然存在的vh序列或优选vhh序列开始获得本发明的免疫球蛋白单可变结构域和/或编码其的核酸的其他合适的方法和技术对于技术人员来说是清楚的,并且可以例如包括将一个或多个天然存在的vh序列的一个或多个部分(例如一个或多个fr序列和/或cdr序列),一个或多个天然存在的vhh序列的一个或多个部分(例如一个或多个fr序列或cdr序列),和/或一个或多个合成或半合成序列以合适的方式进行组合,以提供本发明的纳米抗体或编码其的核苷酸序列或核酸。
[0072]
根据本发明的特定实施方案,能够稳定受体的结合剂可以在正构位点或变构位点结合。在其他具体实施方案中,能够稳定受体的结合剂可以是活性构象选择性结合剂或无活性构象选择性结合剂,通过在正构位点或变构位点结合。通常,与不存在结合剂(或在不针对和/或不特异性结合受体的模拟结合剂(也称为对照结合剂或无关结合剂)的存在下)的受体相比,稳定受体活性构象的构象选择性结合剂将增加或增强受体对活性构象选择性配体(例如激动剂,更具体地,完全激动剂、部分激动剂或偏向性激动剂)的亲和力。此外,与不存在结合剂(或存在模拟结合剂的)的受体相比,稳定受体活性构象的结合剂将降低受体对无活性构象选择性配体(例如反向激动剂)的亲和力。相反,与不存在结合剂(或存在模拟结合剂)的受体相比,稳定受体无活性构象的结合剂将增强受体对反向激动剂的亲和力并降低受体对激动剂(特别是完全激动剂、部分激动剂或偏向性激动剂)的亲和力。对配体的亲和力的增加或减少分别可以通过和/或从ec50、ic50、kd、k或本领域技术人员已知的亲和力或效力的任何其他量度的减少或增加直接测量和/或计算。特别优选的是,在与受体结合时,稳定受体特定构象的结合剂能够将对构象选择性配体的亲和力增加或减少至少2倍、至少5倍、至少10倍、至少50倍、和更优选至少100倍,甚至更优选至少1000倍或更多。应当理解,触发/抑制特定信号传导途径的构象选择性配体的亲和力测量可以用以下物质进行:任何类型的配体,包括天然配体、小分子以及生物制品;正构配体以及变构调节剂;单一化合物以及化合物文库;先导化合物或片段;等等。
[0073]
如本文所用,术语“亲和力”是指配体(如本文进一步定义)与靶蛋白(例如gpcr)结合从而将靶蛋白和配体的平衡向存在通过它们结合形成的复合体的方向转移的程度。因此,例如,当gpcr和配体以相对相等的浓度组合时,高亲和力的配体将与gpcr上的可用抗原结合,从而使平衡向所得复合体的高浓度转移。解离常数通常用于描述配体和靶蛋白之间的亲和力。通常,解离常数低于10-5
m。优选地,解离常数低于10-6
m,更优选地低于10-7
m。最优选地,解离常数低于10-8
m。描述配体(包括小分子配体)与其靶蛋白之间亲和力的其他方式是结合常数(ka)、抑制常数(ki)(也称为抑制性常数),或间接通过测量半数最大抑制浓度
(ic50)或半数最大有效浓度(ec50)评估配体的效力。在本发明的范围内,配体可以是结合gpcr上的构象表位的结合剂,优选免疫球蛋白,例如抗体,或免疫球蛋白片段,例如vhh或纳米抗体。应当理解,在本发明的范围内,术语“亲和力”在结合靶gpcr的构象表位的结合剂特别是免疫球蛋白或免疫球蛋白片段例如vhh或纳米抗体的上下文中使用,以及在结合靶gpcr(更特别地结合靶gpcr的正构或变构位点)的测试化合物(如本文进一步定义)的上下文中使用。
[0074]
如本文所用,术语“特异性”是指蛋白质或其他结合剂,特别是免疫球蛋白或免疫球蛋白片段,例如vhh或纳米抗体,相对于不同抗原(例如不同gpcr)优先结合一种抗原(例如gpcr)的能力,并且不一定意味着高亲和力。
[0075]
如本文所用,术语“特异性结合(specifically bind、specific binding)”通常是指结合剂,特别是免疫球蛋白,例如抗体,或免疫球蛋白片段,例如vhh或纳米抗体,优先与存在于不同抗原的均匀混合物中的特定抗原结合的能力。在某些实施方案中,特异性结合相互作用将在一些实施方案中以超过约10至100倍或更多(例如,超过约1000倍或10,000倍)区分样品中的期望和不期望抗原。在gpcr的构象状态的谱的上下文中,该术语特别指结合剂(如本文定义的)与另一种构象状态相比优先识别和/或结合gpcr的特定构象状态的能力。
[0076]
此外,应当理解,在本说明书和所附权利要求中,其中蛋白质、配体、化合物、结合结构域、结合单元或其他化学实体被称为“结合”另一蛋白质、配体、化合物、结合结构域、结合单元或其他化学实体或表位或结合位点,这种结合优选是如本文定义的“特异性”结合。此外,优选地,这种结合是如本文定义的“选择性结合”。
[0077]
如本文所用,本发明上下文中的术语“构象选择性结合剂”是指以构象选择性方式结合靶蛋白(例如gpcr)的结合剂。选择性结合蛋白质的特定构象或构象状态的结合剂是指与蛋白质可能呈现(assume)的其他构象或构象状态相比,以更高的亲和力与处于构象或构象状态子集中的蛋白质结合的结合剂。本领域技术人员将认识到,选择性结合蛋白质的特定构象或构象状态的结合剂将稳定或保留处于该特定构象或构象状态的蛋白质。例如,活性构象选择性结合剂将优先与处于活性构象状态的gpcr结合,并且不会或在较小程度上与处于无活性构象状态的gpcr结合,并且因此将对所述活性构象状态具有更高的亲和力;或相反亦然。术语“特异性结合”、“选择性结合”、“优先结合”及其语法等同物在本文中可互换使用。术语“构象特异性”或“构象选择性”在本文中也可互换使用(但应注意,本文使用的术语“构象诱导”具有单独的含义,如本文进一步定义的那样)。
[0078]
如本文所用,术语“稳定”或如上文定义的语法等效术语是指,蛋白质(如本文所述)或受体(也如本文所述)在结构(例如构象状态)和/或特定的生物活性(例如细胞内信号传导活性、配体结合亲和力等)方面的增加的稳定性。关于在结构和/或生物活性方面增加的稳定性,这可以通过活性(例如ca2+释放、camp生成或转录活性、β-抑制蛋白募集等)或配体结合的功能测定,或通过物理方法,例如x射线晶体学、nmr或自旋标记等方法来轻松确定。术语“稳定”还包括在由变性剂或变性条件诱导的非生理条件下受体的热稳定性增加。如本文所用,术语“热稳定(thermostabilize、thermostabilizing)”、“增加...的热稳定性”是指受体的功能性而非热力学特性以及蛋白质对由热和/或化学方法(包括但不限于加热、冷却、冷冻、化学变性剂、ph、去污剂、盐、添加剂、蛋白酶或温度)诱导的不可逆变性的抗
性。不可逆变性导致蛋白质功能性构象的不可逆展开、生物活性的丧失和变性蛋白质的聚集。关于增加的热稳定性,这可以通过测量配体结合或通过使用光谱方法(如荧光、cd或光散射)来轻松确定,这些方法对温度升高时的展开敏感。优选地,结合剂能够增加稳定性,如通过在至少2℃、至少5℃、至少8℃、更优选至少10℃或15℃或20℃下功能性构象状态中的蛋白质或受体的热稳定性的增加所测量的。关于增加对去污剂或离液剂的稳定性,通常将蛋白质或受体在测试去污剂或测试离液剂存在下温育规定时间,并使用例如配体结合或光谱方法任选地在如上所述的升高的温度下确定稳定性。另外,结合剂能够增加蛋白质或受体的功能性构象状态对极端ph的稳定性。关于极端ph,典型的测试ph将选择在例如范围6至8、范围5.5至8.5、范围5至9、范围4.5至9.5,更具体地范围4.5至5.5(低ph)或范围8.5至9.5(高ph)内。如本文所用,术语“(热)稳定((thermo)stabilize、(thermo)stabilizing)”、“增加
……
的(热)稳定性”适用于嵌入脂质颗粒或脂质层(例如,脂质单层、脂质双层等)的蛋白质或受体,和已溶解在去污剂中的蛋白质或受体。
[0079]
除上述之外,关于gpcr的功能性构象状态,术语“稳定(stabilizing或stabilized)”是指将gpcr蛋白保留或保持在由于gpcr与根据本发明的结合剂相互作用的效果而可能呈现的可能的构象子集中。在此上下文中,选择性结合蛋白质的特定构象或构象状态的结合剂是指与蛋白质可能呈现的其他构象或构象状态相比,以更高的亲和力与处于构象或构象状态子集中的蛋白质结合的结合剂。本领域技术人员将认识到特异性或选择性结合蛋白质的特定构象或构象状态的结合剂将稳定该特定构象或构象状态及其相关活性。本文进一步提供了更多细节。
[0080]
如本文所用,术语“化合物”或“测试化合物”或“候选化合物”或“药物候选化合物”描述了在测定(例如筛选测定或药物发现测定)中测试的天然存在的或合成的任何分子。因此,这些化合物包括有机或无机化合物。这些化合物包括以低分子量为特征的多核苷酸、脂质或激素类似物。其他生物聚合有机测试化合物包括含有约2至约40个氨基酸的小肽或肽样分子(肽模拟物),和含有约40至约500个氨基酸的较大多肽,例如抗体、抗体片段或抗体缀合物。测试化合物也可以是蛋白质支架。出于高通量目的,可以使用测试化合物文库,例如提供足够多样性范围的组合或随机文库。实例包括但不限于天然化合物文库、变构化合物文库、肽文库、抗体片段文库、合成化合物文库、基于片段的文库、噬菌体展示文库等。可以在说明书中进一步找到更详细的描述。
[0081]
如本文所用,术语“配体”是指与本文所指的蛋白质(例如gpcr)特异性结合的分子。配体可以是,但不限于,多肽、脂质、小分子、抗体、抗体片段、核酸、碳水化合物。配体可以是合成的或天然存在的。配体还包括“天然配体”,其是作为天然gpcr的内源性天然配体的配体。在本发明的上下文中,当蛋白质是跨膜蛋白质例如gpcr时,配体可以在当蛋白质处于其天然细胞环境中时暴露于细胞内环境的配体结合位点上与所述蛋白质结合(即配体可以是“细胞内配体”),或者,配体可以在当蛋白质处于其天然细胞环境中时暴露于细胞外环境的配体结合位点上与所述蛋白质结合(即配体可以是“细胞外配体”)。细胞外配体通常根据它们调节(如本文定义)gpcr的方式进行分类,例如作为激动剂、作为部分激动剂、作为反向激动剂、作为拮抗剂或作为变构调节剂。细胞外配体可以在正构位点或变构位点结合。
[0082]
如本文进一步描述的,细胞内配体(例如本发明中使用的结合结构域或结合单元)可以是“构象诱导”(如本文定义的)配体,意味着所述配体在与嵌合gpcr(即嵌合gpcr上的
细胞内结合位点)结合时能够稳定和/或诱导嵌合gpcr的功能性和/或活性构象状态。如本文还进一步描述的,这种构象诱导配体还能够诱导形成和/或稳定由gpcr(其在所述复合体中优选处于功能性、活性和/或可成药状态),构象诱导的细胞内配体和细胞外配体(特别是当细胞外配体可以作为gpcr上的激动剂时)形成的复合体。
[0083]
在特定实施方案中,(细胞内或细胞外)配体可以是“构象选择性配体”或“构象特异性配体”,意指此类配体以构象选择性方式结合蛋白质或gpcr。如本文进一步描述的,与蛋白质可能采用的其他构象相比,构象选择性配体以更高的亲和力结合蛋白质的特定构象。为了说明的目的,作为激动剂的细胞外配体是活性构象选择性配体的示例,而作为反向激动剂的细胞外配体是无活性构象选择性配体的示例。为清楚起见,中性拮抗剂不被视为构象选择性配体,因为中性拮抗剂不区分gpcr的不同构象。
[0084]
如本文所用,“正构配体”是指与gpcr的活性位点结合的配体(天然的和合成的),并根据它们的功效或换言之它们通过特定途径对信号传导的作用进一步分类。如本文所用,“激动剂”是指通过结合受体蛋白(例如gpcr)而增加受体的信号传导活性的配体。完全激动剂能够最大程度地刺激蛋白质;即使在饱和浓度下,部分激动剂也不能引发完全活性。部分激动剂还可以通过阻止更稳健的激动剂的结合而起到“阻断剂”的作用。“拮抗剂”,也称为“中性拮抗剂”,是指结合受体而不刺激任何活性的配体。“拮抗剂”也称为“阻断剂”,因为它能够阻止其他配体的结合,从而阻断激动剂诱导的活性。此外,“反向激动剂”是指一种拮抗剂,其除了阻断激动剂作用外,还将受体的基础活性或组成型活性降低到低于未配体(unliganded)蛋白的活性。
[0085]
如本文所用的配体也可以是具有选择性刺激受体信号传导活性子集的能力的“偏向配体(biased ligand)”,例如在gpcr的情况下选择性激活g-蛋白或β-抑制蛋白功能。这种配体被称为“偏向配体”、“偏向激动剂”或“功能选择性激动剂”。更具体地,配体偏向可以是不完美偏向,特征在于多种受体活性的配体刺激,对不同信号具有不同的相对功效(非绝对选择性);或者可以是完美偏向,特征在于一种受体蛋白质活性的配体刺激,而没有另一种已知的受体蛋白活性的任何刺激。
[0086]
另一种配体称为变构调控剂。如本文所用,“变构调控剂”或其他“变构调节剂”、“变构配体”或“效应分子”是指在gpcr的变构位点(即,与蛋白质的活性位点物理上不同的调控位点)处结合的配体。与正构配体相反,变构调节剂是非竞争性的,因为它们在不同位点结合受体蛋白并改变它们的功能,即使内源性配体也正在结合。增强蛋白质活性的变构调控剂在本文中称为“变构激活剂”或“正变构调节剂”(pam),而降低蛋白质活性的变构调控剂在本文中称为“变构抑制剂”或“负变构调节剂”(nam)。
[0087]
如本文所用,术语“确定”、“测量”、“评估”、“测定”可互换使用并且包括定量和定性确定。
[0088]
术语“抗体”旨在表示能够结合抗原的免疫球蛋白或其任何片段。术语“抗体”还指单链抗体和仅具有一个结合结构域的抗体。
[0089]
如本文所用,抗体上下文中的术语“互补决定区”或“cdr”是指h(重)或l(轻)链的可变区(也分别缩写为vh和vl)并且包含能够特异性结合抗原靶标的氨基酸序列。这些cdr区解释了抗体对特定抗原决定簇结构的基本特异性。这样的区域也被称为“高变区”。cdr代表可变区内的非邻近氨基酸段,但无论物种如何,已发现在可变重链和轻链区内这些关键
氨基酸序列的位置在可变链的氨基酸序列中具有相似的位置。所有经典抗体的可变重链和轻链均具有3个cdr区,对于相应的轻(l)和重(h)链,每个区都与其他区不邻近(称为l1、l2、l3、hi、h2、h3)。免疫球蛋白单可变结构域,特别是纳米抗体,通常包含可被认为包含4个“构架序列或区域”或fr和3个“互补决定区”或cdr的单氨基酸链。纳米抗体具有3个cdr区域,每个区域与其他区域不邻近(称为cdr1、cdr2、cdr3)。如本文所述,为了表示vhh、纳米抗体或confobody中的氨基酸位置/残基cdr,将遵循kabat编号系统,并且构架和cdr是基于abm定义而定义的(除非另有明确说明)。
[0090]
通常,为了本文公开及其所附权利要求的目的,相比于使用相同测定或模型在基本相同条件下但不存在所述化合物时测量的相同值或参数,当在合适的测定或模型中化合物的存在(即以合适的量或浓度,例如生物活性量或浓度)改变所述测定或模型的合适或预期读数(即,可以使用所述测定或模型确定的至少一个合适的值或参数)至少0.1%,例如至少1%,例如至少10%和直至50%或更多时,则本发明的化合物将被视为靶标的“调节剂”,或“调节”靶标(和/或信号传导、途径、作用机制和/或涉及所述靶标的所述生物学、生理学和/或药理学功能)。再次,所述调节可导致所述值或参数的增加或减少(即,增加或减少前一句中给出的百分比)。此外,本发明的化合物优选能够以剂量依赖性方式调节所述靶标、信号传导、途径、作用机制和/或所述生物学、生理学和/或药理学功能,即在或超过(over)测定或模型中使用的化合物的至少一个浓度范围内。
[0091]
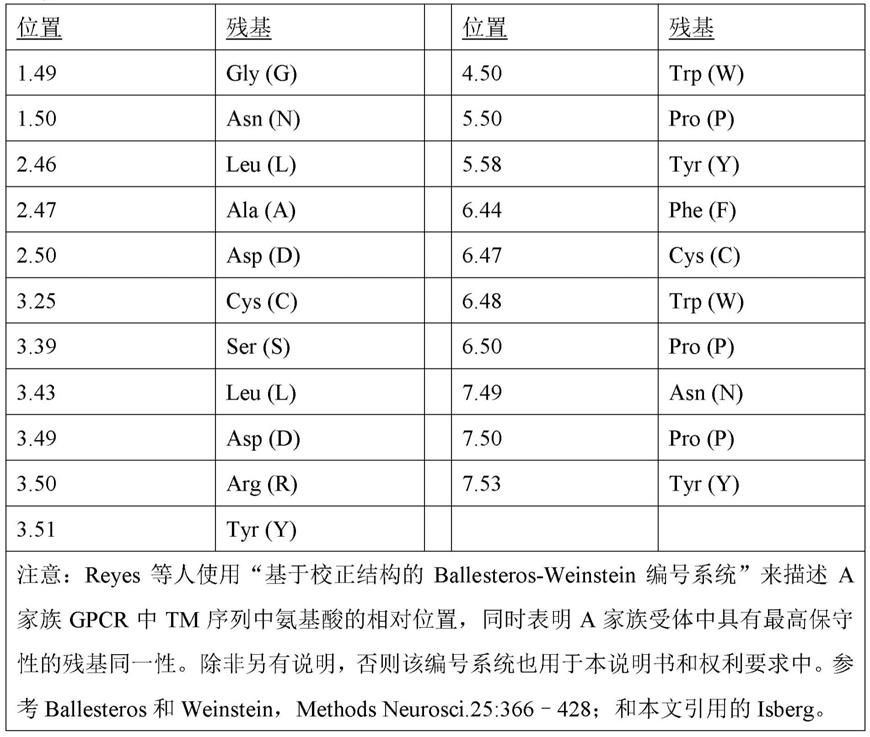
有许多现有技术参考文献讨论了gpcr的序列和结构。除了本文已经引用的现有技术之外,这些包括mirzadegan和benko,biochemistry.2003年3月18日;42(10):2759-2767;arakawa等人,biochimica et biophysica acta 1808(2011)1170-1178;han等人,febs open bio 5(2015)182-190;sanchez-reyes等人,biophysical journal 112,2315-2326,2017年6月6日2315;和kochman,postepy hig med dosw(在线).2014年10月31日;68:1225-37。mirzadegan和benko给出了基于同源性的多重序列分析结果,这些分析是对a家族的270个gpcr(其中153个是具有未知配体的孤儿gpcr)进行的。他们指出,a家族的gpcr的长度在290到951个氨基酸残基之间变化,大多数受体的长度约为310到470个残基。他们还指出gpcr的特征在于一组分布在七个螺旋结构域中的保守残基,这有助于gpcr序列之间的多重比对。这些保守残基(在本领域有时也称为“特征残基”)位于螺旋i(gly和asn)、螺旋ii(leu和asp)、螺旋iii(cys和aspargtyr)、螺旋iv(trp和pro)、螺旋v(pro和tyr)、螺旋vi(phe、trp和pro)和螺旋vii(npxxy基序的asn、pro和tyr)中。sanchez-reyes等人在表s1中还列出了gpcr特征残基及其在家族a中的保守程度,这些特征残基位于以下位置:
[0092]
表a:a家族gpcr中的特征残基(根据sanchez-reyes等人,2017年):
[0093][0094]
例如,在arakawa等人的图1中,这些特征残基中的大多数也以红色表示,该图示意性地显示了它们在β-肾上腺素能受体的整体结构中的位置。
[0095]
作为表a的替代,各种特征残基的位置可以通过它们与所选经典gpcr中特定残基的相对关系来理解。因此,当检查特定gpcr中的位置时,可以参考经典gpcr的整体结构中的相对位置,以确定所考虑的残基是否存在于特定gpcr上的该位置。如果将人β2ar(uniprot p07550(adrb2_human),参见seq id no:17和图22)作为基础gpcr,那么——特征残基可以描述为:
[0096]-在相对于adrb2_human的氨基酸50的位置处的gly;
[0097]-在相对于adrb2_human的氨基酸51的位置处的ans;
[0098]-在相对于adrb2_human的氨基酸75的位置处的leu;
[0099]-在相对于adrb2_human的氨基酸76的位置处的ala;
[0100]-在相对于adrb2_human的氨基酸79的位置处的asp;
[0101]-在相对于adrb2_human的氨基酸106的位置处的cys;
[0102]-在相对于adrb2_human的氨基酸120的位置处的ser;
[0103]-在相对于adrb2_human的氨基酸124的位置处的leu;
[0104]-在相对于adrb2_human的氨基酸130的位置处的asp;
[0105]-在相对于adrb2_human的氨基酸131的位置处的arg;
[0106]-在相对于adrb2_human的氨基酸132的位置处的tyr;
[0107]-在相对于adrb2_human的氨基酸158的位置处的trp;
[0108]-在相对于adrb2_human的氨基酸211的位置处的pro;
[0109]-在相对于adrb2_human的氨基酸219的位置处的tyr;
[0110]-在相对于adrb2_human的氨基酸282的位置处的phe;
[0111]-在相对于adrb2_human的氨基酸285的位置处的cys;
[0112]-在相对于adrb2_human的氨基酸286的位置处的trp;
[0113]-在相对于adrb2_human的氨基酸288的位置处的pro;
[0114]-在相对于adrb2_human的氨基酸322的位置处的asn;
[0115]-在相对于adrb2_human的氨基酸323的位置处的pro;和
[0116]-在相对于adrb2_human的氨基酸326的位置处的tyr。
[0117]
如本文所述,本发明旨在提供一种方法,用于对所需的gpcr提供测定和筛选技术,该技术不需要针对所述特定gpcr(的细胞内部分)生成或产生构象特异性vhh,并且从而避免现有技术方法的任何问题或限制,这些问题或限制可能与需要以分离的和适当纯化的形式以及用于筛选和选择目的(并且当要使用原始文库时,用于免疫和展示目的)的所需构象提供所需gpcr相关。
[0118]
本发明通常通过提供本文所述的嵌合蛋白并通过将所述嵌合蛋白与对嵌合蛋白的细胞内环(由其形成的结合位点)(如本文进一步描述的)特异性的结合结构域或结合单元一起使用来实现该目的。此类嵌合gpcr在其如本文所述的各个方面和实施方案中形成本发明的第一方面,并且所述嵌合蛋白(其在本文中也称为“本发明的嵌合蛋白”或“本发明的嵌合gpcr”,这些术语在本文中可互换使用),可以结合嵌合gpcr的此类结合结构域或结合单元,以及它们在本发明中的用途如本文中进一步描述的。
[0119]
通常,如本文进一步描述的,本发明的嵌合蛋白具有源自第一gpcr的其氨基酸序列的至少一个或多个部分和源自第二gpcr(与第一gpcr不同)的其序列的至少一个或多个其他部分。特别地,本发明的嵌合蛋白具有(至少)源自第一gpcr的细胞外环和源自第二gpcr(不同于第一gpcr)的细胞内环。
[0120]
优选地,所述第一和所述第二gpcr都是天然存在的gpcr。此外,当本发明用于发现或开发药物时,至少第一gpcr和优选还有第二gpcr是天然存在于人体中的gpcr(即在存在于人体中的至少一个细胞的表面上),特别是在待用化合物、配体或其他治疗实体治疗的受试者体内(即在存在于所述受试者体内的至少一个细胞的表面上),所述化合物、配体或其他治疗实体已使用本文所述的嵌合蛋白和方法发现和/或开发,例如为了治疗或预防的目的(如本文进一步描述的,本发明的一种优选用途是产生可以调节(如本文所定义的)ecl所源自的“第一”gpcr的化合物)。
[0121]
尽管通常且优选地,本发明的嵌合蛋白将基本上由(和/或仅由)源自第一或第二gpcr的氨基酸残基段组成,但不排除在本发明的范围之外,本发明从最广泛的意义上讲,本发明的嵌合蛋白还将适当地包含一段或多段源自一种或多种其他gpcr的氨基酸残基、一段或多段源自其他蛋白质的氨基酸残基(尽管这通常不太优选)和/或一段或多段合成或半合成的氨基酸残基,例如通过将一个或多个突变(如本文定义)引入已被从第一或第二(或另一个)gpcr获得的氨基酸残基段。
[0122]
本发明的嵌合蛋白通常且优选地包含n-末端序列、c-末端序列、7个跨膜结构域(tm)、3个细胞外环(ec或ecl)和3个细胞内环(ic或icl)。更优选地,在本发明的嵌合蛋白
中,整个序列的这些部分被排列成对于天然存在的gpcr最常见的结构,即如下(从n-末端到其c-末端):
[0123]
[n末端序列]-[tm1]-[ic1]-[tm2]-[ec1]-[tm3]-[ic2]-[tm4]-[ec2]-[t m5]-[ic3]-[tm6]-[ec3]-[tm7]-[c末端序列]。
[0124]
特别地,在本发明的嵌合蛋白中,至少一个(例如至少两个)细胞外环源自第一gpcr并且至少一个(例如至少两个)细胞内环源自第二gpcr(不同于第一gpcr)。
[0125]
最优选地,在本发明的嵌合蛋白中,所有三个(或基本上所有三个)细胞外环源自第一gpcr并且所有三个(或基本上所有三个)细胞内环源自第二gpcr(不同于第一gpcr)。这应该被理解为意味着细胞外环优选地与所述细胞外环所源自的(第一)gpcr的细胞外环相比具有不超过2个,更优选地不超过1个,最优选地没有氨基酸差异(如本文所定义),并且细胞内环优选地与所述细胞内环所源自的(第二)gpcr的细胞内环相比具有不超过2个,更优选地不超过1个,最优选地没有氨基酸差异(如本文所定义)。
[0126]
存在于本发明嵌合蛋白中的tm优选全部基本上源自相同的gpcr。更优选地,存在于本发明嵌合蛋白中的tm使得它们与细胞外环一起形成功能性配体结合位点,特别是紧密相似于和/或模拟细胞外环所源自的(第一)gpcr的细胞外配体的结合位点的配体结合位点。通常在本发明中,并且优选地,这意味着tm基本上与第一gpcr相同和/或基本上源自第一gpcr(除了,如本文进一步描述的并且取决于icl是如何提供/插入到嵌合gpcr中,它们可能在与icl相邻的tm7位置包含一些与第二gpcr相同和/或源自第二gpcr的氨基酸残基)。特别地,源自第一gpcr的本发明的嵌合gpcr的序列部分可以使得它们形成细胞外配体的功能性结合位点,该结合位点与嵌合序列的所述部分所源自的第一gpcr的细胞外结合位点基本相同和/或非常相似。
[0127]
优选地,嵌合gpcr中的每个tm与存在于所述tm所源自的天然存在的gpcr中的相应tm的氨基酸序列相比具有不超过4个,更优选不超过3个,例如不超过2个,特别是不超过1个,最优选没有氨基酸差异(不考虑在icl相邻的位置中的与第二gpcr中存在和/或源自第二gpcr中氨基酸残基相同的任何氨基酸残基)。
[0128]
此外,当考虑在icl相邻的位置中的与第二gpcr中存在和/或源自第二gpcr中氨基酸残基相同的任何氨基酸残基时,每个这样的tm优选地具有与来自所述tm所源自的天然存在的gpcr的相应tm的氨基酸序列相比至少80%,更优选地至少85%,例如至少90%,例如超过95%和高达并包括100%的序列同一性(同样也取决于每个tm中有多少氨基酸残基与第二gpcr相同和/或源自第二gpcr)。当不考虑在icl相邻的位置中的与第二gpcr中存在和/或源自第二gpcr中氨基酸残基相同的任何氨基酸残基时,每个这样的tm优选地具有与来自所述tm所源自的天然存在的gpcr的相应tm的氨基酸序列相比至少90%,更优选地至少95%,例如至少98%,并且高达并包括100%的序列同一性。
[0129]
本发明的嵌合蛋白的n末端序列通常源自与tm中的第一个相同的gpcr(并且如本文所述,在本发明的实践中,这通常并且优选地是第一gpcr)。c-末端序列通常也源白与tm7相同的gpcr(并且如本文所述,在本发明的实践中,这将再次通常并且优选地是第一gpcr)。然而,c-末端部分也可能源自第二gpcr,并且使用第二gpcr的c末端部分可能会提高表达水平和/或其他特性(即与相同的但具有来自第一gpcr的c末端序列的嵌合gpcr相比)。
[0130]
在本发明的一个方面,源自第一gpcr的氨基酸序列和源自第二gpcr的氨基酸序列
都源自属于相同类别或家族的gpcr(换言之,在本发明中,第一和第二gpcr优选属于相同类别的gpcr家族)。因此,当使用来自iuphar数据库(截至2019年1月)的标准分类时,第一和第二gpcr均优选属于a类(视紫质样)、b类(胰泌素受体家族)、c类(代谢型谷氨酸)或f类(卷曲/平滑的)(因为本发明主要针对脊椎动物,特别是人类的应用,来自d类和e类的gpcr序列通常不会在本发明中找到任何应用)。当使用来自脊椎动物的gpcr的“grafs”分类时,第一和第二gpcr都优选属于谷氨酸家族、视紫质家族、粘附家族、卷曲家族或胰泌素家族。然而,令人惊讶的是,从本文所示的实验数据中可以看出,本发明还可以提供和/或使用本发明的嵌合gpcr,其中ec和tm基本上源自一个类别或家族的gpcr并且icl基本上源自另一个类别或家族。
[0131]
优选地,icl源自属于a类(视紫质样)的gpcr(根据截至2019年1月的iuphar数据库分类)。此外,ecl、tm以及c-末端和n-末端序列也优选源自属于a类(视紫质样)的gpcr。因此,更一般地,在本发明中,第一gpcr优选地是属于a类的gpcr并且第二gpcr优选地是属于a类的gpcr。还参考实验部分,其中使用icl和特异于所述icl的vhh的一些特别优选的组合。
[0132]
例如但不限于,一方面,icl可以从β-2-肾上腺素能受体(adrenegic receptor)获得,并且结合结构域可以是与β-2-肾上腺素能受体的icl结合的isvd,例如国际申请2012/007593中描述的isvd,其还提供了关于β-肾上腺素能受体是构象诱导(如本文定义)的特定vhh的序列和cdr,例如ca2780(wo2012/007593中的seq id no:4和本文中的seq id no:20),也称为“nb80”,也用于以下实验部分)。
[0133]
在另一非限制性的方面,icl可以从阿片样物质受体(特别是μ-阿片样物质受体)获得,并且结合结构域可以是与阿片样物质受体(特别是μ-阿片样物质受体)的icl结合的isvd,例如国际申请2015/121092中描述的isvd,该国际申请2015/121092还提供了关于μ-阿片样物质受体是构象诱导(如本文定义)的特定vhh的序列和cdr,例如x8633(wo2014/118297中的seq id no;19和本文中的seq id no:21),也用于以下实验部分。
[0134]
所使用的icl优选进一步这样(并且被并入本发明的嵌合gpcr中)使得它们形成功能性结合位点,特别是用于本发明方法中的结合结构域或结合单元的功能性结合位点(该结合结构域或结合单元,如本文进一步描述的,最优选是构象诱导结合结构域或结合单元,并且特别是构象诱导isvd,例如confobody)。更具体地说,所使用的icl与嵌合gpcr的其余部分一起形成(部分)构象表位,即取决于嵌合gpcr的构象状态改变其“形状”(例如其几何和/或空间布置)的表位或结合位点,例如当嵌合gcpr经历构象变化时,例如从无活性或活性较低状态到活性、活性较高和/或功能性状态的构象变化,和/或当第一配体与嵌合gpcr上的细胞外结合位点结合时发生的构象变化(基本上类似于天然存在的gpcr可以经历的构象变化,例如当它被激动剂结合时)。
[0135]
此外,所使用的icl还优选地是这样的(并且被并入本发明的嵌合gpcr中),使得它们形成功能性(细胞内)结合位点,其模拟所述icl所源自的天然存在的gpcr上的相应结合位点。特别地,所使用的icl可以是模拟icl所源自的天然存在的gpcr的g-蛋白结合位点。因此,在一个特定方面,本发明的嵌合蛋白使得其icl形成(或形成一部分的)g蛋白或g蛋白复合体的功能性结合位点,如本文进一步描述的。通常,在本发明中,本发明的嵌合蛋白将使得其icl形成(或形成一部分的)功能性结合位点,该功能性结合位点既是g蛋白或g蛋白复合体的功能性结合位点,又是针对所述icl产生的特异性vhh的功能性结合位点。
[0136]
因此,通常,本发明的嵌合gpcr将包含至少两个不同的配体结合位点,即至少:
[0137]-第一配体结合位点,其最优选地精密地(closely)模拟或基本上对应细胞外环(并且优选地还有tm)所源自的gpcr上的细胞外配体结合位点。对于gpcr通常已知,所述配体结合位点可由一个或多个ecl和/或一个或多个tm形成,但不包括icl。本发明的嵌合gpcr上的所述配体结合位点在本文中也通常被称为“细胞外结合位点”。如本文进一步描述的,并且本领域技术人员也将清楚,通常(并且优选地)本发明的嵌合gpcr上的所述细胞外结合位点将对应于ecl(并且优选地还有tm)所源自的第一gpcr的正构结合位点(尽管如本文所述,本文所使用的术语“细胞外结合位点”在其最广泛的意义上也包括合适的变构结合位点);和
[0138]-第二配体结合位点,其包含至少一个(优选至少两个,例如所有三个)icl。如本文所述,所述配体结合位点应该使得其能够被本发明中使用的蛋白质结合结构域(特别是isvd)结合。此外,优选地,所述配体结合位点包含和/或模拟g-蛋白结合位点。本发明的嵌合gpcr上的该配体结合位点在本文中也通常被称为“细胞内结合位点”。
[0139]
然而,应当注意,对于天然存在的gpcr本身也是已知的(例如参考eglen和reisine,本文中引用),取决于本发明的嵌合gpcr中存在的ecl和tm,本发明的嵌合gpcr除了对应于第一gpcr的正构结合位点的结合位点之外还包含一个或多个变构结合位点。优选地,当ecl和tm都源自第一gpcr时,本发明的嵌合gpcr还包含与第一gpcr基本上相同的变构结合位点。因此,设想本发明还可用于鉴定、产生、筛选、测试和/或开发针对变构结合位点的化合物和配体。正如eglen和reisine(在此引用)所讨论的,这种变构结合剂可能是针对正构结合位点的配体和化合物的有价值的替代品,特别是对于治疗用途。
[0140]
因此,应当理解,虽然本说明书和权利要求中使用的术语“细胞外结合位点”优选地指的是正构结合位点(即,ecl所源自的gpcr的正构结合位点),术语“细胞外结合位点”在其最广泛的意义上还包括变构结合位点,特别是在ecl所源自的gpcr中,当所述gpcr处于其天然细胞环境中时延伸出(如本文所定义)至细胞外环境中的变构结合位点。
[0141]
分别关于术语“细胞外结合位点”和“细胞内结合位点”,还应当理解,这些术语的使用并不意味着或暗示本发明的嵌合gpcr需要存在于细胞内环境。相反,这些结合位点由这些术语指代,分别是因为嵌合gpcr上的细胞外结合位点通常被提供以便基本上对应和/或精密地模拟ecl(通常还有tm)所源自的天然存在的gpcr的细胞外结合位点(即至少正构位点和还任选地一个或多个变构位点,如果存在的话),和因为嵌合gpcr上的细胞内结合位点通常会被提供以便基本上对应和/或精密地模拟icl所源自的天然存在的gpcr的细胞内结合位点。
[0142]
因此,一方面,本发明涉及如本文进一步描述的嵌合gpcr,其包含如本文进一步描述的细胞外结合位点和如本文进一步描述的细胞内结合位点。
[0143]
本发明进一步涉及嵌合gpcr,其包含(基本上)源自第一gpcr的细胞外结合位点和(基本上)源自第二gpcr(不同于第一gpcr)的细胞内结合位点。本发明还涉及包含这种嵌合gpcr的组合物,该组合物可以如本文进一步描述的那样。本发明进一步涉及一种组合物,其包含这样的嵌合gpcr并且进一步包含能够特异性结合所述嵌合gpcr上的细胞内结合位点的结合结构域或结合单元。同样,这样的组合物可以如本文进一步描述的,并且存在于所述组合物中的结合结构域或结合单元优选是构象诱导的(如本文定义)结合结构域或结合单
元,更优选构象诱导的isvd(例如confobody)。
[0144]
本发明进一步涉及嵌合gpcr,其包含源自第一gpcr的ecl和tm和源自第二gpcr(不同于第一gpcr)的icl,该ecl和tm使得嵌合gpcr包含(功能性)细胞外结合位点,该位点(基本上)对应(和/或精密地模拟)所述第一gpcr的细胞外结合位点,该icl使得其形成(一部分的)功能性细胞内结合位点。本发明进一步涉及一种组合物,其包含这样的嵌合gpcr并且进一步包含能够特异性结合所述嵌合gpcr上的细胞内结合位点的结合结构域或结合单元。同样,这样的组合物可以如本文进一步描述的,并且存在于所述组合物中的结合结构域或结合单元优选是构象诱导的(如本文定义)结合结构域或结合单元,更优选构象诱导的isvd(例如confobody)。
[0145]
在另一方面,本发明涉及一种组合物,其至少包含:
[0146]
a)包含n术端序列、c末端序列、7个跨膜结构域(tm)、3个细胞外环和3个细胞内环的嵌合蛋白,其中:
[0147]-嵌合蛋白中存在的细胞外环(基本上)源自第一gpcr;和
[0148]-嵌合蛋白中存在的细胞内环(基本上)源自第二gpcr;
[0149]
和
[0150]
b)结合结构域或结合单元,其可以特异性结合存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点),该结合结构域或结合单元优选是构象诱导的(如本文定义的)结合结构域或结合单元,更优选构象诱导的isvd(例如confobody)。
[0151]
在这样的组合物中,嵌合蛋白和结合结构域或结合单元优选地如本文进一步描述的。
[0152]
一方面,结合结构域或结合单元可以与嵌合蛋白融合,基本上如国际申请wo2014/118297中所述,其描述了gpcr和confobody的融合及其用途。因此,在另一方面,本发明涉及包含本发明的嵌合gpcr的融合蛋白,该嵌合gpcr直接或通过合适的接头或间隔物并且优选在其c末端融合到如本文进一步描述的结合结构域或结合单元(该结合结构域或结合单元优选为构象诱导的结合结构域或结合单元,并且优选为构象诱导的isvd)。
[0153]
在另一方面(也如本文所述),本发明涉及包含本发明的嵌合gpcr的融合蛋白,该嵌合gpcr直接或通过合适的接头或间隔物融合到结合结构域或结合单元,其中该结合结构域或结合单元是至少包含第一和第二结合成员的结合对的第一结合成员,当所述第一和第二结合成员彼此接触或紧密接近时,该结合对可以产生可检测的信号。
[0154]
在更一般的方面,本发明涉及包含本发明的嵌合gpcr和至少一个另外的氨基酸序列、蛋白质或肽(例如至少一个结合结构域或结合单元)的融合蛋白。
[0155]
还如本文进一步描述的,包含本发明的嵌合蛋白(并且优选地还有本文所述的结合结构域或结合单元)的组合物可以是细胞、细胞系或源自细胞或细胞系的合适的级分或制剂(例如膜级分)、包含一种或多种细胞器的细胞级分或合适的细胞裂解物(此类细胞和源自此类细胞的级分在本文中也称为“细胞组合物”)。这样的组合物也可以是脂质体、小泡或其他合适的脂质体组合物,其可以包含天然或合成的脂质或其组合,包括但不限于病毒样脂质颗粒、脂质层(双层和单层)、脂质小泡、高密度脂质颗粒(例如nanodisks)等。通常,该组合物是这样的,并且嵌合gpcr将以这样的方式存在于所述组合物中,使得gpcr可以呈现作为gpcr特征的桶状三级结构。通常,这将意味着gpcr将以使得gpcr可以呈现作为gpcr
特征的桶状三级结构的方式适当地关联(例如适当地锚定在或锚定于)组合物的一种或多种其他组分例如细胞壁、细胞膜、细胞壁或细胞膜的片段、脂质体或小泡的壁,或脂质双层。而且,组合物通常是这样的,并且嵌合gpcr将以这样的方式存在于所述组合物中,使得至少在gpcr的大小范围内,gpcr的细胞外结合位点通过细胞壁、细胞膜或其他层(如脂双层)(的至少一部分或片段)与细胞内结合位点分开。
[0156]
如本文所述,存在于所述组合物中的本发明的嵌合蛋白优选具有以下总体结构(从n-末端到c-末端):
[0157]
[n末端序列]-[tm1]-[ic1]-[tm2]-[ec1]-[tm3]-[ic2]-[tm4]-[ec2]-[t m5]-[ic3]-[tm6]-[ec3]-[tm7]-[c末端序列]。
[0158]
优选地,本发明的嵌合蛋白使得至少在本发明的嵌合gpcr用于测定或筛选目的时的应用的条件下,其tm可以呈现为天然存在的gpcr(中的7tm)的特征的桶状结构。再次参考本文引用的现有技术。
[0159]
优选地,在所述组合物中存在的嵌合蛋白中:
[0160]-嵌合蛋白中存在的细胞外环形成功能性配体结合位点(可选地与一个或多个tm一起);和
[0161]-嵌合蛋白中存在的细胞内环形成结合结构域或结合单元可以结合的功能性配体结合位点,并且特别是构象依赖性的功能性配体结合位点(如本文所述)。
[0162]
此外,优选地,在存在于所述组合物中的嵌合蛋白中,存在于嵌合蛋白中的tm均源自(或基本上源自,如本文进一步描述的)相同的gpcr。更优选地,嵌合蛋白中存在的tm源自(或基本上源自,如本文进一步描述的)细胞外环所源自的相同的(第一)gpcr。
[0163]
此外,优选地,嵌合蛋白中存在的细胞外环与所述细胞外环所源自的第一gpcr的细胞外环相比具有不超过2个,优选不超过1个,更优选没有氨基酸差异。
[0164]
如本文所述,当本发明用于鉴定、选择、产生、测试或开发旨在用于人类治疗和/或预防用途的配体或化合物时,源自第一gpcr的本发明的嵌合蛋白的序列部分和源自第二gpcr的本发明的嵌合蛋白的序列部分优选都源自存在于人体内的gpcr。
[0165]
此外,优选地,嵌合蛋白中存在的细胞外环与所述细胞外环所源自的第一gpcr的细胞外环相比具有不超过2个,优选不超过1个,更优选没有氨基酸差异(如本文所定义的)。此外,优选地,嵌合蛋白中存在的细胞内环与所述细胞内环所源自的第二gpcr的细胞内环相比具有不超过2个,优选不超过1个,更优选没有氨基酸差异。
[0166]
此外,优选地,嵌合蛋白中存在的每个tm与来自所述tm所源自的天然存在的gpcr的相应tm的氨基酸序列具有至少80%,更优选至少85%,例如至少90%,例如超过95%和高达并包括100%的序列同一性(考虑在icl相邻的位置中的与第二gpcr中存在和/或源自第二gpcr中氨基酸残基相同的任何氨基酸残基,如本文进一步所述)。同样,优选地,嵌合gpcr中存在的每个tm与所述tm所源自的天然存在的gpcr中的相应tm的氨基酸序列相比具有不超过7个,优选不超过5个,例如5、4、3、2、1个,或没有氨基酸差异(在这种情况下,不考虑在icl相邻的位置中的与第二gpcr中存在和/或源自第二gpcr中氨基酸残基相同的任何氨基酸残基,如本文进一步所述)。
[0167]
此外,优选地,当嵌合蛋白包含在icl相邻的位置中的与第二gpcr中存在和/或源自第二gpcr中氨基酸残基相同的氨基酸残基(本文也称为“icl侧翼残基”)时,则所述嵌合
蛋白优选包含在每个icl旁边(即,分别在紧邻相关icl的第一个氨基酸残基或相关icl的最后一个氨基酸残基的位置)不超过10个,优选不超过7个,例如不超过5个,例如5、4、3、2或1个这样的icl侧翼残基。此外,优选地,任何此类icl侧翼残基(如果存在)将与在所述icl所源自的第二gpcr中相关icl侧翼的氨基酸残基相同或基本相同。此外,如果源自第二gpcr的任何此类icl侧翼残基存在于嵌合gpcr中,它们将优选与来自第二gpcr的相关icl的氨基酸序列邻接。总的来说,这意味着,示意性表示,所述icl和取自第二gpcr的任何icl侧翼残基将从n末端到c末端具有以下结构(以粗体/下划线表示):
[0168]
[7tm]-[icl侧翼残基,如果有的话]-[icl]-[icl侧翼残基,如果有的话]-[7tm]。
[0169]
其中,来自(反过来)位于icl侧翼残基侧翼的相关7tm的氨基酸序列取自第一gpcr。例如还参考非限制性图16a-16c和17,它们给出了本发明的嵌合gpcr的实例。
[0170]
优选地,当一起考虑时,每个icl和任何icl侧翼残基与相关icl和icl侧翼残基所源自的第二gpcr中的氨基酸序列的相应部分相比基本上没有氨基酸差异(如本文所定义)。然而,在本发明的嵌合蛋白中,由取自第二gpcr的icl和任何icl侧翼残基形成的每一氨基酸残基段与所述序列的所述部分所源自的第二gcpr中的相应氨基酸残基段相比具有一些氨基酸差异(包括置换、突变或缺失),但对于每个这样的一段icl侧翼残基和icl优选不超过5个氨基酸差异,例如5、4、3、2或1个氨基酸差异。而且,如本文所述,每个icl本身将优选地与所述细胞内环所源自的(第二)gpcr的细胞内环具有不超过2个、更优选地不超过1个、并且最优选地不具有氨基酸差异(如本文定义的)。
[0171]
还应注意,对于每个icl每次都可以独立选择以下各项:对于每个icl,是否存在任何icl侧翼残基,此类icl侧翼残基存在于icl的哪一侧(即在n末端,在c末端,或两者),存在多少个icl侧翼残基(如果有),以及由每个icl和任何icl侧翼残基形成的氨基酸残基段是否包含与第二gpcr中的相应的氨基酸残基段相比的任何氨基酸差异(如果有,有多少氨基酸差异和哪些氨基酸差异,以及在序列中的位置)。
[0172]
此外,虽然通常优选任何icl侧翼残基替换相关icl连接的tm相应位置上的氨基酸残基,但也可能由每个icl和位于所述icl侧翼的任何icl侧翼残基形成的氨基酸残基段适当地插入到第一gpcr的序列中,来自第二gpcr的icl替换来自第一gpcr的相应icl,并且来自第二gpcr的任何icl侧翼残基被插入到序列或替换tm中的一些(但不是全部)氨基酸残基,这些氨基酸残基在第一个gpcr中位于相关icl的侧翼。此外,在嵌合gpcr的最终序列中,存在于由每个icl及其icl侧翼序列(如果有的话)形成的序列部分中的任何氨基酸差异可以源自第一gpcr的氨基酸序列(例如,因为来自第二gpcr的一个或多个icl侧翼氨基酸残基被存在于第一gpcr的氨基酸序列中相应位置的氨基酸残基取代),但也有可能嵌合gpcr的最终序列在这些位置包含一个或多个其他氨基酸差异(或源自第一gpcr的一个或多个氨基酸差异与一个或多个其他氨基酸差异的合适组合)。
[0173]
本领域技术人员也将清楚,gpcr中位于每个icl侧翼的一些氨基酸残基段在某些高度保守的位置含有氨基酸残基。参考上面的表a,其中列出了家族a gpcr中的一些所谓的“特征残基”。
[0174]
本领域技术人员将清楚,优选地,靠近icl的位置中的这种高度保守的氨基酸残基也优选地在本发明的嵌合gcpr中是保守的,特别是当所述保守的氨基酸残基也存在于第一和第二gpcr时。因此,一方面,嵌合gpcr在一个合适的组合中将优选地包含一个或多个,例
如至少5个,优选至少10个,更优选至少15个,例如15、16、17、18、19、20或所有21个上面表a中列出的特征残基。
[0175]
优选地,本发明的嵌合gpcr在指定位置至少包含以下氨基酸残基:
[0176]-g在位置1.49,和n在位置1.50;
[0177]-l在位置2.46,和a在位置2.47;
[0178]-d在位置3.49,和r在位置3.50;
[0179]-w在位置4.50;
[0180]-p在位置5.50,和y在位置5.58;
[0181]-f在位置6.44,c在位置6.47和p在位置6.50;
[0182]
并且优选另外至少1个(例如1、2、3、4、5、6、7、8或9个),更优选至少5个(例如5、6、7、8或9个)另外的在序列中相关位置处的表a中列出的特征氨基酸残基。
[0183]
在相对于人β2ar(uniprot p07550(adrb2_human)的位置方面重申,优选地,本发明的嵌合gpcr在所示位置处至少包含以下氨基酸残基:
[0184]-相对于adrb2_human位置50的g和位置51的n;
[0185]-相对于adrb2_human位置75的l和位置76的a;
[0186]-相对于adrb2_human位置130的d和位置131的r;
[0187]-相对于adrb2_human在位置158的w;
[0188]-相对于adrb2_human位置211的p和位置219的y;
[0189]-相对于adrb2_human位置282的f,位置285的c和位置288的p;
[0190]
并且优选另外至少1个(例如1、2、3、4、5、6、7、8或9个),更优选至少5个(例如5、6、7、8或9个)另外的在序列中相关位置处的表a中列出的特征氨基酸残基。
[0191]
为了提供本发明的嵌合gpcr的序列,第一gpcr的氨基酸序列中的icl(以及任选的一些icl侧翼残基)应该被来自第二gpcr的icl(以及任选的一些icl侧翼残基)替换。这可以使用本身已知的重组dna技术来完成。此外,基于本文提供的信息,再次使用本身已知的重组dna技术,可以设计嵌合gpcr的氨基酸序列(例如,以第一和第二gpcr的氨基酸序列或这些序列的比对为起点),然后可以通过合成编码所述嵌合gpcr的核苷酸序列并通过在合适的宿主生物中表达所述核苷酸序列来产生相应的嵌合gpcr。
[0192]
不管如何提供本发明的嵌合gpcr(即其中来自第一gpcr的icl和任选地任何icl侧翼残基被来自第二gpcr的icl和任选地任何icl侧翼残基替换的特定方式),优选地本发明的嵌合gpcr是这样的:
[0193]
a)在第一gpcr中形成icl1的氨基酸残基和任选的一个或多个存在于第一gpcr的氨基酸序列中位于(并包括)位置1.49和1.50之间的位置(相对于adrb2_human的第50和51位的位置)处的另外的氨基酸残基,其在大多数情况下提到的是gn;和位置2.50(相对于adrb2_human第79位的位置)的另外的氨基酸残基,其在大多数情况下提到的是d;(适当地)被在第二gpcr中形成icl1的氨基酸残基和任选地一个或多个存在于第二gpcr的氨基酸序列中位于(并包括)位置1.49和1.50之间以及位置2.50的位置处的另外的氨基酸残基替换;或者
[0194]
b)在第一gpcr中形成icl2的氨基酸残基和任选的一个或多个存在于第一gpcr的氨基酸序列中位于(并包括)位置3.49和3.50之间的位置(相对于adrb2_human的第130和
131位的位置)处的另外的氨基酸残基,其在大多数情况下提到的是dr;和位置4.50(相对于adrb2_human第158位的位置)的另外的氨基酸残基,其在大多数情况下提到的是w;(适当地)被在第二gpcr中形成icl2的氨基酸残基和任选地一个或多个存在于第二gpcr的氨基酸序列中位于(并包括)位置3.49和3.50之间以及位置4.50的位置处的另外的氨基酸残基替换;或者
[0195]
c)在第一gpcr中形成icl3的氨基酸残基和任选的一个或多个存在于第一gpcr的氨基酸序列中位于(并包括)位置5.50之间的位置(相对于adrb2_human的第211位的位置)处的另外的氨基酸残基,其在大多数情况下提到的是p;和位置6.50(相对于adrb2_human第288位的位置)的另外的氨基酸残基,其在大多数情况下提到的是p;(适当地)被在第二gpcr中形成icl3的氨基酸残基和任选地一个或多个存在于第二gpcr的氨基酸序列中位于(并包括)5.50和位置6.50之间的位置处的另外的氨基酸残基替换;
[0196]
并且优选使得至少a)和b)、至少a)和c)或至少b)和c)适用,并且最优选a)、b)和c)全部适用。
[0197]
基于本文的公开内容以及第一gpcr的氨基酸序列与第二gpcr的氨基酸序列之间的比对和比较,技术人员将能够选择可以适当地被来自第二gpcr的一个或多个icl侧翼残基“替换”的第一gpcr中的一个或多个icl侧翼残基(除了相关的icl以外),可选地在有限程度的试错之后。例如但不限于,从第一gpcr和第二gpcr的氨基酸序列之间的比对,技术人员可以衍生出相同和/或在第一和第二gpcr的氨基酸之间看起来保守的氨基酸残基和/或位置并且此类残基/位置可用于指导icl和任何icl侧翼残基的替换/插入。例如但不限于,基于对来自gpcr数据库(https://gpcrdb.org/)的约60个gpcr序列的比较,看起来位置1.52、1.53(相对于adrb2_human的第53和54位的位置),位置2.46和2.47(相对于adrb2_human的第75和76位的位置)的la基序和位置6.44和6.47(相对于adrb2_human的第282和285位的位置)(该位置6.44和6.47以及位置6.50处的p可以形成fxxcxxp基序)可以在给定的第一gpcr和给定的第二gpcr之间保守,并且这样的保守残基可以指导icl和任何icl侧翼残基的替换/插入。
[0198]
还应该注意的是,来自第二gpcr的氨基酸残基段和被来自第二gpcr的氨基酸残基的所述段“替换”的来自第一gpcr的氨基酸残基的(相应)段不需要长度相同,尤其是当涉及到icl3时,众所周知,icl3在不同gpcr之间,甚至在同一家族的gpcr之间长度不同。
[0199]
一般认为,本发明的嵌合蛋白与对存在于所述嵌合蛋白中的icl特异的isvd(这些isvd如下文进一步描述)的组合可以找到多种用途,特别是在以下方面的应用中:正在使用gpcr和构象诱导的结合结构域或结合单元的那些组合(特别是gpcr和构象诱导的isvd的组合)。这些包括但不限于本文和wo2012/007593、wo2012/007594、wo2012/175643、wo2014/118297、wo2014/122183和wo 2014/118297中描述的各种应用和用途。如本文进一步描述的,此类应用和用途还包括如在受让人于2019年4月29日提交的、题为“screening methods and assays for use with transmembrane proteinns,in particular with gpcrs”的共同未决的美国临时申请和受让人的相同名称的共同未决的pct申请中描述的方法和装置中的用途,该共同未决的pct申请与本技术具有相同的国际申请日并援用与本技术相同的优先权申请。
[0200]
基于本文的公开内容,本领域技术人员将清楚进一步的应用和用途。
[0201]
特别地,设想本发明的嵌合蛋白与对存在于所述嵌合蛋白中的icl以及含有并在适当情况下表达此类嵌合蛋白的细胞、细胞系、细胞组合物、小泡、脂质体和其他组合物具有特异性的构象诱导的结合结构域或结合单元(并且优选此类结合结构域或结合单元)的组合将在各种测定技术和筛选方法中找到应用和用途,更特别地用于鉴定、筛选、产生、测试和开发特异于、针对和/或可用于调节ecl(以及通常基本上所有的tm,如本文所述)所源自的gpcr的化合物和配体。因此,本发明的嵌合蛋白与对存在于所述嵌合蛋白中的icl特异的构象诱导的结合结构域或结合单元的组合,可用于此类测定和筛选方法,作为以下的替代方案:(即替换)在此类方法(例如wo2012/007593,wo2012/007594,wo 2012/175643,wo2014/118297,wo2014/122183和wo 2014/118297中描述的那些)中使用的(非嵌合)gpcr(以及对此类非嵌合gpcr的icl具有特异性的isvd)。这意味着,与使用天然存在的gpcr和针对所述天然存在的gpcr的icl的构象诱导的isvd相比,本发明为技术人员提供了一种替代的途径,以提供针对所需天然存在的gpcr的测定和筛选方法,该途径不需要针对所述天然存在的gpcr(的icl)必须出现构象诱导的isvd,从而避免可能与需要这样做相关的任何实践问题或技术限制(如本文所述)。还设想在某些情况下,用另一gpcr的icl替换所需的天然存在的gpcr的icl可能会产生比原始的非嵌合gpcr更实用的嵌合gpcr(例如在表达、折叠、纯化和/或稳定性方面),特别是在用于测定和筛选技术的条件下。
[0202]
因此,总的来说,设想本发明将不仅为技术人员提供针对建立涉及gpcr的测定和筛选方法的替代途径(该替代方法甚至在某些方面可能比相应的涉及使用相应的天然存在的gpcr的方法更实用或更容易建立或实施),而且还可以使建立用于gpcr的分析和筛选方法成为可能,这些方法目前由于技术可行性的潜在的问题,使用天然存在的或非嵌合gpcr基本上不可能或难以实现。
[0203]
本发明中使用的结合结构域或结合单元应该能够结合(并且应该与icl一起被选择能够结合)本发明的嵌合gpcr中的至少一个icl,并且优选地至少两个,例如基本上所有三个icl。特别地,本发明中使用的结合结构域或结合单元应该结合,并且优选特异性结合,嵌合gpcr上的细胞内结合位点(如本文所定义),该细胞内结合位点可以包含1个、2个或基本上所有这样的icl。
[0204]
优选地,结合结构域或结合单元在与嵌合gpcr(即,与嵌合gpcr上的细胞内结合位点)结合时能够稳定和/或诱导嵌合gpcr的功能性和/或活性构象状态。这种结合结构域或结合单元在本文中也称为“构象诱导”结合结构域或结合单元或“构象稳定”结合结构域或结合单元(这些术语在本文中可互换使用)。特别地,这样的构象诱导结合结构域或结合单元可以是这样的:它在与嵌合gpcr(即与嵌合gpcr上的细胞内结合位点)结合时能够稳定和/或诱导嵌合gpcr的可成药(如本文定义的)构象状态。
[0205]
通常,这意味着构象诱导结合结构域或结合单元将对嵌合gpcr的至少一种功能性构象状态具有特异性(即,与嵌合gpcr的至少一种其他非功能性构象状态相比)和/或对嵌合gpcr的至少一种活性或活性较高的构象状态具有特异性(即,与嵌合gpcr的至少一种无活性或活性较低的构象状态相比)。优选地,构象诱导结合结构域或结合单元对嵌合gpcr的至少一种可成药构象状态具有特异性(即,与不可成药或较少可成药的嵌合gpcr的至少一种其他构象状态相比)。
[0206]
特别地,构象诱导结合结构域或结合单元可以是使得当所述嵌合gpcr被激动剂结
合结合时,其可以优先结合本发明的嵌合gpcr(即,结合如本文定义的细胞内结合位点),即,使得其优先结合当本发明的嵌合gpcr与激动剂结合时所采用的构象(即与结合当本发明的嵌合gpcr未被激动剂结合和/或当它被反向激动剂和/或拮抗剂结合时所采用的至少一种构象相比)。
[0207]
此外,构象诱导结合结构域或结合单元优选增强嵌合gpcr对激动剂的亲和力,更优选至少两倍,甚至更优选至少五倍,例如至少十倍。
[0208]
此外,不受任何特定假设或机制的限制,构象诱导结合结构域或结合单元优选是这样的,即在结合嵌合gpcr(即如本文定义的细胞内结合位点)时,它能够稳定和/或诱导包含结合结构域或结合单元、嵌合gpcr和结合嵌合gpcr的细胞外结合位点(如本文定义)的化合物或配体的复合体的形成。特别地,构象诱导结合结构域或结合单元可以是这样的,在结合嵌合gpcr(即如本文定义的细胞内结合位点)时,它能够稳定和/或诱导包含结合结构域或结合单元、嵌合gpcr和结合嵌合gpcr的细胞外结合位点(如本文定义)的激动剂的复合体的形成。
[0209]
优选地,构象诱导结合结构域或结合单元源自免疫球蛋白。更优选地,构象诱导结合结构域或结合单元是具有免疫球蛋白折叠并包含4个构架区和3个互补决定区的氨基酸序列。更优选地,构象诱导结合结构域或结合单元是免疫球蛋白单可变结构域,例如源自骆驼科动物抗体的isvd,例如vhh或纳米抗体。构象诱导结合结构域或结合单元也可以是来自这种免疫球蛋白的合适片段。能够诱导或稳定gpcr的功能性、活性和/或可成药构象状态的isvd(和/或对gpcr的功能性、活性和/或可成药构象状态具有特异性)例如从wo2012/007593、wo2012/007594、wo2012/175643、wo2014/118297、wo2014/122183和wo2014/118297是已知的,并且此类isvd(也称为confobody)可在本发明中用作与嵌合gpcr组合的构象诱导结合结构域或结合单元,该嵌合gpcr包含来自针对其产生相关confobody的gpcr的icl(再次参考wo2012/007593、wo2012/007594、wo2012/175643、wo2014/118297、wo2014/122183和wo2014/118297)。
[0210]
结合结构域或结合单元可以本身使用(即作为不同的结合蛋白,例如作为单价vhh)或者它可以是包含一个或多个其他氨基酸序列、结合结构域或结合单元的大蛋白的一部分。例如但不限于,并且如本文进一步描述的,当本发明的嵌合蛋白和结合结构域或结合单元在以下提及的于2019年4月29日提交的、题为“screening methods and assays for use with transmembrane proteins,in particular with gpcrs”的共同未决的美国临时申请中描述的方法和装置中使用时,结合结构域或结合单元可以形成用于所述方法和装置中的“第二融合蛋白”的一部分。如本文进一步描述的,在这样的第二融合蛋白中,结合结构域或结合单元可以直接或经由合适的间隔物或接头连接至结合成员,该结合成员是可以产生可检测的信号的结合对的一部分。jacobs等人int.j.mol.sci.,2019,20,2597的出版物中的图3也显示了类似的装置。
[0211]
此外,如本文所述,在一方面,结合结构域或结合单元可与本发明的嵌合蛋白融合,基本上如国际申请wo2014/118297中所述。
[0212]
本发明还涉及这样的结合结构域或结合单元诱导本发明的嵌合gpcr中构象变化的用途(如本文进一步描述的)。特别地,本发明还涉及这种结合结构域或结合单元的用途,其诱导本发明的嵌合gpcr中功能性、活性和/或可成药构象状态和/或稳定本发明的嵌合
gpcr的这种构象状态。
[0213]
本发明进一步涉及这种结合结构域或结合单元的用途,其诱导形成和/或稳定包含所述结合结构域或结合单元和本发明的嵌合gpcr的复合体。这种复合体可以进一步包含结合到嵌合gpcr上的细胞外结合位点(如本文定义的)的配体或化合物(该配体或化合物也可以如本文进一步描述的,并且特别可以是激动剂)。特别地,本发明进一步涉及这种结合结构域或结合单元的用途,其诱导形成和/或稳定其中本发明的嵌合gpcr处于功能性、活性和/或可成药构象状态的复合体。在一个特定的方面,本发明还涉及这种结合结构域或结合单元的用途,其诱导在本发明的嵌合gpcr中(如本文进一步所述的)形成和/或稳定其中本发明的嵌合gpcr处于配体结合的(优选激动剂结合的)构象状态的复合体。
[0214]
在另一方面,本发明涉及一种复合体,其包含:
[0215]
a)包含n末端序列、c末端序列、7个跨膜结构域(tm1至tm7)、3个细胞外环(ec1至ec3)和3个细胞内环(ic1至ic3)的嵌合蛋白,其中:
[0216]-嵌合蛋白中存在的细胞外环(基本上)源自第一gpcr;和
[0217]-嵌合蛋白中存在的细胞内环(基本上)源自第二gpcr;
[0218]
和:
[0219]
b)可以与存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)特异性结合的结合结构域或结合单元;
[0220]
和任选地:
[0221]
c)与嵌合gpcr上的细胞外结合位点(如本文所定义)结合的配体或化合物。
[0222]
在另一方面,本发明涉及这样的复合体,其包含所有三个a)下提及的嵌合gpcr、b)下提及的结合结构域或结合单元和c)下提及的配体或化合物。
[0223]
此外,在任何此类复合体中,结合结构域或结合单元可与嵌合蛋白融合,基本上如国际申请wo 2014/118297中所述,并且本发明还涉及包含此类融合蛋白和(任选地)与嵌合gpcr上的细胞外结合位点(如本文所定义)结合的配体或化合物的复合体。
[0224]
优选地,所述复合体中的嵌合gpcr处于功能性构象状态和/或处于活性构象变化中。特别地,所述复合体中的嵌合gpcr可能处于可成药的构象变化中。所述功能性的、活性的和/或可成药的构象状态也可以通过b)下提及的结合结构域或结合单元与嵌合gpcr的结合,通过c)下提及的配体或化合物与嵌合gpcr的结合和/或通过所述结合结构域或结合单元和化合物或配体二者与嵌合gpcr的结合来诱导。一方面,所述功能性、活性和/或可成药构象状态是由以下各项诱导的构象状态:激动剂与嵌合gpcr的结合(所述激动剂是在c)中提及的配体或化合物),任选地连同b)项下提及的结合结构域或结合单元与嵌合gpcr的结合。
[0225]
复合体中存在的结合结构域或结合单元再次优选是构象诱导的(如本文定义)结合结构域或结合单元,即在结合嵌合gpcr(即嵌合gpcr上的细胞内结合位点)时能够稳定和/或诱导嵌合gpcr的功能性和/或活性构象状态的结合结构域或结合单元。更优选地,结合结构域或结合单元将能够诱导由a)中提及的嵌合蛋白、b)中提及的结合结构域或结合单元和c)中提及的配体或化合物形成的复合体的形成和/或将能够稳定这种复合体。
[0226]
存在于所述复合体中的配体或化合物优选为完全激动剂、部分激动剂、反向激动剂或拮抗剂,更优选为完全激动剂或部分激动剂。特别地,所述配体或化合物可以是小分
子、蛋白质、肽、蛋白质支架、核酸、离子、碳水化合物或抗体,或其任何合适的片段。
[0227]
在另一方面,由a)下提及的嵌合gpcr、b)下提及的结合结构域或结合单元和(任选地)c)下提及的配体或化合物形成的复合体结合和/或固定在合适的固体支持物上。这样的复合体可以例如通过以下来形成:首先形成仅包含a)下提及的嵌合gpcr和b)下提及的结合结构域或结合单元的本发明的复合体,该复合体结合到固体支持物上,和然后使所述复合体与c)中提及的配体或化合物接触,所述配体或化合物可存在于合适的(优选液体且通常为水性)介质中。在一个特定方面,通过执行以下步骤(以指定的顺序执行)来形成这样的复合体:
[0228]-提供固定在合适的固体支持物上的上述b)中提到的结合结构域或结合单元;
[0229]-将所述固定的结合结构域或结合单元与本发明的嵌合gcpr接触(即在使得固定的结合结构域或结合单元捕获所述嵌合gpcr,优选地使得固定的结合结构域或结合单元捕获处于功能性和/或活性构象状态,更优选处于可成药构象状态的所述嵌合gpcr的条件下);和
[0230]-使由固定的结合结构域或结合单元和捕获的嵌合gpcr形成的复合体与上述c)中提到的化合物或配体接触。
[0231]
结合结构域或结合单元再次优选是构象诱导的结合结构域或结合单元(如本文所定义)并且再次优选为isvd(并且优选为构象诱导的isvd)。
[0232]
合适的固体支持物和固定技术对技术人员来说是清楚的,并且例如包括珠子、柱、载玻片、芯片或板。例如参考wo2012/007593,第55至57页。
[0233]
在另一方面,本发明涉及其上固定有复合体的固体支持物,该复合体包含a)下提及的嵌合gpcr、b)下提及的结合结构域或结合单元和任选地c)下提及的配体或化合物。
[0234]
本发明涉及其上固定有复合体的固体支持物的用途,该复合体包含a)下提及的嵌合gpcr和b)下提及的结合结构域或结合单元。特别地,本发明涉及这种固体支持物在以下方面的用途:
[0235]-鉴定、产生和/或筛选可以结合(特别是,如本文定义的特异性结合)存在于所述复合体中的嵌合gpcr的配体或化合物(例如,使用本身已知的标准筛选技术);和/或
[0236]-确定化合物或配体的至少一种特性,例如其结合(并且特别地,如本文所定义的特异性结合)存在于所述复合体中的嵌合gpcr和/或调节所述嵌合gpcr的能力(例如使用本身已知的标准测定技术)。
[0237]
本发明还涉及一种确定化合物或配体的至少一种特性的方法,该方法至少包括以下步骤:
[0238]-提供本发明的嵌合gpcr和如本文所述的结合结构域或结合单元的复合体;
[0239]-使所述复合体与所述化合物或配体接触。
[0240]
所述方法优选地还包括测量代表所述至少一种特性的至少一种信号或参数(变化)的步骤。如本文所述,所述特性可以是与本发明的嵌合gpcr和/或所述复合体结合的能力(尤其是特异性结合的能力)。所述至少一种特性也可以是调节所述嵌合gpcr的能力,例如作为嵌合gpcr的激动剂(例如部分或完全激动剂)的能力,作为嵌合gpcr的拮抗剂的能力如拮抗剂,和/或作为嵌合gpcr的反向激动剂的能力。再次,优选地,使用本发明的嵌合gpcr确定的所述至少一种特性代表与ecl(并且优选基本上还有tm,如本文进一步描述的)所源
自的天然存在的gpcr基本相同或基本相似的特性。
[0241]
同样,在所述方法中,复合体可以固定在固体支持物上。此外,结合结构域或结合单元优选是构象诱导的(如本文定义)结合结构域或结合单元,更优选是构象诱导的isvd(例如confobody)。此外,优选地,在所述复合体中,本发明的嵌合gpcr处于功能性、活性和/或可成药状态。
[0242]
此外,基于本文的公开内容,本领域技术人员也将清楚,当本发明的嵌合gpcr以及结合结构域和结合单元作为融合蛋白提供时(例如在国际申请wo2014/118297中所描述的),如本文所述的复合体也可以通过存在于所述融合蛋白中的嵌合gpcr和存在于所述融合蛋白中的结合结构域或结合单元,任选地连同如c)中提及的化合物或配体一起形成。
[0243]
在另一方面,鉴定和/或产生能够结合至gpcr的细胞外结合位点(如本文所定义)的化合物或配体的方法,所述方法包括以下步骤:
[0244]
a)提供嵌合gpcr,其基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;
[0245]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0246]
c)在允许所述结合结构域或结合单元与包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0247]
d)在允许所述测试化合物与所述嵌合gpcr的细胞外结合位点结合的条件下,使所述嵌合gpcr与一种或多种测试化合物或配体接触;
[0248]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;和任选地
[0249]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0250]
在所述方法中,嵌合gpcr和结合结构域或结合单元优选地再次如本文进一步描述的(对于本发明的嵌合gpcr,具有本文所述的任何偏好或优选方面和/或对于这种结合结构域/结合单元也优选用于所述方法)。同样,在上述步骤中提供和使用的嵌合gpcr优选地是这样的,并且优选地选择在上述步骤中使用所述嵌合gpcr和结合结构域或结合单元的条件是这样的,使得在所用条件下测试化合物与嵌合gpcr的结合代表所述测试化合物与所述gpcr的结合。此外,在这种方法中,嵌合gpcr和结合结构域或结合单元可以存在于合适的细胞组合物中和/或由合适的细胞或细胞系表达,或者它们可以存在于合适的脂质体或小泡中,所有如本文进一步描述。嵌合gpcr或结合结构域或结合单元也可固定在固体支持物上,再次如本文进一步描述。如本文和国际申请wo2014/118297中进一步描述的,嵌合gpcr或结合结构域或结合单元也可以被适当地提供和用作融合蛋白。
[0251]
还应注意,如本文所述以及本身已知的天然存在的gpcr(例如再次参考本文引用的eglen和reisine),除了对应于第一gpcr的正构结合位点的结合位点之外,本发明的嵌合gpcr可以还包含一个或多个对应于第一gpcr上的一个或多个变构结合位点的一个或多个变构位点,这取决于本发明的嵌合gpcr中存在的ecl和tm。因此,预期,更一般地,本发明还可用于鉴定、产生、筛选、测试和/或开发作为第一gpcr的正构结合剂的化合物和配体以及作为第一gpcr的变构结合剂(binder)的化合物和配体。
[0252]
因此,在另一方面,本发明涉及鉴定和/或产生能够结合至gpcr的化合物或配体的方法,所述方法包括以下步骤:
[0253]
a)提供嵌合gpcr,其包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有所述gpcr的tm,如本文进一步描述的)并且包含另一gpcr的细胞内环;
[0254]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0255]
c)在允许所述结合结构域或结合单元与包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0256]
d)在允许测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述嵌合gpcr与一种或多种测试化合物或配体接触;
[0257]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;和任选地
[0258]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0259]
在另一方面,本发明涉及鉴定和/或产生能够结合至gpcr的细胞外结合位点的化合物或配体的方法,所述方法包括以下步骤:
[0260]
a)提供嵌合gpcr,其包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有所述gpcr的tm,如本文进一步描述的),使得所述细胞外环和所述tm形成功能性细胞外结合位点,并且还包含另一gpcr的细胞内环;
[0261]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0262]
c)在允许所述结合结构域或结合单元与包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0263]
d)在允许测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述嵌合gpcr与一种或多种所述测试化合物或配体接触;
[0264]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与所述嵌合gpcr的细胞外结合位点结合;和任选地
[0265]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0266]
在另一方面,本发明涉及鉴定和/或产生能够结合gpcr的细胞外结合位点的化合物或配体的方法,所述方法包括以下步骤:
[0267]
a)提供包含以下内容的细胞或细胞系:
[0268]-在其细胞壁或细胞膜内的嵌合gpcr,其中所述嵌合gpcr包含(至少)所述gpcr的细胞外环,并且其中所述嵌合gpcr包含另一gpcr的细胞内环,并且其中所述嵌合gpcr的细胞外环延伸出(如本文所定义)至细胞外环境中,并且其中嵌合gpcr的所述细胞内环延伸出至所述细胞或细胞系的细胞内环境中;
[0269]
并进一步包含:
[0270]-与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域
或结合单元;
[0271]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外结合位点结合的条件下,使所述细胞或细胞系与一种或多种测试化合物或配体接触;
[0272]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述细胞或细胞系中的所述嵌合gpcr结合;和任选地
[0273]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0274]
在本发明的该方法中,包含所述嵌合gpcr和所述结合结构域或结合单元的细胞或细胞系可以特别地通过在使得所述细胞系表达所述嵌合gpcr(并且特别是适当地表达所述嵌合gpcr,如本文所定义)并且还表达所述结合结构域或结合单元的条件下维持或培养能够表达所述嵌合gpcr和所述结合结构域或结合单元的细胞或细胞系来提供。
[0275]
在另一方面,本发明涉及鉴定和/或产生能够结合gpcr的细胞外结合位点的化合物或配体的方法,所述方法包括以下步骤:
[0276]
a)提供包含以下内容的小泡或脂质体:
[0277]-在其壁或膜内的嵌合gpcr,其中所述嵌合gpcr包含(至少)所述gpcr的细胞外环,并且其中所述嵌合gpcr包含另一gpcr的细胞内环,并且其中所述嵌合gpcr的细胞外环延伸出(如本文所定义)至小泡或脂质体外面的环境中,并且其中嵌合gpcr的所述细胞内环延伸出至所述小泡或脂质体内的环境中;
[0278]
并进一步包含:
[0279]
a)与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0280]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述小泡或脂质体与一种或多种测试化合物或配体接触;
[0281]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述小泡或脂质体中的所述嵌合gpcr结合;和任选地
[0282]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0283]
在另一方面,本发明涉及鉴定和/或产生能够结合至gpcr的细胞外结合位点(如本文所定义)的化合物或配体的方法,所述方法包括以下步骤:
[0284]
a)提供嵌合gpcr,其基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;
[0285]
b)将所述嵌合gpcr与:
[0286]-可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;并且与
[0287]-测试化合物或配体;
[0288]
在允许在所述嵌合gpcr、所述结合结构域或结合单元和所述测试化合物或配体之间形成复合体的条件下接触;
[0289]
c)评估所述测试化合物或配体是否与所述嵌合gpcr和所述结合结构域或结合单元形成复合体;
[0290]
和任选地:
[0291]
d)选择与所述嵌合gpcr和所述结合结构域或结合单元形成复合体的一个或多个
测试化合物或配体。
[0292]
在每个所述方法以及本文所述的其他方法中,嵌合gpcr和结合结构域或结合单元优选地如本文描述的(对于本发明的嵌合gpcr,具有本文所述的任何偏好或优选方面和/或对于这种结合结构域/结合单元也优选用于所述方法)。此外,如本文所述,嵌合gpcr和结合结构域或结合单元也可适当地提供并用作融合蛋白的一部分,再次基本上如wo2014/118297中所述。
[0293]
在另一方面,本发明涉及鉴定能够结合至gpcr的功能性构象状态的化合物的方法,所述方法包括以下步骤:
[0294]
a)提供嵌合gpcr,其基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;
[0295]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元(即在与嵌合gpcr结合时能够稳定和/或诱导嵌合gpcr的功能性和/或活性构象状态的结合结构域或结合单元);
[0296]
c)在允许所述结合结构域或结合单元与嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0297]
d)在允许所述测试化合物与所述嵌合gpcr的细胞外结合位点结合的条件下,使所述嵌合gpcr与一种或多种测试化合物或配体接触;
[0298]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;和任选地
[0299]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0300]
在另一方面,本发明涉及鉴定能够结合gpcr的活性构象状态的化合物的方法,所述方法包括以下步骤:
[0301]
a)提供嵌合gpcr,其基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;
[0302]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元(即在与嵌合gpcr结合时能够稳定和/或诱导嵌合gpcr的功能性和/或活性构象状态的结合结构域或结合单元);
[0303]
c)在允许所述结合结构域或结合单元与包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0304]
d)在允许所述测试化合物与所述嵌合gpcr的细胞外结合位点结合的条件下,使所述嵌合gpcr与一种或多种测试化合物或配体接触;
[0305]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;和任选地
[0306]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0307]
在另一方面,本发明涉及鉴定能够结合gpcr的功能性构象状态的化合物的方法,
所述方法包括以下步骤:
[0308]
a)提供嵌合gpcr,其包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有所述gpcr的tm,如本文进一步描述的)并且包含另一gpcr的细胞内环;
[0309]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0310]
c)在允许所述结合结构域或结合单元与包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0311]
d)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述嵌合gpcr与一种或多种测试化合物或配体接触;
[0312]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和如和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;和任选地
[0313]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0314]
在另一方面,本发明涉及鉴定能够结合gpcr的活性构象状态的化合物的方法,所述方法包括以下步骤:
[0315]
a)提供嵌合gpcr,其包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有所述gpcr的tm,如本文进一步描述的)并且包含另一gpcr的细胞内环;
[0316]
b)提供可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0317]
c)在允许所述结合结构域或结合单元与包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点结合的条件下,使所述嵌合gpcr与所述结合结构域或结合单元接触;
[0318]
d)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述嵌合gpcr与一种或多种测试化合物或配体接触;
[0319]
e)评估在所述结合结构域或结合单元存在的情况下每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;和任选地
[0320]
f)选择在所述结合结构域或结合单元存在的情况下与嵌合gpcr结合的测试化合物或配体。
[0321]
在另一方面,本发明涉及鉴定能够结合gpcr的功能性构象状态的化合物的方法,所述方法包括以下步骤:
[0322]
a)提供包含以下内容的细胞或细胞系:
[0323]-在其细胞壁或细胞膜内的嵌合gpcr,其中所述嵌合gpcr包含(至少)所述gpcr的细胞外环,并且其中所述嵌合gpcr包含另一gpcr的细胞内环,并且其中所述嵌合gpcr的细胞外环延伸出(如本文所定义)至细胞外环境中,并且其中嵌合gpcr的所述细胞内环延伸出至所述细胞或细胞系的细胞内环境中;
[0324]
并进一步包含:
[0325]-与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0326]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述细胞或细胞系与一种或多种测试化合物或配体接触;
[0327]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述细胞或细胞系中的所述嵌合gpcr结合;和任选地
[0328]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0329]
在本发明涉及使用细胞或细胞系的该方法中,所述嵌合gpcr和所述结合结构域或结合单元可以特别地通过在使得所述细胞系表达所述嵌合gpcr(并且特别是适当地表达所述嵌合gpcr,如本文所定义)并且还表达所述结合结构域或结合单元的条件下维持或培养能够表达所述嵌合gpcr和所述结合结构域或结合单元的细胞或细胞系来提供。
[0330]
在另一方面,本发明涉及鉴定能够结合gpcr的活性功能性构象状态的化合物的方法,所述方法包括以下步骤:
[0331]
a)提供包含以下内容的细胞或细胞系:
[0332]-在其细胞壁或细胞膜内的嵌合gpcr,其中所述嵌合gpcr包含(至少)所述gpcr的细胞外环,并且其中所述嵌合gpcr包含另一gpcr的细胞内环,并且其中所述嵌合gpcr的细胞外环延伸出(如本文所定义)至细胞外环境中,并且其中嵌合gpcr的所述细胞内环延伸出至所述细胞或细胞系的细胞内环境中;
[0333]
并进一步包含:
[0334]-与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0335]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述细胞或细胞系与一种或多种测试化合物或配体接触;
[0336]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述细胞或细胞系中的所述嵌合gpcr结合;和任选地
[0337]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0338]
在本发明的该方法中,包含所述嵌合gpcr和所述结合结构域或结合单元的细胞或细胞系可以特别地通过在使得所述细胞系表达所述嵌合gpcr(并且特别是适当地表达所述嵌合gpcr,如本文所定义)并且还表达所述结合结构域或结合单元的条件下维持或培养能够表达所述嵌合gpcr和所述结合结构域或结合单元的细胞或细胞系来提供。
[0339]
在本发明涉及使用细胞或细胞系的该方法中,所述嵌合gpcr和所述结合结构域或结合单元可以特别地通过在使得所述细胞系表达所述嵌合gpcr(并且特别是适当地表达所述嵌合gpcr,如本文所定义)并且还表达所述结合结构域或结合单元的条件下维持或培养能够表达所述嵌合gpcr和所述结合结构域或结合单元的细胞或细胞系来提供。
[0340]
在另一方面,本发明涉及鉴定能够结合gpcr的功能性构象状态的化合物的方法,所述方法包括以下步骤:
[0341]
a)提供包含以下内容的小泡或脂质体:
[0342]-在其壁或膜内的嵌合gpcr,其中所述嵌合gpcr包含(至少)所述gpcr的细胞外环,并且其中所述嵌合gpcr包含另一gpcr的细胞内环,并且其中嵌合gpcr的所述细胞外环延伸出(如本文所定义)至小泡或脂质体外面的环境中,并且其中嵌合gpcr的所述细胞内环延伸出至所述小泡或脂质体内的环境中;
[0343]
并进一步包含:
[0344]-与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0345]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述小泡或脂质体与一种或多种测试化合物或配体接触;
[0346]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述小泡或脂质体中的所述嵌合gpcr结合;和任选地
[0347]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0348]
在另一方面,本发明涉及鉴定能够结合gpcr的活性构象状态的化合物的方法,所述方法包括以下步骤:
[0349]
a)提供包含以下内容的小泡或脂质体:
[0350]-在其壁或膜内的嵌合gpcr,其中所述嵌合gpcr包含(至少)所述gpcr的细胞外环,并且其中所述嵌合gpcr包含另一gpcr的细胞内环,并且其中嵌合gpcr的所述细胞外环延伸出(如本文所定义)至小泡或脂质体外面的环境中,并且其中嵌合gpcr的所述细胞内环延伸出至所述小泡或脂质体内的环境中;
[0351]
并进一步包含:
[0352]-与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;
[0353]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述小泡或脂质体与一种或多种测试化合物或配体接触;
[0354]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述小泡或脂质体中的所述嵌合gpcr结合;和任选地
[0355]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0356]
在另一方面,本发明涉及鉴定能够结合gpcr的功能性构象状态的化合物的方法,所述方法包括以下步骤:
[0357]
a)提供嵌合gpcr,其基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;
[0358]
b)将所述嵌合gpcr与:
[0359]-可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;并且与
[0360]-测试化合物或配体;
[0361]
在允许在所述嵌合gpcr、所述结合结构域或结合单元和所述测试化合物或配体之间形成复合体的条件下接触;
[0362]
c)评估所述测试化合物或配体是否与所述嵌合gpcr和所述结合结构域或结合单元形成复合体;
[0363]
和任选地:
[0364]
d)选择与所述嵌合gpcr和所述结合结构域或结合单元形成复合体的一个或多个测试化合物或配体。
[0365]
在另一方面,本发明涉及鉴定能够结合gpcr的功能性构象状态的化合物的方法,
所述方法包括以下步骤:
[0366]
a)提供嵌合gpcr,其基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;
[0367]
b)将所述嵌合gpcr与:
[0368]-可与包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点结合的结合结构域或结合单元;并且与
[0369]-测试化合物或配体;
[0370]
在允许在所述嵌合gpcr、所述结合结构域或结合单元和所述测试化合物或配体之间形成复合体的条件下接触;
[0371]
c)评估所述测试化合物或配体是否与所述嵌合gpcr和所述结合结构域或结合单元形成复合体;
[0372]
和任选地:
[0373]
d)选择与所述嵌合gpcr和所述结合结构域或结合单元形成复合体的一个或多个测试化合物或配体。
[0374]
此外,在所有这些方法中,嵌合gpcr和结合结构域或结合单元优选地再次如本文进一步描述的(对于本发明的嵌合gpcr,具有本文所述的任何偏好或优选方面和/或对于这种结合结构域/结合单元也优选用于所述方法)。同样,在上述步骤中提供和使用的嵌合gpcr优选地是这样的,并且优选地选择在上述步骤中使用所述嵌合gpcr和结合结构域或结合单元的条件是这样的,使得在所使用的条件下,测试化合物与嵌合gpcr的结合代表了所述测试化合物与衍生细胞外结合位点的gpcr的结合。此外,在这种方法中,嵌合gpcr和结合结构域或结合单元可以存在于合适的细胞组合物中和/或由合适的细胞或细胞系表达,或者它们可以存在于合适的脂质体或小泡中,所有如在此进一步描述。嵌合gpcr或结合结构域或结合单元也可固定在固体支持物上,再次如本文进一步描述。嵌合gpcr和结合结构域或结合单元也可适当地提供并用作融合蛋白,如本文进一步和在国际申请wo2014/118297中所述。
[0375]
本发明还涉及鉴定和/或产生能够结合gpcr的细胞外结合位点(如本文所定义)的化合物或配体的方法,所述方法包括以下步骤:
[0376]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环;和(ii)结合结构域或结合单元,其可结合至包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0377]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0378]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0379]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0380]
本发明还涉及鉴定和/或产生能够结合gpcr的细胞外结合位点(如本文所定义)的化合物或配体的方法,所述方法包括以下步骤:
[0381]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含所述gpcr的细胞外环
和所述gpcr的tm(或基本上所有的所述gpcr的tm,如本文进一步所述)并且包含另一gpcr的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0382]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0383]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0384]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0385]
本发明还涉及形成嵌合gpcr、结合结构域或结合单元、以及能够结合所述嵌合gpcr上的细胞外结合位点(如本文所定义)的化合物或配体的复合体的方法,所述方法包括以下步骤:
[0386]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含(至少)第一gpcr的细胞外环和第二gpcr(不同于所述第一gpcr)的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0387]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点。
[0388]
本发明还涉及鉴定和/或产生能够结合gpcr的功能性构象的化合物或配体的方法,所述方法包括以下步骤:
[0389]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含(至少)所述gpcr的细胞外环和第二gpcr(不同于所述第一gpcr)的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0390]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0391]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0392]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0393]
本发明还涉及鉴定和/或产生能够结合gpcr的活性构象的化合物或配体的方法,所述方法包括以下步骤:
[0394]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含(至少)所述gpcr的细胞外环和第二gpcr(不同于所述第一gpcr)的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0395]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0396]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0397]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0398]
本发明还涉及鉴定和/或产生能够结合gpcr的功能性构象的化合物或配体的方法,所述方法包括以下步骤:
[0399]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含所述gpcr的细胞外结合位点(如本文所定义的)并且包含另一gpcr的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0400]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0401]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0402]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0403]
本发明还涉及鉴定和/或产生能够结合gpcr的活性构象的化合物或配体的方法,所述方法包括以下步骤:
[0404]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含所述gpcr的细胞外结合位点(如本文所定义的)并且包含另一gpcr的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0405]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0406]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0407]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0408]
本发明还涉及鉴定和/或产生能够结合gpcr的功能性构象的化合物或配体的方法,所述方法包括以下步骤:
[0409]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有的所述gpcr的tm,如本文进一步所述)并且包含另一gpcr的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0410]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0411]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0412]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0413]
本发明还涉及鉴定和/或产生能够结合gpcr的活性构象的化合物或配体的方法,所述方法包括以下步骤:
[0414]
a)提供组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有的所述gpcr的tm,如本文进一步所述)并且包含另一gpcr的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元是构象诱导的(如本文定义的)结合结构域或结合单元;
[0415]
b)在以下条件下使所述组合物与一种或多种测试化合物或配体接触:(i)允许所述结合结构域或结合单元结合包含至少一个所述细胞内环的嵌合gpcr上的所述结合位点;和(ii)允许所述测试化合物结合所述嵌合gpcr的细胞外结合位点;
[0416]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与嵌合gpcr结合;在所述组合物中;和任选地
[0417]
d)选择与所述组合物中的嵌合gpcr结合的测试化合物或配体。
[0418]
此外,在所有这些方法中,存在于所使用的化合物中的嵌合gpcr和结合结构域或结合单元优选地再次如本文进一步描述的(对于本发明的嵌合gpcr,具有本文所述的任何偏好或优选方面和/或对于这种结合结构域/结合单元也优选用于所述方法)。同样,存在于使用的化合物中的嵌合gpcr和在上述步骤中使用组合物的条件优选地选择是这样的,使得在所使用的条件下,测试化合物与嵌合gpcr的结合代表了所述测试化合物与细胞外结合位点所源自的gpcr的结合。嵌合gpcr或结合结构域或结合单元也可固定在固体支持物上,再次如本文进一步描述。嵌合gpcr和结合结构域或结合单元也可适当地提供并用作融合蛋白,如本文进一步和在国际申请wo2014/118297中所述。
[0419]
此外,在使用包含本发明嵌合gpcr和可与所述嵌合gpcr的细胞内结合位点结合的结合结构域或结合单元的组合物的方法中,所述组合物可为如本文所述的细胞组合物,或该组合物可包含在合适的脂质体或小泡中,该脂质体或小泡适当地包含(如本文所述)嵌合gpcr和结合结构域或结合单元。
[0420]
在进一步的方面,本发明还涉及:
[0421]-组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含(至少)第一gpcr的细胞外环和第二gpcr(不同于所述第一gpcr)的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元优选是构象诱导的(如本文定义的)结合结构域或结合单元;
[0422]-组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含(至少)第一gpcr的细胞外结合位点和第二gpcr(不同于所述第一gpcr)的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元优选是构象诱导的(如本文定义的)结合结构域或结合单元;
[0423]-组合物,该组合物包含(i)嵌合gpcr,该嵌合gpcr包含第一gpcr的细胞外环和所述第一gpcr的tm(或基本上所有的所述第一gpcr的tm,如本文进一步所述)并且包含第二gpcr(不同于所述第一gpcr)的细胞内环;和(ii)结合结构域或结合单元,其可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点,其中所述结合结构域或结合单元优选
是构象诱导的(如本文定义的)结合结构域或结合单元。
[0424]
本发明还涉及此类组合物的用途,特别是在本文所述的方法中的用途。
[0425]
所述组合物可以是如本文所述的细胞组合物,或者所述组合物可包含在合适的脂质体或小泡中,所述脂质体或小泡适当地包含(如本文所述)嵌合gpcr和结合结构域或结合单元。同样,存在于使用的所述组合物中的嵌合gpcr和结合结构域或结合单元优选地再次如本文进一步描述的(对于本发明的嵌合gpcr,具有本文所述的任何偏好或优选方面和/或对于这种结合结构域/结合单元也优选用于所述方法)。此外,嵌合gpcr或结合结构域或结合单元也可固定在固体支持物上,再次如本文进一步描述。嵌合gpcr和结合结构域或结合单元也可适当地提供并用作融合蛋白,如本文进一步和在国际申请wo2014/118297中所述。
[0426]
如本文所述,在本发明的一些优选方面,本发明的嵌合gpcr存在于合适的细胞或细胞系中和/或由其表达。
[0427]
因此,在另一方面,本发明涉及包含、表达和/或能够表达本发明的嵌合gpcr的细胞或细胞系。这样的细胞或细胞系优选地使得所述嵌合gpcr存在于(即锚定在)所述细胞或细胞系的细胞膜或细胞壁中和/或使得所述细胞或细胞系合适地表达(如本文所定义)所述嵌合gpcr。更优选地,所述细胞或细胞系是(和/或能够表达嵌合gpcr)使得本发明的嵌合gpcr跨越所述细胞或细胞系的细胞膜或细胞壁,使得细胞外环延伸出至细胞外环境内并且细胞内环延伸出至所述细胞或细胞系的细胞内环境内。在本技术和权利要求的上下文中,当一个或多个ecl被称为“延伸出”至环境内(例如细胞的细胞外环境或脂质体或小泡外面的环境)时,这通常应理解为意指所述ecl暴露于所述环境和/或对于存在于所述环境中的配体、化合物或其他化学实体的结合是可及的。特别地,对于本发明的嵌合gpcr,这意味着嵌合蛋白的细胞外结合位点(如本文所定义)对于存在于所述环境中的配体、化合物或其他化学实体的结合是可及的。类似地,当一个或多个icl被称为“延伸出”至环境内(例如细胞的细胞内环境或脂质体或小泡内部的环境)时,这通常应理解为意指所述icl暴露于所述环境和/或对于存在于所述环境中的配体、化合物或其他化学实体的结合是可及的。在这方面,还应注意,措辞“对于结合是可及的”通常应理解为存在于相关环境中的配体、化合物或其他化学实体可以结合在嵌合gpcr上或内的结合口袋或结合位点,即使实际结合位点或结合口袋位于嵌合gpcr结构的深处(更深处)(甚至使得实际结合位点或结合口袋位于嵌合蛋白的一部分内,该部分本身不会物理延伸超出边界层)。例如,参考chevillard的出版物(在此引用),该出版物显示用于在fbdd筛选技术中使用的片段的gpcr上的结合位点可能位于gpcr结构的深处(参见例如第1120页的图2)而不是位于gpcr的表面,但仍对于片段结合是可及的。还参考了本文引用的一些其他科学参考文献中关于gpcr结构、gpcr信号传导机制和gpcr配体结合位点的教导。
[0428]
包含或表达本发明嵌合gpcr的细胞或细胞系优选进一步包括表达和/或能够表达可特异性结合存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)的结合结构域或结合单元。同样,存在于所述细胞或细胞系中和/或由所述细胞或细胞系表达的这种结合结构域或结合单元优选是构象诱导的(如本文定义)结合结构域或结合单元,更优选构象诱导的isvd(例如confobody)。此外,优选地,所述细胞或细胞系使得它含有或表达所述结合结构域或结合单元,使得所述结合结构域或结合单元可以结合本发明嵌合gpcr的细胞内结合位点(如本文所定义)(这对技术人员而言将是清楚的,通常是指所述细胞或细胞系在其细
胞内环境中含有或表达所述结合结构域或结合单元)。
[0429]
包含或表达本发明的嵌合gpcr(并且优选地还有可以特异性结合存在于所述嵌合蛋白中的细胞内环的结合结构域或结合单元)的这种细胞或细胞系通常可以如本文进一步描述的。
[0430]
本发明还涉及包含、表达或能够表达本发明的嵌合gpcr的细胞或细胞系的用途。特别地,本发明还涉及包含、表达或能够表达本发明的嵌合gpcr的细胞或细胞系在以下方面中的用途:
[0431]-鉴定、产生和/或筛选可以结合(特别是,如本文定义的特异性结合)存在于所述复合体中的嵌合gpcr的配体或化合物(例如,使用本身已知的标准筛选技术);和/或
[0432]-确定化合物或配体的至少一种特性,例如其结合(并且特别地,如本文所定义的特异性结合)存在于所述复合体中的嵌合gpcr和/或调节所述嵌合gpcr的能力(例如使用本身已知的标准测定技术)。
[0433]
对于此类用途,包含、表达和/或能够表达本发明的嵌合gpcr的细胞或细胞系可以如本文进一步描述的。优选地,所使用的细胞或细胞系使得其包含、表达或能够表达结合结构域或结合单元,所述结合结构域或结合单元可以特异性结合存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)。这样的结合结构域再次优选是构象诱导的结合结构域或结合单元(如本文所定义)并且再次优选为isvd(并且优选为构象诱导的isvd)。
[0434]
本发明还涉及一种确定化合物或配体的至少一种特性的方法,该方法至少包括以下步骤:
[0435]-提供包含、表达或能够表达本发明的嵌合gpcr的细胞或细胞系,该细胞或细胞系优选地还包含、表达或能够表达可以特异性结合存在于所述嵌合gpcr中的细胞内环(由其形成的结合位点)的结合结构域或结合单元,该结合结构域或结合单元优选为构象诱导的(如本文所定义)结合结构域或结合单元;
[0436]-将所述细胞或细胞系与所述化合物或配体接触,其中所述化合物或配体存在于细胞外环境中,并且其中所述细胞或细胞系使得嵌合gpcr上的细胞外结合位点(如本文所定义)可用于存在于细胞外环境中的化合物或配体结合/对于存在于细胞外环境中的化合物或配体结合是可及的。
[0437]
在需要时,所述方法还可以包括在这样的条件下维持或培养所述细胞或细胞系的步骤,所述条件使得所述细胞或细胞系表达(并且特别地适当地表达,如本文所定义)本发明的嵌合gpcr并且还表达所述结合结构域或结合单元,使得所述结合结构域或结合单元可以结合嵌合gpcr的icl和/或与所述嵌合gpcr以及任选地还与所述化合物或配体形成复合体(如本文所述)。
[0438]
所述方法再次优选地还包括测量代表所述至少一种特性的至少一种信号或参数(变化)的步骤。如本文所述,所述特性可以是与本发明的嵌合gpcr结合的能力(尤其是特异性结合的能力)。所述至少一种特性也可以是调节所述嵌合gpcr的能力,例如作为嵌合gpcr的激动剂(例如部分或完全激动剂)的能力,作为嵌合gpcr的拮抗剂的能力如拮抗剂,和/或作为嵌合gpcr的反向激动剂的能力。再次,优选地,使用本发明的嵌合gpcr确定的所述至少一种特性代表与ecl(并且优选基本上也是tm,如本文进一步描述的)所源自的天然存在的gpcr基本相同或基本相似的特性。
[0439]
本发明还涉及一种形成包含以下各项的复合体的方法:
[0440]
a)包含n末端序列、c末端序列、7个跨膜结构域(tm1至tm7)、3个细胞外环(ec1至ec3)和3个细胞内环(ic1至ic3)的嵌合蛋白,其中:
[0441]-嵌合蛋白中存在的细胞外环(基本上)源自第一gpcr;和
[0442]-嵌合蛋白中存在的细胞内环(基本上)源自第二gpcr;
[0443]
和:
[0444]
b)可以与存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)特异性结合的结合结构域或结合单元;
[0445]
和任选地:
[0446]
c)与嵌合gpcr上的细胞外结合位点(如本文所定义)结合的配体或化合物;
[0447]
该方法至少包括以下步骤:
[0448]-在使得所述细胞或细胞系表达所述嵌合蛋白和所述结合结构域的条件下维持或培养表达a)中提及的嵌合蛋白和b)中提及的结合结构域或结合单元的细胞或细胞系;
[0449]
并且任选地还包括以下步骤:
[0450]-将所述细胞或细胞系与c)中提及的配体或化合物接触。
[0451]
再次,所述细胞或细胞系优选地使得嵌合gpcr的细胞外环延伸出(如本文所定义)至细胞外环境中和/或使得当所述配体或化合物存在于细胞外环境中时嵌合gpcr上的细胞外结合位点可用于在c)中提及的配体或化合物结合/对在c)中提及的配体或化合物结合是可及的。同样,存在于所述细胞或细胞系中和/或由所述细胞或细胞系表达的结合结构域或结合单元优选地是构象诱导的(如本文定义)结合结构域或结合单元,更优选构象诱导的isvd(例如confobody)。此外,优选地,所述复合体中的嵌合gpcr(一旦形成)优选地处于功能性、活性和/或可成药构象。在一个特定的方面,c)中提及的配体或化合物是激动剂,并且所述复合体中的嵌合gpcr(一旦形成)处于激动剂结合的构象。
[0452]
如本文所述,设想在本发明中本发明的嵌合gpcr可以与结合结构域或结合单元融合,所述结合结构域或结合单元可以特异性结合存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)。此类融合体(fusion)及其用途可基本上如题为“novel chimeric polypeptides for screening and drug discoverypurposes”的国际申请wo2014/118297中所述,其描述了对gpcr,特别是对细胞内gpcr上的细胞内结合位点特异的gpcr和confobody的融合体。
[0453]
通常,此类融合蛋白将包含如本文所述的本发明的嵌合gpcr,该嵌合gpcr任选地通过合适的间隔物或接头融合或连接至可特异性结合存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)的结合结构域或结合单元。存在于此类融合蛋白中的间隔物或接头也可基本上如国际申请wo2014/118297中所述。此外,存在于所述融合蛋白中的嵌合gpcr和结合单元或结合结构域可以基本上如本文进一步描述的那样。特别地,结合单元或结合结构域可以是构象诱导的结合结构域或结合单元,更优选构象诱导的isvd(例如confobody)。
[0454]
本发明还涉及此类融合蛋白的用途,特别是用于测定药物发现和筛选目的。此类用途可以如本文和/或国际申请wo2014/118297中进一步描述的。对于此类用途,嵌合蛋白可在合适的细胞或细胞系(基本上如本文和国际申请wo2014/118297中所述)中表达,并且表达此类融合蛋白的细胞或细胞系形成本发明的其他方面。此外,对于此类用途,此类融合
蛋白可固定在固体支持物上(再次,基本上如本文和国际申请wo2014/118297中所述)并且固定在固体支持物上的此类融合蛋白和在其上固定有此类融合蛋白的固体支持物形成了本发明的进一步方面。
[0455]
因此,在另一方面,本发明涉及鉴定和/或产生能够结合gpcr上的细胞外结合位点的化合物或配体的方法,所述方法包括以下步骤:
[0456]
a)提供一种融合蛋白,包括:i)嵌合gpcr,该嵌合gpcr基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环,该嵌合gpcr任选地通过合适的间隔物或接头融合或连接至(ii)结合结构域或结合单元,该结合结构域或结合单元可结合至包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0457]
d)在允许所述测试化合物与存在于所述融合蛋白中的嵌合gpcr的细胞外结合位点结合的条件下,使所述融合蛋白与一种或多种测试化合物或配体接触;
[0458]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述融合蛋白中的所述嵌合gpcr结合;和任选地
[0459]
d)选择与存在于所述融合蛋白中的嵌合gpcr结合的测试化合物或配体。
[0460]
在另一方面,本发明涉及鉴定和/或产生能够结合至gpcr的化合物或配体的方法,所述方法包括以下步骤:
[0461]
a)提供一种融合蛋白,其包括:(i)嵌合gpcr,该嵌合gpcr包含所述gpcr的细胞外环和所述gpcr的tm(或基本上所有的所述gpcr的tm,如本文进一步所述)并且包含另一gpcr的细胞内环,该嵌合gpcr任选地通过合适的间隔物或接头融合或连接至(ii)结合结构域或结合单元,该结合结构域或结合单元可结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0462]
b)在允许所述测试化合物与存在于所述融合蛋白中的嵌合gpcr的细胞外结合位点结合的条件下,使所述融合蛋白与一种或多种测试化合物或配体接触;
[0463]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述融合蛋白中的所述嵌合gpcr结合;和任选地
[0464]
d)选择与存在于所述融合蛋白中的嵌合gpcr结合的测试化合物或配体。
[0465]
在其中使用这种融合蛋白的本发明方法中,存在于所述融合蛋白中的嵌合gpcr和结合结构域或结合单元再次如本文进一步描述。同样,存在于所述融合蛋白中的嵌合gpcr和在上述步骤中使用所述融合蛋白和结合结构域或结合单元的条件优选地选择是这样的,使得在所使用的条件下,测试化合物与嵌合gpcr的结合代表了所述测试化合物与所述gpcr的结合。此外,在这种方法中,融合蛋白可以存在于合适的细胞组合物中和/或由合适的细胞或细胞系表达,或者它们可以存在于合适的脂质体或小泡中,所有如在此进一步描述。融合蛋白也可固定在固体支持物上,再次如本文进一步描述。
[0466]
此外,与本文所述的其他方法一样,涉及使用此类融合蛋白的方法可用于鉴定和/或产生与存在于所述融合蛋白中嵌合gpcr上的细胞外结合位点结合的化合物或配体,和/或与嵌合gpcr上的变构位点结合的化合物或配体。
[0467]
在另一方面,本发明涉及鉴定和/或产生能够结合gpcr的细胞外结合位点的化合物或配体的方法,所述方法包括以下步骤:
[0468]
a)提供包含包含融合蛋白的细胞或细胞系,该融合蛋白包括;(i)嵌合gpcr,该嵌
合gpcr基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环,该嵌合gpcr任选地通过合适的间隔物或接头融合或连接至(ii)结合结构域或结合单元,该结合结构域或结合单元可结合至包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0469]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外结合位点结合的条件下,使所述细胞或细胞系与一种或多种测试化合物或配体接触;
[0470]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述细胞或细胞系中的所述嵌合gpcr结合;和任选地
[0471]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0472]
在本发明的该方法中,包含所述融合蛋白的细胞或细胞系尤其可以通过在这样的条件下维持或培养能够表达所述融合蛋白的细胞或细胞系来提供,所述条件使得所述细胞系表达所述融合蛋白,优选地使得融合蛋白中的嵌合gpcr变得锚定或掺入到所述细胞或细胞系的细胞壁或细胞膜中(如本文对于本发明的嵌合gpcr的一般描述),并且使得作为融合蛋白的一部分的结合结构域或结合单元在细胞内环境中表达使得它可以与嵌合蛋白上的细胞内结合位点(如本文所定义)结合。
[0473]
在另一方面,本发明涉及鉴定和/或产生能够结合gpcr的细胞外结合位点的化合物或配体的方法,所述方法包括以下步骤:
[0474]
a)提供包含融合蛋白的脂质体或小泡,该融合蛋白包括:(i)嵌合gpcr,该嵌合gpcr基本上包含(至少)所述gpcr的细胞外结合位点并且包含另一gpcr的细胞内环,该嵌合gpcr任选地通过合适的间隔物或接头融合或连接至(ii)结合结构域或结合单元,该结合结构域或结合单元可结合至包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点;
[0475]
b)在允许所述测试化合物与所述嵌合gpcr的(至少)细胞外环结合的条件下,使所述细胞或细胞系与一种或多种测试化合物或配体接触;
[0476]
c)评估每种测试化合物或配体是否(和/或所述测试化合物或配体中的哪一种)与存在于所述细胞或细胞系中的所述嵌合gpcr结合;和任选地
[0477]
d)选择与所述嵌合gpcr结合的测试化合物或配体。
[0478]
在进一步的方面,本发明还涉及包含此类融合蛋白的组合物,以及此类融合蛋白和此类组合物的用途,特别是在本文所述的方法中的用途。同样,此类组合物可以是如本文所述的细胞组合物或包含合适地含有此类融合蛋白的小泡或脂质体,如本文进一步描述的。
[0479]
本发明还设想,本发明的嵌合gpcr可用于2019年4月29日提交的题为“screening methods and assays for use with transmembrane proteins,in particular with gpcrs”的共同未决美国临时申请(本文中也称为“共同未决申请”)中描述的方法和装置中,该共同未决申请已转让给confo therapeutics nv,其公开内容以引用方式并入本文。
[0480]
共同未决申请通常描述了一种装置,该装置至少包括以下元件(均在共同未决申请中进一步定义):
[0481]-分隔第一环境和第二环境的边界层;
[0482]-跨层蛋白;
[0483]-存在于(如本文定义的)第一环境中的跨层蛋白的第一配体;
[0484]-存在于(如本文定义的)第二环境中的跨层蛋白的第二配体;和
[0485]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0486]
并且还描述了所述装置的用途(特别是用于测定和筛选技术)和使用这种装置的方法(同样可以特别是测定和筛选方法)。
[0487]
在一个特定且优选的方面,本发明的嵌合蛋白在共同未决申请中描述的装置和方法中用作跨层蛋白。
[0488]
通常,这意味着这样的装置将包含作为跨层蛋白的嵌合gpcr,其中细胞内环源自第一7tm或gpcr,而细胞外环源自与第一个不同的第二7tm或gpcr。这种嵌合蛋白的跨膜结构域可以源自第一或第二7tm或gpcr,并且优选地基本上都源自相同的gpcr,更优选地源自与细胞外环相同的gpcr(但可能包含一些来自细胞内环所源自的gpcr的氨基酸残基,取决于对于重组缺失天然细胞内环和插入替代细胞内环而选择的位置)。
[0489]
在本发明的这个方面,所得嵌合跨层蛋白应该最优选地仍使得它可以适用于如共同未决申请中所述的方法和装置中。同样,用作跨层蛋白的本发明嵌合gpcr将包含三个细胞内环和三个细胞外环,其中三个细胞内环形成第二配体的功能性配体结合位点(然后选择第二配体,使得它可以与由所述细胞内环形成的配体结合位点(9)结合)。同样,由三个细胞内环形成的结合位点将优选地延伸出至第二环境[b]内(即,当本发明的方法分别在细胞或脂质体中进行时,细胞或脂质体内的环境)和三个细胞外环将优选地延伸出至第一环境[a]内(并且可以形成第一配体的功能性结合位点,或者所述结合位点可以位于7tm结构的更深处)。
[0490]
因此,在另一方面,本发明涉及如共同未决申请中所述的装置,其中跨层蛋白是包含7个跨膜结构域、3个细胞内环和3个细胞外环(它们彼此连接并且按照7tm本身已知的顺序,即[n-末端序列]-[tm1]-[ic1]-[tm2]-[ec1]-[tm3]-[ic2]-[tm4]-[ec2]-[tm5]-[ic3]-[tm6]-[ec3]-[tm7]-c-末端序列)的7tm,其中细胞内环来自第一7tm,细胞外环来自不同于第一7tm的第二7tm,其中细胞内环形成功能性配体结合位点。优选地,来自所述跨层蛋白的tm结构域基本上源自与细胞外环相同的7tm。
[0491]
此外,所述细胞内环和7tm作为一个整体使得它们形成功能性配体结合位点,特别是(合适的)第二配体(如本文所定义)可以结合至其的功能性配体结合位点。所述配体结合位点再次优选延伸出至第二环境[b]内。
[0492]
本发明特别涉及如共同未决申请中所述的装置,其包含这样的嵌合7tm和可与由所述细胞内环形成的配体结合位点结合的第二配体。
[0493]
对于其余部分,只要适当地选择第二配体,使其能够结合嵌合跨层蛋白上的配体结合位点(9),从而提供如共同未决申请中所述的可操作装置(并且条件是嵌合跨层蛋白本身在这种装置中是可操作的),其中使用嵌合跨层蛋白的这种装置基本上可以如本文和共同未决申请中进一步描述的那样。
[0494]
本发明的另一方面是如共同未决申请中所述的组合物或部件试剂盒(kit-of-parts),其至少包含所述嵌合跨层蛋白和可与存在于所述gpcr中的细胞内环结合的配体。所述配体优选地是蛋白质,更优选地是包含免疫球蛋白单可变结构域(例如vhh结构域)或基本上由其组成的蛋白质,并且特别可以是confobody(如本文所述)。
[0495]
还应该理解的是,当在本文的进一步描述和权利要求中参考这种装置或这种装置
的任何元件时,这种装置或元件通常(并且优选地)如在共同待决的申请中进一步描述。此外,此处未具体定义的任何术语通常应理解为具有共同未决申请中阐述的含义。
[0496]
因此,在另一方面,本发明涉及至少包括以下元件(均如本文进一步定义)的装置:
[0497]-分隔第一环境和第二环境的边界层;
[0498]-跨层蛋白;
[0499]-存在于(如本文定义的)第一环境中的跨层蛋白的第一配体;
[0500]-存在于(如本文定义的)第二环境中的跨层蛋白的第二配体;和
[0501]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0502]
其中所述跨层蛋白是如本文描述的本发明的嵌合gpcr,并且其中装置的元件以本文和共同待决申请中进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。
[0503]
在这样的设置的特定方面,第二配体是本文所述的结合结构域或结合单元,即可以特异性结合存在于所述嵌合蛋白中的细胞内环(由其形成的结合位点)的结合结构域或结合单元。
[0504]
还如共同未决申请中所述,共同未决申请的装置和方法通常(并且优选地)包括使用两种融合蛋白,即包含跨层蛋白和结合对的第一结合成员的第一融合蛋白,以及包含结合对的第二成员和可直接或间接结合(如共同未决申请中所定义)跨层蛋白的蛋白质的第二融合蛋白。因此,当本发明的嵌合蛋白在这样的方法和装置中用作跨层蛋白时,它可以是这样的第一融合蛋白的一部分,与结合对的第一结合成员一起在这样的装置中使用。
[0505]
因此,在另一方面,本发明涉及包含本发明的嵌合蛋白的融合蛋白,该嵌合蛋白通过合适的接头或间隔物与结合结构域、结合单元或作为结合对成员的其他肽、蛋白质或氨基酸序列连接,该结合对如本文和共同未决申请中进一步描述的。本发明还涉及编码这种融合蛋白的核苷酸序列和/或核酸,以及表达(特别是适当地表达,如共同未决申请中所述)或能够(适当地)表达这种融合蛋白的细胞、细胞系或其他宿主细胞或宿主生物体。
[0506]
特别地,用于执行本发明的方法的装置可以至少包括以下元件:
[0507]-分隔第一环境和第二环境的边界层;
[0508]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0509]-与所述结合对的结合成员之一适当融合或连接(直接地或通过合适的接头或间隔物)的跨层蛋白(即以形成第一融合蛋白);
[0510]-存在于第一环境中的跨层蛋白的第一配体;和
[0511]-存在于第二环境中的跨层蛋白的第二配体;
[0512]
其中所述跨层蛋白是本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。如在本文和共同待决的申请中进一步描述的,结合对的第二成员可以是第二融合蛋白(其不同于包含跨层蛋白和结合对的第一结合成员的第一融合蛋白)的一部分,该第二融合蛋白进一步在本文中描述。
[0513]
更特别地,用于执行本发明的方法的装置可以至少包括以下元件:
[0514]-分隔第一环境和第二环境的边界层;
[0515]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0516]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0517]-包含可直接或间接结合跨层蛋白的蛋白和所述结合对的另一结合成员的第二融合蛋白,该第二融合蛋白存在于第二环境中;和
[0518]-存在于第一环境中的跨层蛋白的第一配体;
[0519]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。
[0520]
应该注意的是,在本说明书和权利要求中,当说配体、结合结构域、结合单元或其他化合物或蛋白质“能够结合”另一蛋白质或化合物时,这种结合最优选是如本文进一步定义的“特异性结合”。此外,如本文进一步描述的,当融合蛋白被描述为“包含”第一蛋白质、配体、结合结构域、结合成员或结合单元和第二蛋白质、配体、结合结构域、结合成员或结合单元(和任选的一个或更多其他蛋白质、配体、结合结构域、结合成员或结合单元)时,应当理解在这样的融合蛋自中,这样的蛋白质、配体、结合结构域、结合成员或结合单元直接或通过合适的间隔物或接头适当地彼此连接。
[0521]
如在共同未决申请中的一般描述,在根据共同未决申请的装置中,如果出现以下情况,则蛋白质(例如结合结构域、结合单元或配体)被称为“直接或间接”结合跨层蛋白:(i)所述蛋白质本身结合(和/或能够结合)跨层蛋白(例如结合跨层蛋白上的表位或结合位点,如本文进一步描述的);或如果(ii)所述蛋白质结合(和/或能够结合)配体或蛋白质,其中所述配体或蛋白质结合(和/或能够结合)所述跨层蛋白;或者如果(iii)所述蛋白质结合(和/或能够结合)蛋白质复合体,其中所述蛋白质复合体包含结合(和/或能够结合)所述跨层蛋白质的配体或蛋白质。在(i)的情况下,蛋白质在本文中被称为“直接”结合跨层蛋白,而在(ii)和(iii)的情况下,蛋白质在本文中被称为“间接”结合跨层蛋白。此外,当蛋白质与包含与跨层蛋白质结合的配体或蛋白质的蛋白质复合体结合时,所述蛋白质可与所述配体或蛋白质或与所述复合体的任何其他部分、表位或结合位点结合。
[0522]
当本发明的嵌合gpcr在根据共同未决申请的装置中用作跨层蛋白时,结合跨层蛋白(即:结合本发明的嵌合gpcr)的蛋白质也可选自(i)结合(和/或能够结合)跨层蛋白上的表位或结合位点的结合结构域、结合单元或其他蛋白质;(ii)结合(和/或能够结合)配体或蛋白质的结合结构域、结合单元或其他蛋白质,该配体或蛋白质结合(和/或能够结合)所述跨层蛋白;和(iii)结合(和/或能够结合)蛋白质复合体的结合结构域、结合单元或其他蛋白质,该蛋白质复合体包含结合(和/或能够结合)所述跨层蛋白质的配体或蛋白质。在每种这样的情况下,这种结合结构域、结合单元或其他蛋白质优选地如本文进一步描述的。
[0523]
当在包含本发明嵌合gpcr的此类装置中,结合跨层蛋白(即结合本发明的嵌合gpcr)的蛋白质是“间接”结合本发明的嵌合gpcr的蛋白质时,则所述蛋白质和第二配体将如共同未决申请中进一步描述的,并且该装置通常不包含如本文所述的结合结构域或结合单元(即,可与嵌合gpcr的细胞内环结合的构象诱导的结合结构域或结合单元)。
[0524]
然而,当在包含本发明嵌合gpcr的此类装置中,结合跨层蛋白(即结合本发明的嵌合gpcr)的蛋白质是“直接”结合本发明的嵌合gpcr的蛋白质时,则所述装置将包含如本文所述的结合结构域或结合单元,该结合结构域或结合单元作为“第二配体”。同样,如共同待决的申请中一般描述的,当所述蛋白“直接”结合跨层蛋白时,其优选为第二融合蛋白的一部分。因此,当该包含本发明的嵌合gpcr的此类装置也包含如本文所述的结合结构域或结合单元作为第二配体时,则所述结合结构域或结合单元最优选也形成第二融合蛋白的一部分。
[0525]
因此,在另一方面,本发明涉及包含本发明的嵌合蛋白的融合蛋白,该嵌合蛋白通过合适的接头或间隔物与结合结构域、结合单元或作为结合对成员的其他肽、蛋白质或氨基酸序列连接,该结合对如本文和共同未决申请中进一步描述的。本发明还涉及编码这种融合蛋白的核苷酸序列和/或核酸,以及表达(特别是适当地表达,如共同未决申请中所述)或能够(适当地)表达这种融合蛋白的细胞、细胞系或其他宿主细胞或宿主生物体。
[0526]
在本发明的进一步的方面,用于执行本发明的方法的装置可以至少包括以下元件:
[0527]-分隔第一环境和第二环境的边界层;
[0528]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0529]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0530]-包含可直接结合(如本文所定义)跨层蛋白的蛋白和所述结合对的另一结合成员的第二融合蛋白,该第二融合蛋白存在于第二环境中;和
[0531]-存在于第一环境中的跨层蛋白的第一配体;
[0532]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中所述蛋白是可以结合包含至少一个所述细胞内环的所述嵌合gpcr上的结合位点的结合结构域或结合单元(并且是优选地,如本文所述的构象诱导的结合结构域),并且其中所述装置的另外的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或相关联)。在本发明的这个方面中,可直接结合(如本文定义)跨层蛋白(即结合本发明的跨层蛋白)并存在于第二融合蛋白中的蛋白质优选为结合结构域或结合单元,并且更优选为免疫球蛋白单可变结构域。还应当理解,在本发明的这个方面,可直接结合(如本文定义的)跨层蛋白并且存在于第二融合蛋白中的蛋白质作为第二配体。
[0533]
在本发明的另一方面,用于执行本发明的方法的装置可以至少包括以下元件:
[0534]-分隔第一环境和第二环境的边界层;
[0535]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0536]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0537]-存在于第一环境中的跨层蛋白的第一配体;
[0538]-跨层蛋白的第二配体,它可以任选地是蛋白质复合体的一部分;
[0539]-包含可间接结合(如本文所定义)跨层蛋白的蛋白和所述结合对的另一结合成员
的第二融合蛋白,该第二融合蛋白存在于第二环境中;
[0540]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。在本发明的这个方面,第二配体可以是任何合适的配体(如本文进一步描述的)但是最优选地是g蛋白(或g-蛋白复合体),并且可间接结合(如本文定义)跨层蛋白并且存在于第二融合蛋白中的蛋白质优选是结合结构域或结合单元,并且更优选是免疫球蛋白单可变结构域。此外,当第二配体是g蛋白或g蛋白复合体时,本发明的嵌合gpcr最优选地使得其icl形成g蛋白的功能性结合位点(或形成其一部分)。还将清楚的是,在本发明的这个方面,第二配体不会形成第二融合蛋白的一部分。
[0541]
应当注意,如本文进一步描述的,在本发明的实践中,第一配体通常将被添加到如本文所述的本发明的已经形成/建立的装置的另外的元件,并且因此不存在第一配体(即在添加第一配体之前)的本发明的装置形成本发明的其他方面(如将第一配体添加到其中所述第一配体不存在或尚不存在的本发明的装置中的方法)。
[0542]
在本说明书和权利要求中,术语“第二配体”用于表示这样的配体、结合结构域、结合单元或其他化学实体:在本文所述的方法和装置中,其直接结合跨层蛋白(即结合本发明的嵌合gpcr)或能够直接结合跨层蛋白(或形成直接结合跨层蛋白或能够直接结合跨层蛋白的蛋白质复合体的一部分)。
[0543]
从本文的进一步描述可以清楚地看出,当本发明的嵌合蛋白用作本文和共同未决申请中描述的装置的一部分时,所述第二配体可以是第二融合蛋白的一部分,或者它可以是与第二融合蛋白分开。在任一情况下(即,无论第二配体是否为第二融合蛋白的一部分),第二配体优选能够结合嵌合gpcr上的构象表位(或它可以形成直接结合嵌合gpcr或能够直接结合嵌合gpcr的蛋白质复合体的一部分),并且特别地结合包含一个或多个icl的嵌合gpcr上的构象表位。更优选地,第二配体(和/或包含第二配体的蛋白质复合体)优选地是它特异性结合跨层蛋白(即本发明的嵌合gpcr)的一个或多个功能性、活性和/或可成药构象,它诱导形成和/或稳定跨层蛋白的一个或多个功能性、活性和/或可成药构象(和/或使跨层蛋白的构象平衡向一个或多个此类构象转移);和/或它诱导形成和/或稳定跨层蛋白、第一配体和第二配体的复合体。
[0544]
当第二配体是第二融合蛋白的一部分时,它可以是能够直接结合用作跨层蛋白的本发明的嵌合蛋白的icl并且能够适当地包含在第二融合蛋白中的任何配体、结合结构域、结合单元、肽、蛋白质或其他化学实体。优选地,如本文进一步描述的,当它是第二融合蛋白的一部分时,第二配体将是合适的结合结构域或结合单元,并且特别是免疫球蛋白单可变结构域(并且优选地作为如本文所定义的构象诱导的isvd)。同样,在本发明的这个方面,当本发明的嵌合gpcr与对嵌合gpcr中存在的icl特异的免疫球蛋白单可变结构域(该isvd用作存在于“第二融合蛋白”中的“第二配体”)一起用作跨层蛋白时,这避免了可能与需要以分离的和适当纯化的形式以及用于筛选和选择目的(当使用原始文库时,用于免疫和展示目的)的所需构象提供所需的gpcr相关的任何问题或限制。
[0545]
当第二配体与第二融合蛋白分开时,它可以是可以直接结合跨层蛋白(即结合本发明的嵌合gpcr)和/或可以形成结合跨层蛋白的蛋白质复合体的一部分的任何配体或蛋白质,但它优选是g-蛋白或g-蛋白复合体(特别是在本发明的那些方面,其中本发明的嵌合
gpcr中存在的icl形成g-蛋白或g-蛋白复合体的功能结合位点)。例如,如本文进一步描述的,在本发明的这些方面,第二配体可以是天然存在的g蛋白,例如,当包含本发明的嵌合gpcr的本文描述的装置存在于细胞中时,g-蛋白可以是由其中存在或表达本发明的嵌合gpcr的细胞天然表达的g-蛋白。这种第二配体也可以是天然存在的配体g蛋白的半合成或合成类似物或衍生物,或者再次当本发明的装置存在于细胞中时,它可以是在所述细胞中天然存在的g蛋白的直向同源物。此外,当第二配体不是第二融合蛋白的一部分时,第二融合蛋白将包含可以间接结合(如本文定义)跨层蛋白的结合结构域或结合单元,即可以结合第二配体和/或结合包含第二配体的蛋白质复合体的结合结构域或结合单元。同样,也如本文进一步描述的,这样的结合结合结构域或结合单元可以特别地是免疫球蛋白单可变结构域,例如源自骆驼科动物的isvd。
[0546]
如本文进一步描述的,在本发明的一个方面,包含和/或使用本发明的嵌合gpcr的如本文所述的装置可以存在于合适的细胞或细胞系中,和/或可以使用合适的细胞或细胞系进行本发明的方法,其中该合适的细胞或细胞系适当地表达本发明的嵌合gpcr和/或在存在于所述细胞或细胞系中的(可操作的)装置中包含本发明的嵌合gpcr。这样的细胞或细胞系再次可以如本文进一步描述的那样,并且还可以表达包含结合结构域或结合单元的第二融合蛋白,该结合结构域或结合单元可以与嵌合gpcr中存在的icl结合。
[0547]
在其中本发明的嵌合gpcr用作本文和共同未决申请中所述的装置的一部分的本发明的一些方面中,这种细胞或细胞系最优选地还包含和/或适当地表达(或能够适当地表达)这种装置的另外的元件,特别是以便提供在所述细胞或细胞系中可操作的装置。本发明还涉及包含和/或适当地表达(如本文定义)或能够适当地表达如本文所述的第一融合蛋白的细胞或细胞系,该第一融合蛋白包含本发明的嵌合gpcr。本发明还涉及包含和/或适当地表达或能够适当地表达如本文所述的第二融合蛋白的细胞或细胞系。在又一方面,本发明涉及包含和/或适当地表达或能够适当地表达本文所述的包含本发明嵌合gpcr的第一融合蛋白和本文所述的第二融合蛋白两者的细胞或细胞系。在其中第二配体不形成第二融合蛋白的一部分的方面和实施方案中,此类细胞或细胞系还可包含或适当地表达合适的第二配体,特别是g蛋白或其类似物或衍生物,如本文进一步描述的。
[0548]
还如本文所述,在本发明的一个方面,本文所述的包含和/或使用本发明嵌合gpcr的装置可存在于合适的脂质体或小泡中,和/或本发明的方法可使用在如本文所述的(可操作的)的装置中适当地包含本发明的嵌合gpcr的脂质体或小泡来进行。这样的小泡或脂质体可以再次如本文进一步描述的那样,并且还可以含有包含结合结构域或结合单元的第二融合蛋白,该结合结构域或结合单元可以与嵌合gpcr中存在的icl结合。
[0549]
在其中本发明的嵌合gpcr用作本文和共同未决申请中所述的装置的一部分的本发明的一些方面中,这种脂质体或小泡最优选地还包含这种装置的另外的元件,特别是以便提供可在所述脂质体或小泡中操作的装置。本发明还涉及包含如本文所述的第一融合蛋白的脂质体或小泡,该第一融合蛋白包含本发明的嵌合gpcr。本发明还涉及包含如本文所述的第二融合蛋白的细胞或细胞系脂质体或小泡。在另一方面,本发明涉及包含如本文所述的第一融合蛋白和如本文所述的第二融合蛋白二者的脂质体或小泡。在第二配体不形成第二融合蛋白的一部分的方面和实施方案中,此类脂质体或小泡还可包含合适的第二配体(其再次优选为天然存在的g蛋白或g-蛋白的合成或半合成的类似物或衍生物,特别是当本
发明的嵌合gpcr中存在的icl形成功能性g-蛋白结合位点时)。
[0550]
因此,如本文进一步描述的以及将通过所附的非限制性附图说明的,并且取决于第二配体是否是第二融合蛋白的一部分,本发明设想了其中使用本发明的嵌合gpcr的本发明的方法和装置的至少三个优选实施方案。
[0551]
在第一个这样的优选实施方案(图1中示意性所示)中,结合对的第二结合成员将适当地融合或连接(直接地或通过合适的接头或间隔物)到第二配体。根据该优选实施方案,用于执行本发明的方法的装置因此可以至少包括以下元件:
[0552]-分隔第一环境和第二环境的边界层;
[0553]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0554]-与所述结合对的结合成员之一适当融合或连接(直接地或通过合适的接头或间隔物)的跨层蛋白;
[0555]-存在于第一环境中的跨层蛋白的第一配体;和
[0556]-存在于第二环境中并适当地融合或连接(直接或通过合适的接头或间隔物)到所述结合对的另一结合成员的跨层蛋白的第二配体;
[0557]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。如本文进一步描述的,在该实施方案中,第二配体优选是结合结构域或结合单元,其可以结合包含至少一个所述细胞内环(如本文所述)的所述嵌合gpcr上的结合位点,并且更优选地是构象诱导的结合结构域或结合单元(也如本文所述)并且可以特别是isvd,更特别是构象诱导的isvd。
[0558]
特别地,如本文进一步描述的,这样的装置可以包括以下元件:
[0559]-分隔第一环境和第二环境的边界层;
[0560]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0561]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0562]-存在于第一环境中的跨层蛋白的第一配体;和
[0563]-包含跨层蛋白的第二配体和所述结合对的另一结合成员的第二融合蛋白,该第二融合蛋白存在于第二环境中;
[0564]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。如本文进一步描述的,在该实施方案中,存在于第二融合蛋白中的第二配体优选是结合结构域或结合单元,其可以结合包含至少一个所述细胞内环(如本文所述)的所述嵌合gpcr上的结合位点,并且更优选地是构象诱导的结合结构域或结合单元(也如本文所述)并且可以特别是isvd,更特别是构象诱导的isvd。
[0565]
在第二个这样的优选实施方案中(示意性地显示在图2中),结合对的第二结合成员将适当地融合或连接(直接或通过合适的接头或间隔物)至不直接结合跨层蛋白(即嵌合gpcr)而是结合第二配体(其反过来能够结合嵌合gpcr)的结合结构域或结合单元。根据该
优选实施方案,用于执行本发明的方法的装置因此可以至少包括以下元件:
[0566]-分隔第一环境和第二环境的边界层;
[0567]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0568]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0569]-存在于第一环境中的跨层蛋白的第一配体;
[0570]-存在于第二环境中的跨层蛋白的第二配体;和
[0571]-第二融合蛋白,其存在于第二环境中,并且包含能够结合第二配体的结合结构域或结合单元,该结合结构域或结合单元适当地融合或连接(直接或通过合适的接头或间隔物)至所述结合对的另一结合成员;
[0572]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。
[0573]
技术人员清楚,在该第二个实施方案中,存在于第二融合蛋白中的结合结构域或结合单元将“间接”结合跨层蛋白,即通过结合至嵌合蛋白的第二配体。同样,所述结合结构域或结合单元优选地是如本文进一步描述的免疫球蛋白单可变结构域。同样,在该实施方案中,第二配体可以是如本文进一步所述的嵌合gpcr的任何合适的配体,但是如所提及的是优选地天然存在的g蛋白或g-蛋白的合成或半合成的类似物或衍生物,特别是当本发明的嵌合gpcr中存在的icl形成功能性g-蛋白结合位点时。
[0574]
在第三优选实施方案中(示意性地显示在图3中),结合对的第二结合成员将适当地融合或连接(直接或通过合适的接头或间隔物)至结合结构域或结合单元,其中所述结合结构域或结合单元不直接结合跨层蛋白(即嵌合gpcr),而是与至少包含嵌合gpcr的第二配体的蛋白复合体结合(该蛋白质复合体可以结合嵌合gpcr或被嵌合gpcr结合和/或包含嵌合gpcr)。根据该优选实施方案,用于执行本发明的方法的装置因此可以至少包括以下元件:
[0575]-分隔第一环境和第二环境的边界层;
[0576]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0577]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0578]-存在于第一环境中的跨层蛋白的第一配体;
[0579]-至少包含跨层蛋白的第二配体的蛋白质复合体,该蛋白质复合体存在于第二环境中;和
[0580]-第二融合蛋白,其存在于第二环境中,并且包含能够结合蛋白质复合体的结合结构域或结合单元,该结合结构域或结合单元适当地融合或连接(直接或通过合适的接头或间隔物)至所述结合对的另一结合成员;
[0581]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关
联)。
[0582]
技术人员清楚,在该第三个实施方案中,存在于第二融合蛋白中的结合结构域或结合单元将“间接”结合至嵌合gpcr,即通过结合至包含第二配体的蛋白质复合体。同样,所述结合结构域或结合单元优选地是如本文进一步描述的免疫球蛋白单可变结构域,并且第二配体可以是任何合适的配体,其可以是如本文进一步描述的蛋白质复合体的一部分,但如所述优选地是g-蛋白复合体,特别是当本发明的嵌合gpcr中存在的icl形成功能性g-蛋白结合位点时。
[0583]
更一般地,包含本发明的嵌合gpcr的如本文所述的装置通常且优选地至少包括至少以下元件:
[0584]-分隔第一环境和第二环境的边界层;
[0585]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0586]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0587]-存在于第一环境中的跨层蛋白的第一配体;
[0588]-存在于第二环境中的跨层蛋白的第二配体;和
[0589]-包含所述结合对的另一结合成员的第二融合蛋白(即,使得结合对的所述另一成员也存在于第二环境中);
[0590]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中装置的元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。特别是:
[0591]-在本文所述的第一个优选实施方案中,第二融合蛋白将包含所述结合对的另一结合成员和第二配体;
[0592]-在本文所述的第二个优选实施方案中,第二融合蛋白将包含所述结合对的另一结合成员和能够结合第二配体的结合结构域或结合单元;和
[0593]-在本文所述的第三个优选实施方案中,第二融合蛋白将包含所述结合对的另一结合成员和能够结合至少包含第二配体的蛋白质复合体的结合结构域或结合单元。
[0594]
现在将通过本文的进一步描述、下面的实验部分和所附的非限制性附图来说明本发明。在图中:
[0595]
a)图1示意性地显示了本发明的第一装置,其中第二配体(在图1中表示为(4))形成第二融合蛋白(在图1所示的实施方案中,其由第二配体(4)、接头(11)和结合对(6/7)的第二成员(7)形成)的一部分,并直接结合(如本文定义)跨层蛋白(2)。在图1所示的设置中:
[0596]-边界层表示为(1);
[0597]-第一环境表示为[a];
[0598]-第二环境表示为[b];
[0599]-跨层蛋白(即本发明的嵌合gpcr)表示为(2);
[0600]-第一配体表示为(3);
[0601]-暴露于第一环境[a]并且第一配体(3)可以结合的跨层蛋白(2)上的第一结合位点表示为(8);如本文所述,跨层蛋白上的所述第一结合位点(8)是本发明嵌合gpcr上的细
胞外结合位点(如本文所定义);
[0602]-第二配体表示为(4)。如本文进一步描述的,第二配体优选是结合结构域或结合单元,其可以结合包含至少一个所述细胞内环(如本文所述)的所述嵌合gpcr上的结合位点,并且更优选地是构象诱导的结合结构域或结合单元(也如本文所述)并且可以特别是isvd,更特别是构象诱导的isvd;
[0603]-暴露于第二环境[b]并且第二配体(4)可以结合的跨层蛋白(2)上的第二结合位点表示为(9)。如本文所述,跨层蛋白上的所述第二结合位点(9)是本发明嵌合gpcr上的细胞内结合位点(如本文所定义)并且包含来自第二gpcr的至少一个icl;
[0604]-能够产生可检测信号的结合对表示为(6/7),并且由连接到跨层蛋白(2)(直接或通过接头或间隔物(10))的第一结合成员(6)和连接到第二配体(4)(直接或通过接头或间隔物(11))的第二结合成员(7)组成;
[0605]-第一融合蛋白包含直接或通过接头(10)融合至第一结合成员(6)的跨层蛋白(2);
[0606]-第二融合蛋白包含直接或通过接头(11)融合至第二结合成员(7)的第二配体(4);和
[0607]-第一和第二融合蛋白相对于彼此以及相对于边界层(1)的布置方式是,当第二配体(4)结合跨层蛋白(2)(即直接通过结合位点(9))时,第一结合成员(6)和第二结合成员(7)能够彼此接触或紧密接近(或以其他方式适当地关联(associate))以产生可检测的信号(用图1中的闪光符号表示)。
[0608]
b)图2示意性地显示了本发明的第二装置,其中第二配体(在图2中表示为(4))与第二融合蛋白(在图2所示的实施方案中由结合结构域(5)、接头(11)和结合对(6/7)的第二成员(7)形成)分开,并且其中存在于第二融合蛋白中的结合结构域(5)间接结合(如本文所定义,并且在图2的情况下,通过第二配体(4))至跨层蛋白(2)。在图2所示的设置中:
[0609]-边界层表示为(1);
[0610]-第一环境表示为[a];
[0611]-第二环境表示为[b];
[0612]-跨层蛋白(即本发明的嵌合gpcr)表示为(2);
[0613]-第一配体表示为(3);
[0614]-暴露于第一环境[a]并且第一配体(3)可以结合的跨层蛋白(2)上的第一结合位点表示为(8)。如本文所述,跨层蛋白上的所述第一结合位点(8)是本发明嵌合gpcr上的细胞外结合位点(如本文所定义);
[0615]-第二配体表示为(4);
[0616]-暴露于第二环境[b]并且第二配体(4)可以结合的跨层蛋白(2)上的第二结合位点表示为(9)。如本文所述,跨层蛋白上的所述第二结合位点(9)是本发明嵌合gpcr上的细胞内结合位点(如本文所定义)并且包含来自第二gpcr的至少一个icl;
[0617]-能够结合第二配体(4)的结合结构域或结合单元表示为(5);
[0618]-能够产生可检测的信号的结合对表示为(6/7),并且由连接到跨层蛋白(2)(直接或通过接头或间隔物(10))的第一结合成员(6)和连接到结合结构域或结合单元(5)(直接或通过接头或间隔物(11))的第二结合成员(7)组成;
[0619]-第一融合蛋白包含直接或通过接头(10)融合至第一结合成员(6)的跨层蛋白(2);
[0620]
第二融合蛋白包含直接或通过接头(11)融合至第二结合成员(7)的结合结构域(5);和
[0621]-第一和第二融合蛋白相对于彼此以及相对于边界层(1)的布置方式是,当结合结构域(5)结合至跨层蛋白(2)(即,间接地通过结合至第二配体(4)(其反过来通过结合位点(9)与跨层蛋白(2)结合))时,第一结合成员(6)和第二结合成员(7)能够彼此接触或紧密接近(或以其他方式适当地关联)以产生可检测的信号(用图2中的闪光符号表示)。
[0622]
c)图3示意性地显示了本发明的第三装置,其中第二配体(在图3中表示为(4))与第二融合蛋白分开并形成蛋白质复合体(12)的一部分,该蛋白质复合体由第二配体(4)和一种或多种其他蛋白质(在图3的情况下,出于说明目的,所述复合体被举例说明为包含第二配体(4)和两种其他蛋白质(4a)和(4b),另见图3的插图)形成。在图3所示的实施方案中,第二配体(4)再次与第二融合蛋白(其在图3所示的实施方案中由结合结构域(5)、接头(11)和结合对(6/7)的第二成员(7)形成)分开,并且存在于第二融合蛋白中的结合结构域(5)间接结合(如本文所定义,并且在图3的情况下,通过蛋白质复合体(12))至跨层蛋白(2)。在图3所示的设置中:
[0623]-边界层表示为(1);
[0624]-第一环境表示为[a];
[0625]-第二环境表示为[b];
[0626]-跨层蛋白(即本发明的嵌合gpcr)表示为(2);
[0627]-第一配体表示为(3);
[0628]-暴露于第一环境[a]并且第一配体(3)可以结合的跨层蛋白(2)上的第一结合位点表示为(8)。如本文所述,跨层蛋白上的所述第一结合位点(8)是本发明嵌合gpcr上的细胞外结合位点(如本文所定义);
[0629]-第二配体表示为(4),并与一种或多种其他蛋白质形成复合体(12)(出于说明目的,在图3中,复合体(12)表示为包含三个蛋白质/亚基的复合体,即第二配体(4)和两个其他亚基(4a)和(4b),另见图3中的插图);
[0630]-暴露于第二环境[b]并且复合体(12)可以结合的跨层蛋白(2)上的第二结合位点表示为(9)。如本文所述,跨层蛋白上的所述第二结合位点(9)是本发明嵌合gpcr上的细胞内结合位点(如本文所定义)并且包含来自第二gpcr的至少一个icl;
[0631]-能够结合复合体(12)的结合结构域或结合单元表示为(5);
[0632]-能够产生可检测的信号的结合对表示为(6/7),并且由连接到跨层蛋白(2)(直接或通过接头或间隔物(10))的第一结合成员(6)和连接到结合结构域或结合单元(5)(直接或通过接头或间隔物(11))的第二结合成员(7)组成;
[0633]-第一融合蛋白包含直接或通过接头(10)融合至第一结合成员(6)的跨层蛋白(2);
[0634]-第二融合蛋白包含直接或通过接头(11)融合至第二结合成员(7)的结合结构域(5);和
[0635]-第一和第二融合蛋白相对于彼此以及相对于边界层(1)的布置方式是,当结合结
构域(5)结合至跨层蛋白(2)(即,间接地通过结合至复合体(12)(其反过来通过结合位点(9)与跨层蛋白(2)结合))时,第一结合成员(6)和第二结合成员(7)能够彼此接触或紧密接近(或以其他方式适当地关联)以产生可检测的信号(用图3中的闪光符号表示)。
[0636]
d)图4是显示使用实施例2中描述的重组mc4r筛选测定获得的指定化合物的剂量反应曲线的图;
[0637]
e)图5是显示使用实施例2中描述的重组mc4r筛选测定获得的测定结果的图;
[0638]
f)图6至10是显示使用实施例3中描述的重组ox2r筛选测定获得的指定化合物的剂量反应曲线的图;
[0639]
g)图11a和b是显示使用实施例4中描述的两种重组apj受体筛选测定获得的测定结果的图。图11a显示使用具有μ.阿片样物质受体(mor)的icl的重组apelin受体获得的结果,并且图11b显示了用具有来自β-2ar受体的icl的重组apelin受体获得的结果;
[0640]
h)图12至15显示了实施例5中进行的化合物文库筛选的结果;
[0641]
i)图16a至c显示了实验部分中提及的两个mc4r嵌合体(seq id no:11和12)与人mc4r(seq id no:13)和所述嵌合体所源自的β-2-肾上腺素能受体(seq id no:14)的氨基酸序列的比对;
[0642]
j)图17是mc4r-b2ar嵌合体1(seq id no:11)的氨基酸序列的三级结构的示意图,显示了n-和c-末端序列、ecl、icl和tm。嵌合gpcr中源自b2ar的氨基酸残基(icl和一些icl侧翼残基)以灰色阴影显示;
[0643]
k)图18是显示在使用野生型mc4r(seq id no:13)和mc4r-b2ar嵌合体1(seq id no:11)的放射性配体测定中测试一系列化合物(a2至f11,在x轴上表示)的图表。对于每种化合物,测量相对于野生型(用点表示的值)和相对于嵌合体(用正方形表示的值)的位移(displacement)(参见实施例6);
[0644]
l)图19是显示一系列化合物(图中的每个数据点代表不同的化合物)在放射性配体测定和使用mc4r/b2ar嵌合体的图1所示测定设置中获得的结果的图表。放射配体测定的结果沿y轴(“conforatio@10微摩尔”)列出,而confosensor测定的结果沿x轴(“confosensor比率”)列出。在使用野生型mc4r的camp细胞测定中选择用于进一步测试的化合物表示为a到i。
[0645]
m)图20和21是来自两个独立实验的图,显示了使用野生型mc4r对α-msh(参考)、未刺激细胞(“未刺激”)和基于图19中所示的数据选择用于camp测定中的测试的化合物a至i的camp细胞测定中的读数;
[0646]
n)图22显示了人β2ar的氨基酸序列(uniprot p07550,参见seq id no:17和图22);
[0647]
o)图23是在实施例9中获得的图,比较了来自本发明的ox2测定(使用重组ox2融合体)和ox2 ip-one测定的结果,其中x轴代表在本发明的测定中获得的数据,y轴代表在ip-one测定中获得的数据,并且每个点代表单个化合物的结果。
[0648]
p)图24a和24b是在实施例10中使用本发明的测定针对重组ox2受体筛选大型化合物文库时获得的图。图24a显示了化合物在30μm下测试时获得的结果,并且图24b显示了化合物在200μm下测试时获得的结果,其中x轴代表了测试化合物(“样品”)获得的信号与载体溶剂(“空白”)给出的信号之比,并且每个点代表单个化合物的结果。
[0649]
根据本文的附图和进一步描述,本领域技术人员将清楚包含本发明嵌合gpcr的装置的一些元件(例如边界层、嵌合gpcr、结合对、任何接头和第一配体)将存在于如本文所考虑的本发明的各个方面和实施方案中。因此,当在本文中给出任何此类元件的详细描述(包括对任何此类元件的任何偏好)时,应理解此类描述适用于其中存在或使用此类元件的本发明的所有方面和实施方案,除非明确说明在此另有说明。
[0650]
在本发明的方法和装置中,边界层(1)可以是适合将第一环境[a]与第二环境[b]分开(在合适的体外系统或合适的体内系统)的任何层(例如壁或膜)。
[0651]
例如,在本发明的一个优选方面中,其中本发明的方法在合适的细胞或细胞系(如本文进一步描述)中进行,边界层(1)是用于本发明方法的细胞或细胞系的细胞膜或细胞壁。在这方面,环境[a]优选为细胞外环境,环境[b]优选为细胞内环境。而且,在这方面,第一配体(3)优选存在于细胞外环境中,而第二配体(4)优选存在于细胞内环境中。此外,第一和第二结合成员(6)和(7)以及第二融合蛋白优选也存在于细胞内环境中,
[0652]
在本发明的另一个优选方面,其中本发明的方法在合适的小泡或脂质体(如本文进一步描述)中进行,边界层(1)是小泡或脂质体的膜或壁。在这方面,环境[a]优选为小泡或脂质体外面的环境,环境[b]优选为小泡或脂质体内部的环境。此外,在这方面,第一配体(3)优选存在于小泡或脂质体外面的环境中,而第二配体(4)优选存在于小泡或脂质体内部的环境中。此外,第一和第二结合成员(6)和(7)以及第二融合蛋白优选也存在于小泡或脂质体内部的环境中。
[0653]
然而,应当理解,虽然本发明在一些优选方面是使用细胞、脂质体或其他合适的小泡进行的,但本发明在其最广泛的意义上不限于使用细胞或小泡,而是可以在任何其他合适的装置中进行,其中边界层(1)用于适当地将第一环境[a]与第二环境[b]分开。例如,边界层也可以是存在于膜提取物中的细胞壁或细胞膜的一部分或片段,例如通过本身已知的技术如合适的渗透压和/或本身已知的机械技术从全细胞获得的膜提取物。
[0654]
因此,边界层(1)可以是任何合适的层、壁或膜,特别是生物壁或膜(例如细胞壁或细胞膜,或其部分或片段)或脂质体或其他合适的小泡的壁或膜。特别地,边界层(1)可以是合适的脂质双层,例如磷脂双层。当边界层(1)是小泡或脂质体的壁或膜时,它可以是单层或多层的。此外,如本文进一步描述的,当边界层(1)是细胞膜或细胞壁时,它优选地是细胞或细胞系的壁或膜,该细胞或细胞系适当地表达(如本文所定义)跨层蛋白(2)(即本发明的嵌合gpcr)并且特别适当地表达如本文所述的包含跨层蛋白(2)的(第一)融合蛋白。
[0655]
如非限制性图1、2和3示意性所示,边界层(1)包含跨层蛋白(2)(即本发明的嵌合gpcr),其跨越边界层(1)使得:
[0656]-第一配体(3)的第一结合位点(8)(即本发明的嵌合gpcr上的细胞外结合位点,如本文所述)延伸出(如本文所定义)至第一环境[a]内(即,使得当所述第一配体存在于第一环境[a]中时,第一结合位点(8)对于第一配体(3)的结合是可及的);
[0657]
并且还使得
[0658]-第二配体(4)的第二结合位点(9)(即本发明的嵌合gpcr上的细胞内结合位点,如本文所述)延伸出(如本文所定义)至第二环境[b]内(即,使得当所述第二配体存在于第二环境[b]中时,第二结合位点(9)对第二配体(4)的结合是可及的)。
[0659]
在本发明的方法和装置中,本发明的嵌合gpcr(在所述方法和装置中作为跨层蛋
白(2))是这样的(和/或以这样的方式关于边界层提供和/或布置),它跨越边界层(1),使得嵌合gpcr的氨基酸序列的至少一部分(特别是至少一个ecl,优选所有ecl)从边界层(1)延伸出(如本文定义的)至第一环境[a]内并且使得嵌合gpcr的氨基酸序列的至少一个其他部分(尤其是至少一个icl,优选所有icl)从边界层(1)延伸出(如本文所定义)至第二环境[b]内。在这种情况下,当本发明的嵌合gpcr的一部分氨基酸序列(例如分别为ecl或icl)被称为从边界层(1)“延伸出”至环境内(即进入第一环境[a]或第二环境[b])时,这通常应理解为意指序列的所述部分暴露于所述环境和/或对存在于所述环境中的配体、化合物或其他化学实体的结合是可及的。因此,在使用本发明的嵌合gpcr的方法和装置中,嵌合gpcr的氨基酸序列的至少一部分(例如表位或结合位点)应该对于存在于第一环境中的配体、化合物或其他化学实体的结合(特别是,对于第一配体(3)的结合)是可及的和跨层蛋白氨基酸序列的至少一个其他部分(例如另一表位或结合位点)应该对于存在于第二环境中的配体、化合物或其他化学实体的结合(特别是,对于第二配体(4)的结合)是可及的。在这方面,还应注意,措辞“对于结合是可及的”通常应理解为存在于相关环境中的配体、化合物或其他化学实体可以结合到在本发明的嵌合gpcr上或内的结合口袋或结合位点(例如细胞外结合位点,如本文所定义),即使实际结合位点或结合口袋位于跨层蛋白结构内的深处(更深处)(甚至使得实际结合位点或结合口袋位于跨层蛋白的一部分内,该部分本身不会物理延伸超出边界层)。例如,参考chevillard的出版物(在此引用),该出版物显示在fbdd筛选技术中使用的片段的gpcr上的结合位点可能位于gpcr结构内的深处(参见例如第1120页的图2)而不是位于gpcr的表面,但仍对于片段的结合是可及的。还参考了本文引用的一些其他科学参考文献中关于gpcr结构、gpcr信号传导机制和gpcr配体结合位点的教导,
[0660]
此外,在本说明书和权利要求中,当任何结合结构域、结合单元、表位、结合位点、配体、蛋白质或其他化合物或化学制剂或其他结构实体(例如蛋白质复合体)被称为“存在于”环境(即第一环境[a]或第二环境[b])中,这通常应理解为是指所述结合结构域、结合单元、表位、结合位点、配体、蛋白质或其他化合物或化学或结构实体暴露于所述环境和/或对于所述环境中存在的另一结构域、配体、蛋白质或化合物的结合是可及的。因此,例如,存在于环境中的化合物或配体可以在所述环境中“自由漂浮”(即不结合或锚定到任何其他蛋白质或结构)或可以锚定到边界层或融合到另一种蛋白质(该其他蛋白质可能锚定在边界层上)。类似地,存在于环境中的结合结构域或结合单元可以是较大蛋白质或结构(例如融合蛋白)的一部分,该较大结构可以在所述环境中自由漂浮或锚定到边界层或到另一结构,只要结合结构域或结合单元对于存在于所述环境中的另一结构域、配体、蛋白质或化合物的结合是可及的即可。此外,环境中存在的表位或结合位点可以是较大蛋白质或结构的一部分,该较大蛋白质或结构可以再次在所述环境中自由漂浮或锚定到边界层或另一结构,只要表位或结合位点对于存在于所述环境中的另一结构域、配体、蛋白质或化合物的结合是可及的。
[0661]
延伸出至第一环境[a]内的本发明嵌合gpcr的一个部分或多个部分可以是跨层蛋白氨基酸序列的任何环、表位(线性或构象)、结合位点或其他部分,并且类似地,延伸出至第二环境[b]内的跨层蛋白的一个部分或多个部分也可以是跨层蛋白的氨基酸序列的任何环、表位(线性或构象)、结合位点或其他部分(但将不同于延伸出至第一环境内的部分),但如本文所述,优选本发明的嵌合gpcr的至少一个ecl(更优选所有ecl,特别是细胞外结合位
点)将延伸出至第一环境[a]内,并且优选地,本发明的嵌合gpcr的至少一个icl(更优选所有icl,特别是细胞内结合位点)将延伸出至第一环境[b]内。
[0662]
通常,跨层蛋白(2)(即本发明的嵌合gpcr)通常会附着和/或锚定在边界层(1)中,例如以对于gpcr本身已知的方式。如本文进一步描述的,这可以例如通过在合适的宿主细胞中适当地表达(如本文定义的)表达第一融合蛋白的核苷酸序列或核酸来实现,使得本发明的嵌合gpcr变得适当地锚定在所述细胞的壁或膜中。当使用脂质体或小泡进行本发明的方法时,这可以通过在第一融合蛋白的存在下适当地形成所述脂质体或小泡来实现,使得嵌合gpcr变得适当地锚定到脂质体或小泡的壁或膜中。
[0663]
此外,当本发明的方法在细胞中进行时,本发明的嵌合gpcr的n-末端和c-末端相对于所用细胞的壁或膜的布置优选地与ecl和icl分别所源自的第一和第二gpcr的所述末端的布置相同(即,当所述第一和第二gpcr处于它们的天然细胞环境中时)。当嵌合gpcr的c末端源自第二gpcr而不是第一gpcr时,这也适用。
[0664]
当本发明的方法要在脂质体或小泡中进行时,脂质体或小泡可以是以下各项:脂质体/小泡的混合物,其中本发明的嵌合gpcr的布置方式与ecl和icl分别所源自的第一和第二gpcr相对于它们天然环境中的细胞壁或细胞膜的布置方式基本相同(即n末端和细胞外环延伸到小泡的外面并且c末端和细胞内环延伸到小泡内),和其中蛋白质以相反方式布置的小泡/脂质体。通常,这不会影响此处描述的系统或设置的性能。
[0665]
正如对天然存在的gpcr所知,本发明的嵌合gpcr应该最优选地存在(即可以呈现)两种或更多种构象(例如基础状态/构象、活性状态/构象和/或无活性状态/构象,和/或配体结合或无配体的构象),和/或可以经历构象变化(特别是功能性构象变化)。特别地,本发明的嵌合gpcr应该是这样的:它可以呈现至少一种功能性构象和至少一种非功能性构象(例如基础构象)和/或可以经历从非功能性构象到功能性构象的构象变化;更特别地,它可以呈现活性(或活性较高)的构象和无活性(或活性较低)的构象,和/或可以经历从无活性(或活性较低)的构象到活性(或活性较高)的构象的构象变化。此外,嵌合gpcr优选地使得它可以呈现至少一种配体结合(特别是激动剂结合)的构象和至少一种无配体的构象。更特别地,嵌合gpcr可以是这样的,即它可以呈现至少一种配体结合(特别是激动剂结合)的构象,即活性或功能性构象。
[0666]
如本文所述,(跨膜)蛋白质(例如某些gpcr)的特定类别的功能性构象被称为/定义为“可成药(druggable)构象”。因此,在一个特定方面,嵌合gpcr使得它可以呈现至少一种这样的可成药构象(其通常是活性构象,尽管本发明不限于与为活性构象的可成药构象一起使用)和至少一种不是可成药构象的构象(通常是无活性的构象)和/或使得它可以经历从不成药构象到可成药构象的构象变化。
[0667]
特别地,嵌合gpcr优选使得它在配体(并且特别是激动剂)与蛋白质结合时经历构象变化。这种在结合配体时的构象变化可以是例如从活性构象到无活性构象或从功能性构象到非功能性构象的构象变化,但优选是从非功能性构象到功能性构象和/或从无活性构象到活性构象的变化。在特定方面,它是从不可成药构象到可成药构象的变化。
[0668]
例如,嵌合gpcr的构象变化可以是从基本上不能结合g-蛋白的构象到结合g-蛋白(或能够被g-蛋白结合)的构象的变化,并且可以尤其是从基本上不能(或不太能)结合构象诱导的结合结构域或结合单元的构象到结合构象诱导的结合结构域或结合单元(或更能由
构象诱导的结合结构域或结合单元结合)的构象的变化。
[0669]
如本文所述,能够引发gpcr从非功能性状态到功能性状态(例如从无活性状态如基础状态到活性状态)的构象变化的配体在本文中也称为所述gpcr的“激动剂”。特别地,gpcr的“激动剂”可能能够引发从基本上不能结合g蛋白的构象到结合g蛋白的构象的构象变化。
[0670]
在一个优选的方面,嵌合gpcr使得它在第一配体(3)与其结合时经历(或能够经历)构象变化(如本文所述),相反地,第一配体(3)使得它可以当嵌合gpcr与其结合时引起嵌合gpcr构象变化(和/或本发明用于鉴定此类第一配体)。同样,在一个更优选的方面,所述构象变化是从无活性或活性较低状态到功能性或(更高)活性状态的变化,并且所使用的第一配体(3)使得当它与嵌合gpcr结合时,它可以引发嵌合gpcr从无活性或活性较低的状态到功能性或(更高)活性状态的构象变化。此外,在结合第一配体(3)时所述构象变化可以是从基本上不能结合g蛋白的构象到结合g蛋白的构象的变化。
[0671]
还如本文进一步描述的,嵌合gpcr可以使得它可以与第一和第二配体形成复合体。在这方面,已知大多数天然存在的gpcr与细胞外配体和g蛋白(这是gpcr最常见的天然细胞内配体)形成复合体,并且这种复合体通过g蛋白与gpcr的细胞内构象表位的结合来稳定。类似地,在本发明中,第二配体优选使其稳定嵌合gpcr、第一配体和第二配体的复合体(的形成)。如本文所述。为此目的,第二配体可以是在其天然环境中与第二gpcr(即嵌合gpcr的icl所源自的gpcr)相关联的g蛋白(即通过gpcr进行信号转导),能够与嵌合gpcr结合并稳定上述复合体形成的另一种天然存在的g蛋白,或能够与嵌合gpcr结合并稳定上述复合体形成的gpcr的合成或半合成类似物或衍生物。如本文进一步描述的,第二配体优选是结合结构域或结合单元,其可以结合包含至少一个所述细胞内环(如本文所述)的所述嵌合gpcr上的结合位点,并且更优选地是构象诱导的结合结构域或结合单元(也如本文所述)并且可以特别是isvd,更特别是构象诱导的isvd。
[0672]
如本文进一步描述的,并且如图1至图3示意性所示,在本发明的装置中,跨层蛋白(2)(即本发明的嵌合gpcr)通常并且优选地直接或经由合适的间隔物或接头(10)融合或连接到结合对(6/7)的第一成员(6)以形成第一融合蛋白。此外,结合对(6/7)的第二结合成员(7)通常并且优选地是不同于第一融合蛋白的第二融合蛋白的一部分,该第二融合蛋白也如本文进一步描述的。所述第一融合蛋白、所述第二融合蛋白(以其如本文所述的各种形式)、编码第一或第二融合蛋白的核苷酸序列和/或核酸,以及表达(并且特别适当地表达,如本文所述)或能够(适当地)表达第一和/或第二融合蛋白(并且优选地两者)的细胞、细胞系或其他宿主细胞或宿主生物体,以及如本文进一步描述的上述内容的各种用途,形成本发明的另外的方面。
[0673]
在采用本发明的嵌合gpcr的装置中使用的结合对(6/7)通常包含至少两个单独的结合成员(6)和(7),它们在本文中也分别称为“第一结合成员”和“第二结合成员”。结合对(6/7)及其每个成员(6)和(7)应该是这样的,当成员(6)和(7)彼此接触或紧密接近时,结合对(6/7)能够产生可检测的信号。这种可检测的信号可以是例如发光信号、荧光信号或化学发光信号。
[0674]
在一个特别优选的方面,当本文描述的方法在合适的细胞中进行时,结合对(6/7)的第一成员(6)和第二成员(7)优选两者是可以通过适当地表达(优选地在用于本发明的方
法的细胞中)编码其的核酸或核苷酸序列而获得的多肽、蛋白质、氨基酸序列或其他化学实体。
[0675]
第一和第二结合成员也可以是合适的报道基因测定的一部分,可以是酶和底物的组合,或者当它们彼此接触或紧密接近时可以产生可检测的信号的任何其他结构域或单元对,例如蛋白质-蛋白质相互作用的实验研究中常用的结合对。如上所述,为了降低基线/背景信号的水平,优选结合对的两个成员本身对彼此不具有实质性的结合亲和力。
[0676]
合适的结合对的一些优选但非限制性的例子是pgfp和来自promega的系统。后者是特别优选的,因为组成系统本身的大bit和小bit彼此之间的亲和力低。
[0677]
第一结合成员(6)可以以任何合适的方式与本发明的嵌合gpcr融合,只要所得的第一融合蛋白是这样的,当由第二配体(4)和第二成员(7)形成的第二融合蛋白通过第二结合位点(9)结合至本发明的嵌合gpcr(即至本文定义的细胞内结合位点)时,它允许第一成员(6)接触(或以其他方式适当地紧密接近)结合对(6/7)的第二成员(7)。此外,优选地,第一结合成员(6)以在用于实施本发明方法的条件下基本上不影响本发明的嵌合gpcr可以进行的构象和/或构象变化的方式与本发明的嵌合gpcr融合或连接。
[0678]
因此,通常,虽然本发明不排除第一结合成员(6)与本发明的嵌合gpcr直接融合或连接,但通常优选第一结合成员(6)通过合适的接头(10)与嵌合gpcr融合或连接。通常优选使用柔性接头,例如总共具有5至50个氨基酸,优选10至30个氨基酸,例如约15至20个氨基酸。合适的接头对于技术人员是清楚的并且包括glyser接头(例如15gs接头)。
[0679]
在本发明中,结合对(6/7)的第一和第二结合成员将存在于(如本文所定义的)相对于边界层(1)相同的环境中,使得它们可以彼此接触或紧密接近(以本文进一步描述的方式)并且在这样做时可以产生可检测的信号。特别地,如图1、2和3示意性所示,结合对(6/7)的第一和第二结合成员将存在于(如本文定义的)与在本发明的嵌合gpcr上的第二结合位点(9)(即如本文定义的细胞内结合位点)相同的环境中(再次,相对于边界层(1)),以允许当第二融合蛋白与所述结合位点结合(即直接(如图1所示)或间接(如图2和3所示))时,结合对(6/7)的第一和第二结合成员接触。为此,第一结合成员(6)通常将直接或通过接头(10)附接至暴露于与第二结合位点(9)相同的环境的本发明嵌合gpcr中/上的氨基酸残基/位置。如本文进一步描述的,所述环境(在图1至3中表示为环境[b])可以是例如细胞内环境(当本发明的方法在细胞中进行时)或小泡或脂质体内的环境。
[0680]
在本发明的优选方面,第一结合成员(6)将直接或通过接头(10)融合至本发明嵌合gpcr的一级氨基酸序列的一端。这可以是本发明嵌合gpcr的n末端或c末端,同样只要在本发明的最终装置中第一结合成员(6)位于边界层(1)上与第二结合位点(9)相同的一侧即可。因此,在如本文进一步描述的在细胞中进行的本发明的方面,并且当第二结合位点(9)暴露于细胞内环境时,第一成员(6)可以融合至在细胞内环境中终止的一级氨基酸序列的末端(在7tm的情况下,通常是c末端)。
[0681]
可以使用本身已知的合适的蛋白质化学技术和/或重组dna技术来提供和生产第一融合蛋白。基于本文的进一步公开以及本文提及的标准手册和其他科学参考文献,这些技术对于技术人员来说将是清楚的。当本发明的方法在细胞中进行时(如本文进一步描述的),优选通过在所述细胞中适当表达编码第一融合蛋白的核苷酸序列和/或核酸来提供第
一融合蛋白。这可以再次使用本身已知的重组dna技术的合适技术进行,并且适当地表达或(能够适当地表达)第一融合蛋白的细胞形成了本发明的另一方面。
[0682]
如本文进一步描述的,在本发明的装置中,结合对(6/7)的第二成员(7)通常并且优选地也形成融合蛋白的一部分,该融合蛋白通常将包含所述第二结合单元,该第二结合单元直接或通过合适的间隔物或接头(11)与另一配体、蛋白质、结合结构域或结合单元融合或连接,该配体、蛋白质、结合结构域或结合单元是这样的,其可以直接(如本文定义的)或间接(如本文定义)结合本发明的嵌合gpcr。为此,如本文进一步描述的,所述配体、蛋白质、结合结构域或结合单元可以例如是第二配体(导致图1中示意性示出的类型的本发明的装置,其中(4)是第二配体),是可以与第二配体结合的结合结构域或结合单元(导致图2中示意性示出的类型的本发明的装置,其中(4)是第二配体和(5)是与第二配体结合的结合结构域或结合单元),或者是可以与可以结合跨层蛋白的蛋白质复合体结合的结合结构域或结合单元(如图3示意性所示,其中(4)是第二配体,(12)是包含第二配体的所述蛋白质复合体,和(5)是结合蛋白质复合体的结合结构域或结合单元)。
[0683]
在第二融合蛋白中,第二结合成员(7)最优选地以合适的方式连接到所述其他配体、蛋白质、结合结构域或结合单元,该合适的方式允许当第二融合蛋白直接或间接结合至本发明的嵌合gpcr上的第二结合位点(9)(即至本文定义的细胞内结合位点)时,第二结合成员(7)接触(或以其他方式适当地紧密接近)结合对(6/7)的第一成员(6)。为此,第二结合成员(7)可以与所述其他配体、蛋白质、结合结构域或结合单元直接融合或连接,但优选地它们通过合适的接头(11)连接,该接头优选为柔性接头,例如具有总共5至50个氨基酸,优选10至30个氨基酸,通常优选例如约15至20个氨基酸。合适的接头对于技术人员是清楚的并且包括glyser接头(例如15gs接头)。
[0684]
如本文所述,通常,第二配体可以是能够与跨层蛋白结合的任何配体、蛋白质、结合结构域或结合单元,即通过结合位点(9)(当第二配体是第二融合蛋白的一部分时,它应该最优选地还使得它可以适当地包含在第二融合蛋白中)。然而,优选地,第二配体是可结合本发明嵌合gpcr的至少一个icl的构象诱导的(如本文定义)结合结构域或结合单元(更优选构象诱导的isvd)。
[0685]
通常,在本发明中(并且无论所述结合位点是被用于本发明装置的第二融合蛋白直接结合还是间接结合),结合位点(9)可以是本发明的嵌合gpcr上的构象表位。更特别地,所述结合位点(9)可以是当嵌合gpcr经历构象变化时改变其“形状”(即结构域、环和/或形成表位的氨基酸残基的空间布置)的本发明的嵌合gpcr上的构象表位,其中所述构象变化为例如从无活性或较低活性状态到活性、较高活性和/或功能性状态的构象变化和/或当第一配体与跨层蛋白结合时发生的构象变化。
[0686]
优选地,结合位点(9)和第二配体使得由于嵌合gpcr经历构象形状结合位点(9)改变其形状时结合位点(9)和第二配体(4)之间相互作用的亲和力改变。特别地,结合位点(9)和第二配体可以使得当嵌合gpcr经历从无活性或较低活性状态到活性、较高活性、功能性和/或可成药状态的构象变化和/或经历当第一配体(3)(特别是作为关于嵌合gpcr的激动剂的第一配体(3))与嵌合gpcr结合时发生的构象变化时,结合位点(9)和第二配体(4)之间相互作用的亲和力增加。
[0687]
特别地,第二配体(4)及其与结合位点(9)的相互作用可以使得当本发明的嵌合
gpcr处于活性、较高活性和/或功能性状态时第二配体(4)以更高的亲和力结合结合位点(9),和/或使得当第一配体(3)(特别是作为关于本发明嵌合gpcr的激动剂的第一配体(3))结合嵌合gpcr时第二配体(4)以更高的亲和力结合结合位点(9)。例如,第二配体(4)及其与结合位点(9)的相互作用可以使得当嵌合gpcr经历这种构象变化时第二配体(4)对本发明嵌合gpcr的亲和力增加10倍,例如100倍或更多,例如从当跨层蛋白处于无活性、较低活性或无配体构象时微摩尔范围内的亲和力(即超过1000nm),到当嵌合gpcr处于功能性、活性或较高活性和/或配体结合构象时纳摩尔范围内的亲和力(即,小于1000nm,例如小于100nm)。例如,已知当配体(尤其是激动剂)与gpcr的细胞外结合位点结合时,g蛋白与g蛋白结合位点之间相互作用的亲和力增加。此外,wo2012/007593、wo2012/007594、wo2012/75643、wo2014/118297、wo2014/122183和wo2014/118297描述了vhh结构域(confobody),与当gpcr处于无活性、较低活性或无配体构象时相比,当gpcr处于功能性、活性或更高活性和/或配体结合构象时,该vhh结构域对gpcr具有更高的亲和力(例如,对于功能性、活性或配体结合构象在纳摩尔范围内,而对于无活性或无配体构象在微摩尔范围内)。根据本发明的嵌合gpcr中存在的icl,此类confobody可在本发明中用作构象诱导的isvd。
[0688]
当第二配体不是构象诱导的结合结构域或结合单元时,第二配体(4)通常是蛋白质或蛋白质的配体。在在合适的细胞或细胞系中进行的本发明的方面中,第二配体(4)可以是所使用的细胞或细胞系天然的蛋白质,或者可以是在使用的细胞或细胞系中表达的合适的(重组)蛋白质。例如,当第二配体(4)不是第二融合蛋白的一部分时,它可以是天然存在于所述细胞或细胞系中的“第二”gpcr(即,icl源自的gpcr)的配体(例如,由所用细胞或细胞系天然表达的g蛋白)。或者,第二配体可以是在所用细胞或细胞系中重组表达的蛋白质,例如当所述细胞或细胞系不天然表达用于本发明嵌合gpcr的合适配体时或当需要使用与由所述细胞或细胞系天然表达的配体不同的配体时(例如,当需要使用天然表达的配体的类似物、衍生物或直向同源物时,在这种情况下,在所使用的细胞或细胞系中,天然表达的配体的天然表达也可能被暂时或组成性地抑制或敲除)。当第二配体(4)形成第二融合蛋白的一部分时,第二配体通常作为第二融合蛋白的一部分重组表达。
[0689]
如本文进一步描述的,第二配体可以是第二融合蛋白的一部分,或者它可以与第二融合蛋白分开。在任一情况下(即,无论第二配体是否为第二融合蛋白的一部分),第二配体优选使得它能够结合本发明的嵌合gpcr上的构象表位(或者使得它是直接结合嵌合gpcr的蛋白质复合体的一部分或能够直接结合嵌合gpcr)。更优选地,第二配体(和/或包含第二配体的蛋白质复合体)优选使得它特异性结合本发明的嵌合gpcr的一个或多个功能性、活性和/或可成药构象,使得它诱导形成和/或稳定嵌合gpcr的一个或多个功能性、活性和/或可成药构象(和/或使跨层蛋白的构象平衡向一个或多个此类构象转移);和/或使得它诱导形成和/或稳定嵌合gpcr、第一配体和第二配体的复合体。
[0690]
当第二配体是第二融合蛋白的一部分时,它可以是能够直接结合本发明的嵌合gpcr并且能够适当地包含在第二融合蛋白中的任何配体、结合结构域、结合单元、肽、蛋白质或其他化学实体。优选地,如本文进一步描述的,当它是第二融合蛋白的一部分时,第二配体将是合适的结合结构域或结合单元,并且特别是免疫球蛋白单可变结构域。如本文所述,第二配体优选为构象诱导的结合结构域或结合单元,并且还优选使用包含此类构象诱导的结合结构域或结合单元的第二融合蛋白。
[0691]
当第二配体与第二融合蛋白分开时,它可以是可以直接结合嵌合gpcr和/或可以形成可以结合嵌合gpcr的蛋白质复合体的一部分的任何配体或蛋白质。例如,如本文进一步描述的,这样的第二配体可以是已经从中获得嵌合gpcr的icl的“第二”gpcr的天然存在的配体、这种天然存在配体的半合成或合成类似物或衍生物或这种天然存在的配体的直向同源物。此外,当第二配体不是第二融合蛋白的一部分时,第二融合蛋白将包含可以间接结合(如本文定义)嵌合gpcr的结合结构域或结合单元,即可以结合第二配体和/或结合包含第二配体的蛋白质复合体的结合结构域或结合单元。同样,也如本文进一步描述的,这样的结合结构域或结合单元可以特别地是免疫球蛋白单可变结构域,例如源自骆驼科动物的isvd。
[0692]
技术人员还清楚的是,当第二配体不形成第二融合蛋白的一部分时,存在于第二融合蛋白中并且可以与第二配体结合的结合结构域或结合单元应该基本上不干扰第二配体与本发明的嵌合gpcr的结合。例如,它优选与所述第二配体上的结合位点或表位结合,该结合位点或表位与结合嵌合gpcr的第二蛋白质上的结合位点不同(并且优选地还从结合嵌合gpcr的第二蛋白质上的结合位点充分去除,以避免任何主要的空间位阻)。
[0693]
当第二配体(4)是icl所源自的“第二”gpcr的天然存在的配体时,它可以是例如参与其中跨层蛋白(2)参与的信号传导途径或信号转导的配体。例如,第二配体(4)可以是受体的天然存在的配体,特别是“第二”gpcr的天然存在的细胞内配体,例如当细胞外配体与受体上的细胞外结合位点结合时与受体上的细胞内结合位点结合的细胞内配体,或者当受体具有某种程度的组成活性时,作为提供所述组成活性的途径的一部分与受体的细胞内结合位点结合的细胞内配体。基于本文的公开内容,技术人员将清楚这种天然配体的合适实例,其中g蛋白是优选实例。
[0694]
如本文进一步描述的,特别是在使用细胞或细胞系进行的本发明的方面和实施方案中,第二配体(4)也可以是包含第二配体(4)和任选的一种或多种的其他蛋白质的复合体的一部分。例如,当第二配体是g蛋白或g蛋白的类似物或衍生物时,第二配体可以是由所述g蛋白和任选的一种或多种其他蛋白质形成的复合体的一部分。这种复合体的一个优选但非限制性实例是包含g-α亚基、g-β亚基和g-γ亚基的g-蛋白三聚体。所述复合体还可包含跨层蛋白本身(例如gpcr和g-蛋白或gpcr和g-蛋白三聚体)。技术人员清楚的是,当第二配体形成这种复合体的一部分时,通常优选第二配体不形成第二融合蛋白的一部分。相反,第二融合蛋白将包含可以与第二配体或所述复合体结合的结合结构域或结合单元。例如,在第二配体形成g蛋白复合体的一部分的情况下,第二融合蛋白中的结合结构域或结合单元可以是与所述复合体(例如与所述复合体内的亚基或与两个或多个所述亚基之间的界面)结合的vhh结构域。如本文所述,此类vhh结构域的实例是称为“ca4435”的vhh(wo2012/75643中的seq id no:1和本文中的seq id no:22)。
[0695]
第二配体(4)也可以是这种天然存在的配体的合成或半合成类似物或衍生物,例如通过有限数量的氨基酸残基或氨基酸残基段的缺失、插入和/或置换而具有与相应天然配体的一级氨基酸序列不同的一级氨基酸序列的类似物或衍生物。此类类似物或衍生物可再次使用本身已知的重组dna技术的合适技术提供,其再次在一方面可涉及在合适的宿主或宿主细胞中表达编码该类似物或衍生物的核苷酸序列或核酸(优选地,作为还包括第二结合成员(7)和任何接头(11)(如果存在的话)的整个第二融合蛋白的一部分)。例如,第二
配体(4)可以是g蛋白(优选)的类似物或衍生物,其与天然序列也可以具有一个或多个氨基酸差异(如本文所定义),条件是该类似物或衍生物仍然对本发明的嵌合gpcr具有足够的亲和力以允许在本发明的方法中合适地使用类似物或衍生物。
[0696]
如上所述,第二配体优选是构象诱导的结合结构域或结合单元,特别是构象诱导的isvd,如在wo2012/007593、wo2012/007594、wo2012/75643、wo2014/118297、wo2014/122183和wo2014/118297中一般描述的,其描述了能够将gpcr稳定在所需构象中的vhh结构域(confobody)。
[0697]
此外,wo2012/75643公开了许多可以间接结合gpcr的vhh结构域,即通过结合g蛋白或g蛋白复合体。其中一些优选但非限制性的实例是可以结合g蛋白复合体的称为“ca4435”的vhh(wo2012/75643中的seq id no:1和本文中的seq id no:22),和可以结合g蛋白的称为“ca4437”的vhh(wo2012/75643中的seq id no:4和本文中的seq id no:23)。此类vhh结构域可适当地包含在第二融合中以提供可通过结合g蛋白或g蛋白复合体间接结合gpcr的第二融合蛋白。
[0698]
通常,在本发明中,当第二融合蛋白直接或间接(均如本文所定义)结合本发明的嵌合gpcr时,第一结合成员(6)和第二结合成员(7)将彼此紧密接近。特别地,当存在于第二融合蛋白中的第二配体(4)直接结合本发明的嵌合gpcr时,或者当存在于第二融合蛋白中的结合结构域或结合单元(5)间接结合本发明的嵌合gpcr时,即当所述结合结构域或结合单元(5)结合第二配体(4)时,或在图3所示的实施方案的情况下结合蛋白质复合体(12)时(该第二配体(4)或蛋白质复合体(12)反过来结合本发明的嵌合gpcr或被本发明的嵌合gpcr结合),第一和第二结合成员将彼此紧密接近。对于本领域技术人员清楚的是,优选地,第一和第二结合成员本身不应彼此具有高亲和力,从而它们的关联(以及可检测信号的伴随(concomittent)产生)主要由因为第二配体(直接或间接)与跨层蛋白结合而彼此接近的第一和第二结合成员驱动,并且基本上不或仅以较小的程度通过第一和第二配体之间的亲和力驱动(来自promega的nanobit系统是这种合适的结合对的实例)。然而,还应注意,第一和第二配体之间的任何此类亲和力通常将为可检测的信号提供基线,该基线基本上不应干扰本发明的测定,因为该测定的读数主要着眼于可检测信号中的任何变化,例如在将第一配体添加到尚不包含第一配体的本发明的装置时(更一般地,还应注意,对于本发明的方法和装置的某些用途,可能优选具有一定水平的基线信号,因为与基线相比,读数还可以包括信号的降低)。
[0699]
因此,一般而言,在本发明中,由第一和第二结合成员产生的可检测的信号(或所述信号的任何变化)将与直接或间接结合本发明的嵌合gpcr的第二融合蛋白的量成比例。这又将取决于第二配体(4)与嵌合gpcr之间(尤其是第二配体与嵌合gpcr可呈现的一种或多种特定构象例如功能性、活性和/或可成药构象之间)的结合相互作用和/或所述结合相互作用的任何变化(特别是所述结合相互作用的任何变化,该任何变化是嵌合gpcr的构象变化和/或嵌合gpcr的构象平衡转移的结果,例如由于第一配体与嵌合gpcr的结合和/或第一配体、嵌合gpcr蛋白和第二配体之间复合体的形成)。
[0700]
基于此和本文的进一步公开,对于技术人员清楚的是,本发明的方法和装置可用于测量或确定第一配体的一个或多个特性(特别是,涉及、影响和/或决定第一配体和本发明的嵌合gpcr之间相互作用的第一配体的特性,如所提及的,其应该代表与嵌合gpcr的ecl
所源自的“第一”gpcr相同的特性)。
[0701]
更具体地,关于第一配体,本发明的方法和装置可用于测量或确定第一配体结合嵌合gpcr以引起嵌合gpcr的构象变化和/或以引起嵌合gpcr的构象平衡变化的能力。例如,如本文进一步描述的,本发明的方法和装置可以是测量或确定给定的第一配体作为嵌合gpcr的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构)调节剂的能力,和/或筛选或鉴定作为或可以作为嵌合gpcr的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构)调节剂的小分子、蛋白质或其他化合物或化学实体。在这方面,基于本文的公开内容技术人员将清楚,当本发明的方法和装置用于这样的目的(即用于关于第一配体的目的)时,通常(并且优选地)在本发明的装置中使用的其他元件(例如第二配体和/或存在于第二融合蛋白中的任何结合结构域或结合单元)将被选择为使得它们具有已知特性(即与它们在本发明的方法和装置中的使用相关的它们的特性是已知的和/或已经表征的),和/或使得它们已经被验证用于本发明的方法和装置中。此外,如所提及的,关于本发明的嵌合gpcr的第一配体的特性旨在并且最优选地代表关于存在于本发明嵌合gpcr中的ecl所源自的“第一”gpcr的第一配体的相同特性。
[0702]
在本发明中,一般而言,可检测信号将优选响应于本发明的嵌合gpcr的构象变化和/或本发明的嵌合gpcr的构象平衡的转移而产生,并且更优选地与其成比例。还如本文进一步描述的,但同样不限于任何特定机制或解释,本发明的嵌合gpcr的所述构象变化和/或构象平衡的转移可以反过来由与本发明的嵌合gpcr结合的第一配体(或以其他方式引起嵌合gpcr的构象变化)和/或通过形成第一配体、本发明的嵌合gpcr和第二配体的复合体(该第二配体可以例如稳定所述复合体或以其他方式诱导或促进所述复合体的形成)引起。因此,更一般地,在本发明中,响应于第一环境中第一配体的存在和/或响应于结合本发明的嵌合gpcr的第一配体(或以其他方式引起跨层蛋白的构象变化和/或本发明的嵌合gpcr的构象平衡的转移)产生可检测的信号(或其中的任何变化,如本文进一步描述的)。
[0703]
此外,通常并且特别是当本发明的方法和装置用于测试、优化和/或验证第一配体和/或鉴定可以作为本发明的嵌合gpcr(以及嵌合gpcr的ecl所源自的第一gpcr)的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构)调节剂的小分子、蛋白质、配体或其他化学实体时,可检测的信号(或其中的任何变化,如本文进一步描述的)将与存在于第一环境中(和/或嵌合gpcr暴露于其)的第一配体的量和/或浓度和/或第一配体对于嵌合gpcr(例如与其他测试的配体相比)的亲和力成比例。
[0704]
因此,基于本文的描述,技术人员将清楚,在本发明的一方面,本文描述的方法和装置将用于检测第一环境中的第一配体的存在和/或确定第一环境中的第一配体的量和/或浓度。本文所述的方法和装置还可用于测量当第一环境中存在不同浓度的第一配体时产生的信号量,例如以建立第一环境中第一配体的量/浓度和可检测的信号(的水平和/或变化)之间的关系。本文所述的方法和装置也可用于确定第一配体对嵌合gpcr的亲和力,例如通过将在第一环境中通过一种或多种已知浓度的第一配体产生的信号与在相同布置中通过对本发明的嵌合gpcr具有已知亲和力的已知浓度的其他配体产生的信号进行比较。
[0705]
如本文进一步描述的,本发明的方法和装置还可用于确定给定的(第一)配体是否是跨层蛋白的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构)调节剂。
[0706]
本领域技术人员还清楚的是,当使用本发明的方法和装置来确定第一配体的一个
或多个特征时,本发明的装置通常将首先设置或以其他方式建立而无需存在第一配体,然后该装置将与该配体接触(例如通过将配体添加到第一环境中),之后由第一配体的存在而产生的可检测的信号(或其中的任何变化)将被测量(并任选地与不存在第一配体的信号和/或一个或多个参考值进行比较)。因此,在不存在第一配体的情况下(例如,在添加第一配体之前)的本文所述的装置形成了本发明的进一步方面。
[0707]
本发明的另一方面是用于提供如本文所述的本发明装置的方法,该方法包括将第一配体添加至不(尚未)包含第一配体的本发明的装置(如本文所述)的步骤。如此获得的装置然后可以用于测量或以其他方式确定第一配体的至少一个特性,并且特别是可以使用本发明的装置来测量或以其他方式确定的第一配体的特性。
[0708]
本领域技术人员基于本文的公开内容将清楚,不存在第一配体的本发明的装置(即尚不包含第一配体的本发明的装置)将至少包括以下元件:
[0709]-分隔第一环境和第二环境的边界层;
[0710]-跨层蛋白;
[0711]-存在于第二环境中的跨层蛋白的配体;和
[0712]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0713]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中元件以本文进一步描述的方式(即基本上以与对包含第一配体的本发明的装置描述的方式相同的方式)相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。如本文进一步描述的,跨层蛋白(即嵌合gpcr)的配体优选是结合结构域或结合单元,其可以结合包含至少一个所述细胞内环(如本文所述)的所述嵌合gpcr上的结合位点,并且更优选地是构象诱导的结合结构域或结合单元(也如本文所述)并且可以特别是isvd,更特别是构象诱导的isvd。
[0714]
特别地,不存在第一配体的本发明的装置(即尚不包含第一配体的本发明的装置)将至少包括以下元件:
[0715]-分隔第一环境和第二环境的边界层;
[0716]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0717]-与所述结合对的结合成员之一适当融合或连接(直接或通过合适的接头或间隔物)的跨层蛋白(即以形成第一融合蛋白);和
[0718]-存在于第二环境中的跨层蛋白的第二配体;
[0719]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中元件以本文进一步描述的方式(即基本上以与对包含第一配体的本发明的装置描述的方式相同的方式)相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。特别地,结合对的第二成员可以是第二融合蛋白(其不同于包含跨层蛋白和结合对的第一结合成员的第一融合蛋白)的一部分,该第二融合蛋白进一步在本文中描述。
[0720]
更特别地,不存在第一配体的本发明的装置(即尚不包含第一配体的本发明的装置)将至少包括以下元件:
[0721]-分隔第一环境和第二环境的边界层;
[0722]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测
的信号;
[0723]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即,使得结合对的所述成员存在于第二环境中);
[0724]-包含可直接或间接结合跨层蛋白的蛋白质和所述结合对的另一结合成员的第二融合蛋白,该第二融合蛋白存在于第二环境中;
[0725]
其中所述跨层蛋白是如本文所述的本发明的嵌合gpcr,并且其中元件以本文进一步描述的方式(即基本上以与对包含第一配体的本发明的装置描述的方式相同的方式)相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。此外,当第二配体可以直接结合嵌合gpcr时,结合结构域或结构单元可以结合包含至少一个所述细胞内环(如本文所述)的所述嵌合gpcr上的结合位点,并且更优选地是构象诱导的结合结构域或结合单元(也如本文所述)并且可以特别是isvd,更特别是构象诱导的isvd。
[0726]
没有第一配体的这种装置的其他方面、实施方案和优选如本文针对具有第一配体但随后不存在第一配体的本发明的装置所描述的。
[0727]
通常,一旦第一配体作为本文所述方法的一部分被添加,任何不存在第一配体的此类装置将变成具有第一配体的相应的装置。因此,本发明的另一方面是提供包含如本文所述的本发明的嵌合gpcr的装置的方法,该方法包括将第一配体添加至不(尚未)包含第一配体的包含本发明嵌合gpcr(如本文所述)的装置的步骤。如此获得的装置然后可以用于测量或以其他方式确定第一配体的至少一个特性,并且特别是可以使用包含本发明的嵌合gpcr的装置来测量或以其他方式确定的第一配体的特性。
[0728]
本发明还涉及一种测量或以其他方式确定化合物或配体的至少一种特性的方法,该方法至少包括以下步骤:
[0729]-将所述化合物或配体作为第一配体添加到本文所述的尚不包含第一配体的包含本发明的嵌合gpcr的装置中;和
[0730]-测量或以其他方式确定所述化合物或配体的至少一种特性,其中所述特性是可以使用所述装置测量或以其他方式确定的特性。
[0731]
在本发明的这个方面,所述特性优选地是代表化合物或配体结合和/或调节嵌合gpcr的能力(例如亲和力)的特性,其又代表关于ecl(并且优选地也基本上是tm)所获自的第一gpcr的基本上相同的特性。
[0732]
本发明还涉及一种测量或以其他方式确定化合物或配体改变可检测信号的能力的方法,所述可检测的信号由存在于本文进一步描述的本发明装置中的结合对产生,该方法至少包括步骤:
[0733]-将所述化合物或配体作为第一配体添加到尚不包含第一配体的包含本发明的嵌合gpcr的装置中;和
[0734]-确定添加所述化合物或配体是否导致通过所述装置中使用的结合对产生的可检测信号的变化,并且任选地测量所述可检测信号的所述变化。
[0735]
因此,在另一方面,本发明涉及一种至少包括以下步骤的方法:
[0736]
a)提供至少包括以下元件的装置:
[0737]-分隔第一环境和第二环境的边界层;
[0738]-跨层蛋白;
[0739]-存在于第二环境中的跨层蛋白的配体;和
[0740]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0741]
其中所述跨层蛋白是本发明的嵌合gpcr,并且其中元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联);
[0742]
以及;
[0743]
b)向第一环境添加第一配体。
[0744]
该方法优选地还包括以下步骤:
[0745]
c)测量由结合对产生的信号和/或测量由结合对产生的信号的变化。
[0746]
因此,在更特定的方面,本发明涉及一种至少包括以下步骤的方法:
[0747]
a)提供至少包括以下元件的装置:
[0748]-分隔第一环境和第二环境的边界层;
[0749]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测信号;
[0750]-与所述结合对的结合成员之一适当融合或连接(直接或通过合适的接头或间隔物)的跨层蛋白(即以形成第一融合蛋白);和
[0751]-存在于第二环境中的跨层蛋白的第二配体;
[0752]
其中所述跨层蛋白是本发明的嵌合gpcr,并且其中元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联);
[0753]
以及;
[0754]
b)向第一环境添加第一配体。
[0755]
该方法优选地还包括以下步骤:
[0756]
c)测量由结合对产生的信号和/或测量由结合对产生的信号的变化。
[0757]
在另一特定的方面,本发明涉及一种至少包括以下步骤的方法:
[0758]
a)提供至少包括以下元件的装置:
[0759]-分隔第一环境和第二环境的边界层;
[0760]-至少由第一结合成员和第二结合成员组成的结合对,该结合对能够产生可检测的信号;
[0761]-包含跨层蛋白和所述结合对的结合成员之一的第一融合蛋白(即使得结合对的所述成员存在于第二环境中);
[0762]-包含可直接或间接结合跨层蛋白的蛋白质和所述结合对的另一结合成员的第二融合蛋白,该第二融合蛋白存在于第二环境中;
[0763]
其中所述跨层蛋白是本发明的嵌合gpcr,并且其中元件以本文进一步描述的方式相对于彼此布置(并且在适用的情况下彼此可操作地连接和/或关联)。
[0764]
以及;
[0765]
b)向第一环境添加第一配体。
[0766]
该方法优选地还包括以下步骤:
[0767]
c)测量由结合对产生的信号和/或测量由结合对产生的信号的变化。
[0768]
如本文进一步描述的,在本发明的这个方面,所述第一配体可以是任何期望的和/
或合适的化合物或配体,包括但不限于小分子、小肽、生物分子或其他化学实体。本领域技术人员还清楚,根据该方面的方法(和本发明的其他方法)可用于测量或以其他方式确定作为第一配体添加到装置中的化合物或配体的至少一个特性,和特别是测量或以其他方式确定所述化合物或配体引起由结合对产生的可检测的信号发生变化的能力,所述化合物或配体结合本发明的嵌合gpcr的能力,所述化合物或配体引起本发明的嵌合gpcr构象变化的能力,和/或所述化合物或配体调节(如本文定义)本发明的嵌合gpcr的能力。同样,第一配体对本发明嵌合gpcr的所述一种或多种能力优选代表第一配体关于第一gpcr的相应的一种或多种能力,其中存在于本发明嵌合gpcr中的ecl源自该第一gpcr。此外,通过具有调节第一gpcr的能力,第一配体也可以具有调节其中第一gpcr所涉及的信号传导途径和/或生物学机制的能力。特别地,所述方法可用于确定此类化合物或配体是否是或是否可作为本发明的嵌合gpcr、第一gpcr和/或其中第一gpcr所涉及的信号传导途径和/或生物学机制的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构调节剂)。此外,本发明的方法和装置可用于鉴定和/或筛选化合物或配体,该化合物或配体具有引起由结合对产生的可检测的信号发生变化的能力,与本发明的嵌合gpcr结合的能力,引起本发明的嵌合gpcr(以及由此第一gpcr)构象变化的能力,调节本发明的嵌合gpcr和第一gpcr和/或第一gpcr所涉及的信号传导途径和/或生物学机制的能力,和/或作为本发明的嵌合gpcr(以及由此第一gpcr)的激动剂、拮抗剂、反向激动剂、抑制剂和/或调节剂(例如变构调节剂)的能力,并且本文描述的方法和装置的这种用途形成了本发明的进一步方面。
[0769]
如本文所述,在本发明的一个特定方面,本发明的方法是使用合适的细胞或细胞系进行的,其中包含本发明的嵌合gpcr的装置的所有元件适当地存在和布置以便提供本发明的可操作的装置。这样的细胞或细胞系将适当地在其细胞壁或细胞膜中包含嵌合gpcr,即,使得嵌合gpcr存在于并跨越细胞的细胞壁或细胞膜,使得嵌合gpcr的氨基酸序列的至少一部分(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞外环境内,并且嵌合gpcr的氨基酸序列的其他部分的至少一个(并且特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞内环境内。此外,优选地并且如本文进一步描述的,嵌合gpcr将形成如本文所述的第一融合蛋白的一部分,并且该装置还将包含如本文所述的第二融合蛋白。更优选地,细胞外环境将是“第一环境”(即其中存在第一配体(3)或向其添加第一配体(3)的环境),并且细胞内环境将是“第二环境”(即其中存在结合对(6/7)和第二融合蛋白的环境)。
[0770]
因此,在另一方面,本发明涉及如本文所述的方法或装置,其中边界层(2)是细胞的壁或膜。
[0771]
还如本文所述,当本发明的方法在细胞或合适的细胞系中进行时,所使用的细胞或细胞系优选地使得其合适地表达本发明装置的以下元件中的一种或多种,并且优选地全部:
[0772]-包含本发明的嵌合gpcr和第一结合成员(6)的第一融合蛋白;
[0773]-包含第二结合成员(7)和可直接或间接(如本文定义)结合跨层蛋白(2)的蛋白质的第二融合蛋白;
[0774]
和/或
[0775]-当第二融合蛋白与嵌合gpcr间接结合时,第二配体(4)和/或构成蛋白质复合体
(12)的蛋白质。
[0776]
在表达本发明装置的一个或多个元件的细胞或细胞系的上下文中,并且更一般地在本说明书和权利要求的上下文中,术语“适当地表达”是指细胞或细胞系表达或能够表达(即在用于实施本发明方法的条件下)编码所述元件的核苷酸序列或核酸,使得当这种元件被表达时,它能够用作本发明的装置的可操作部分。例如,关于本发明的嵌合gpcr,这意味着嵌合gpcr作为第一融合蛋白的一部分表达,从而嵌合gpcr被适当地锚定或以其他方式并入细胞的细胞壁或细胞膜使得嵌合gpcr跨越细胞壁或细胞膜,其中嵌合gpcr的氨基酸序列的至少一部分(并且特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞外环境内并且嵌合gpcr的氨基酸序列的其他部分的至少一个(并且特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞内环境内。关于第一和第二融合蛋白,“适当地表达”是指第一和第二融合蛋白这样表达(并且最优选地在细胞内环境中这样表达)使得当第二融合蛋白以本文进一步描述的方式直接或间接结合本发明的嵌合gpcr时,结合对(6/7)的第一和第二结合成员可以彼此接触或紧密接近。
[0777]
本发明装置的每个这样的元件的任何适当达可以是瞬时的或组成型表达,只要本发明装置的所有需要的元件在细胞被用于执行本发明的方法时的时间点以足够的量适当地和可操作地存在即可。
[0778]
在本发明的一个方面,在本发明的一个实施方案的情况下,其中第二融合蛋白间接结合本发明的嵌合gpcr(即其中第二配体(4)不是第二融合蛋白的一部分),所使用的细胞或细胞系优选地使得其天然表达第二配体(4)和/或构成蛋白质复合体(12)的蛋白质。例如但不限于,在本发明的这个方面,第二配体(4)可以是由所使用的细胞或细胞系天然表达的g蛋白和/或蛋白质复合体(12)可以是包含由所用细胞或细胞系天然表达的g-d亚基、g-β亚基和g-γ亚基的g蛋白三聚体。更一般地,在本发明的这些方面,所使用的细胞或细胞系可以是天然表达本发明嵌合gpcr的一种或多种天然配体(并且特别是细胞内配体)和/或天然表达可用作本发明的嵌合gpcr的第二配体的一种或多种配体的细胞或细胞系。
[0779]
细胞或细胞系可以是适用于本发明的方法和装置的任何细胞或细胞系,包括但不限于哺乳动物细胞和昆虫细胞。一些优选但非限制性的实例是人类细胞系,例如hek 293t。
[0780]
用于在此类细胞或细胞系中瞬时或稳定表达所需蛋白质以使得本发明的嵌合gpcr适当地锚定到所述细胞的细胞壁或细胞膜中的合适技术对技术人员来说是清楚的,并且例如包括涉及使用合适的转染试剂,例如来自sigmaaldrich的x-tremegene
tm
或聚乙烯亚胺(pei)的技术。
[0781]
当使用合适地表达本发明装置的一个或多个元件的细胞或细胞系进行本发明时,本发明的方法通常还包括在使得所述细胞或细胞系适当地表达所述元件的条件下培养或维持所述细胞的步骤。
[0782]
因此,在另一方面,本发明涉及包含融合蛋白的细胞或细胞系,所述融合蛋白包含直接或通过合适的接头与其是结合对的第一结合成员的结合结构域或结合单元融合的本发明的嵌合gpcr(如本文所述),所述结合对至少包含作为第一结合成员的所述结合结构域或结合单元和作为第二结合成员的另一结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得它们在彼此接触或彼此紧密接近时能够产生可检测的信号。本发明还涉及表达或能够表达(即在合适的条件下)这种融合蛋白的细胞或细胞系。
[0783]
这样的细胞或细胞系可以是如本文进一步描述的,并且是优选使得其以使本发明的嵌合gpcr并入细胞或细胞系的细胞壁或细胞膜并且跨越所述细胞壁或细胞膜的方式表达或能够表达所述融合蛋白,更优选使得使得嵌合gpcr的氨基酸序列的至少一部分(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞外环境内,并且嵌合gpcr的氨基酸序列的其他部分的至少一个(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞内环境内。更优选地,在所述细胞或细胞系中,结合对的第一结合成员存在于(如本文定义的)细胞的细胞内环境中和/或细胞或细胞系使其表达或能够表达融合蛋白,使得在该表达时,第一结合成员存在于(如本文定义的)细胞的细胞内环境中。
[0784]
在另一方面,本发明涉及包含融合蛋白的细胞或细胞系,所述融合蛋白包含可以结合(直接或间接,如本文所述的)本发明的嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头与其是结合对的结合成员的结合结构域或结合单元融合,所述结合对至少包含第一结合成员和作为第二结合成员的所述结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得它们在彼此接触或彼此紧密接近时能够产生可检测的信号。本发明还涉及表达或能够表达(即在合适的条件下)这种融合蛋白的细胞或细胞系。
[0785]
存在于所述融合蛋白中并且可以结合本发明的嵌合gpcr的蛋白质优选地如本文针对可以存在于第二融合蛋白中的蛋白质进一步描述的那样。此外,结合对的成员和使用的任何接头可以如本文进一步描述的。也如本文所述,所述蛋白质可直接(如本文所述)或间接(如本文所述)结合本发明的嵌合gpcr。
[0786]
如本文所述,当存在于所述融合蛋白中的蛋白质直接结合本发明的嵌合gpcr时,优选地是使得它特异性结合本发明的嵌合gpcr的一个或多个功能性、活性和/或可成药构象,使得它诱导形成和/或稳定嵌合gpcr的一个或多个功能性、活性和/或可成药构象(和/或使跨层蛋白的构象平衡向一个或多个此类构象转移);和/或使得它诱导形成和/或稳定所述蛋白质、嵌合gpcr和嵌合gpcr的另一配体的复合体(所有如本文进一步所述)。此外,当存在于所述融合蛋白中的蛋白质直接结合嵌合gpcr时,该蛋白质优选地使得它可以结合嵌合gpcr上的细胞内结合位点。嵌合gpcr上的所述细胞内结合位点可以是对应于嵌合gpcr上的icl所源自的第二gpcr上的天然细胞内结合位点的结合位点。
[0787]
此外,当存在于所述融合蛋白中的蛋白质直接结合嵌合gpcr时,它优选是vhh结构域或源自vhh结构域的结合结构域或结合单元,并且尤其是confobody(如本文所述)。
[0788]
还如本文所述,当存在于所述融合蛋白中的蛋白质与本发明的嵌合gpcr间接结合时,优选使得其可以与结合本发明的嵌合gpcr的配体结合。当所述第二配体不形成第二融合蛋白的一部分时,所述配体可以如本文针对“第二配体”所述。此外,所述配体优选使得它特异性结合嵌合gpcr的一个或多个功能性、活性和/或可成药构象,使得它诱导形成和/或稳定嵌合gpcr的一个或多个功能性、活性和/或可成药构象(和/或使嵌合gpcr的构象平衡向一个或多个此类构象转移);和/或使得它诱导形成和/或稳定所述配体、嵌合gpcr和嵌合gpcr的另一配体的复合体(所有如本文进一步所述)。此外,所述配体优选地使得它可以结合嵌合gpcr上的细胞内结合位点。此外,如本文所述,所述配体还可以是可以结合嵌合gpcr(即,结合嵌合gpcr上的细胞内结合位点)的蛋白质复合体的一部分,在这种情况下,存在于融合蛋白中的蛋白质也可以结合所述蛋白质复合体。
[0789]
此外,当存在于所述融合蛋白中的蛋白质间接结合时,它优选是vhh结构域或源自
vhh结构域的结合结构域或结合单元,并且尤其是confobody(如本文所述)。此外,在优选的方面,当存在于所述融合蛋白中的蛋白质与嵌合gpcr间接结合时,与gpcr结合的配体是g蛋白,并且存在于所述融合蛋白中的蛋白质能够特异性结合所述g-蛋白或g-蛋白复合体(例如包含g-α亚基、g-β亚基和g-γ亚基的g-蛋白三聚体)。此外,所述g蛋白可以是对于所使用的细胞或细胞系是天然的,或者可以是天然g蛋白的合适类似物或衍生物(如本文所述,并在所述细胞或细胞系中重组表达)或对所用的细胞或细胞系是天然的g蛋白的合适的直向同源物(同样,在所用的细胞或细胞系中重组表达)。
[0790]
不管存在于所述融合蛋白中的蛋白质是直接还是间接结合嵌合gpcr,细胞或细胞系优选地使得它在细胞内环境中表达或能够表达所述融合蛋白。本发明的另一方面涉及在其细胞内环境中包含此类融合蛋白的此类细胞或细胞系。
[0791]
在另一方面,本发明涉及包含第一融合蛋白和第二融合蛋白的细胞或细胞系,其中:
[0792]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0793]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0794]-所述第二融合蛋白包含可结合(直接或间接,如本文所述)所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员。
[0795]
本发明还涉及表达或能够表达(即在合适的条件下)这种第一和第二融合蛋白的细胞或细胞系。
[0796]
本发明特别地涉及包含第一融合蛋白和第二融合蛋白的细胞或细胞系,其中:
[0797]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0798]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0799]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0800]-当第二融合蛋白与形成第一融合蛋白一部分的跨层蛋白结合(直接或间接,如本文所述)时,结合对的第一和第二结合成员可以彼此接触或紧密接近。
[0801]
本发明还涉及包含第一融合蛋白和第二融合蛋白的细胞或细胞系,其中:
[0802]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0803]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或
通过合适的接头融合至结合对的所述第一结合成员;和
[0804]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0805]-结合对的第一和第二结合成员存在于(如本文定义的)细胞的细胞内环境中。
[0806]
本发明还涉及包含第一融合蛋白和第二融合蛋白的细胞或细胞系,其中:
[0807]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0808]-所述第一融合蛋白包含嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0809]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0810]-当第二融合蛋白结合(直接或间接,如本文所述)嵌合gpcr时,所述细胞或细胞系能够产生可检测的信号(并且特别是由结合对的第一和第二结合成员产生的可检测的信号)。
[0811]
本发明还涉及包含第一融合蛋白和第二融合蛋白的细胞或细胞系,其中:
[0812]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0813]-所述第一融合蛋白包含嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0814]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0815]-当存在于细胞外环境中的嵌合gpcr的配体与嵌合gpcr结合时,所述细胞或细胞系产生可检测的信号和/或可检测的信号的变化(并且特别是由结合对的第一和第二结合成员产生的可检测的信号和/或这样的信号的变化)。
[0816]
在特别的方面,本发明涉及包含第一融合蛋白和第二融合蛋白的细胞或细胞系,其中:
[0817]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0818]-所述第一融合蛋白包含嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0819]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0820]-当存在于细胞外的环境中的嵌合gpcr的激动剂与嵌合gpcr结合时,所述细胞或
细胞系产生可检测的信号和/或可检测的信号的变化(并且特别是由结合对的第一和第二结合成员产生的可检测的信号和/或这样的信号的变化)。
[0821]
此外,这样的包含或表达此类第一和第二融合蛋白的细胞或细胞系可以是如本文进一步描述的,并且是优选使得其以使嵌合gpcr并入细胞或细胞系的细胞壁或细胞膜并且跨越所述细胞壁或细胞膜的方式表达或能够表达所述融合蛋白,更优选使得嵌合gpcr的氨基酸序列的至少一部分(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞外环境内,并且嵌合gpcr的氨基酸序列的其他部分的至少一个(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至细胞内环境内。
[0822]
所述细胞或细胞系还优选地使得其表达或能够表达第一和第二融合蛋白,使得在该表达时当第二融合蛋白与形成第一融合蛋白一部分的嵌合gpcr结合(直接或间接,如本文所述)时结合对的第一和第二结合成员可以彼此接触或紧密接近。对于技术人员将清楚的是,这通常意味着所述细胞或细胞系将以这样的方式表达第一和第二融合蛋白,使得在这种表达时结合对的第一和第二结合成员将存在于(如本文定义的)相对于细胞的壁或膜相同的环境中。优选地,细胞或细胞系使得它们表达或能够表达第一和第二融合蛋白,使得在这种表达时,结合对的第一和第二结合成员都将存在于(如本文定义的)细胞的细胞内环境中。这通常也意味着细胞或细胞系优选地使得它们在它们的细胞内环境中表达或能够表达第二融合蛋白。
[0823]
再次,在涉及表达或能够表达这样的第一和第二融合蛋白的细胞或细胞系的本发明的方面中,嵌合gpcr、可直接或间接结合嵌合gpcr的蛋白质,结合对的成员和所使用的任何接头都可以如本文进一步描述的那样。
[0824]
在进一步的方面,本发明还涉及方法,并且特别是涉及使用本文所述的细胞或细胞系的测定方法或筛选方法。如本文进一步描述的,此类测定和筛选方法可特别用于鉴定化合物和其他化学实体,该化合物和其他化学实体结合(并且特别是特异性结合)嵌合gpcr(并由此结合存在于嵌合gpcr中的ecl所源自的第一gpcr),可以调节嵌合gpcr和第一gpcr,和/或调节其中涉及第一gpcr、其信号传导和/或其信号传导途径的信号传导、信号传导途径和/或生物或生理活动。因此,本文所述的细胞和细胞系可用于鉴定化合物或其他化学实体的方法中,该化合物或其他化学实体可作为嵌合gpcr和第一gpcr的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构)调节剂。
[0825]
本发明还涉及本文所述的细胞或细胞系的用途,特别是在测定和筛选方法和技术中的用途。对于本发明装置的方法和用途,这些方法和用途还可以再次如本文进一步描述,并且通常还将包括在使得所述细胞或细胞系适当地表达所需融合蛋白或蛋白质条件下培养或维持所述细胞的步骤。
[0826]
同样,在所有这些方面,此类细胞、细胞系及其用途优选如本文进一步描述的。
[0827]
在本发明的另一方面,本发明的方法是使用合适的脂质体或小泡进行的,其中本发明装置的所有元件都适当地存在和布置以提供本发明的可操作的装置。这样的脂质体或小泡将适当地在其壁或膜中包含跨层蛋白(2),即,使得跨层蛋白(2)存在于并跨越脂质体或小泡的壁或膜,使得嵌合gpcr的氨基酸序列的至少一部分(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至脂质体或小泡外面的环境内,并且嵌合gpcr的氨基酸序列的其他部分的至少一个(并且特别是至少一个ecl,并且优选所有ecl)延伸出(如本文
所定义)至脂质体或小泡内的环境内。此外,优选地并且如本文进一步描述的,在本发明的在脂质体或小泡中进行的方面中,脂质体或小泡外面的环境将是“第一环境”(即其中存在第一配体(3)或向其添加第一配体(3)的环境)并且脂质体或小泡内的环境将是“第二环境”(即其中存在结合对(6/7)和第二融合蛋白的环境)。
[0828]
因此,在另一方面,本发明涉及如本文所述的方法或装置,其中边界层(2)是脂质体或其他(合适的)小泡的壁或膜。
[0829]
还如本文所述,当本发明的方法在脂质体或小泡中进行时,脂质体或小泡优选使其适当地包含(即以提供本发明的可操作的装置的方式)本发明装置的以下元件:
[0830]-包含嵌合gpcr和第一结合成员(6)的第一融合蛋白;
[0831]-包含第二结合成员(7)和可直接或间接(如本文定义)结合嵌合gpcr的蛋白质的第二融合蛋白;
[0832]
和/或
[0833]-当第二融合蛋白与嵌合gpcr间接结合时,第二配体(4)和/或构成蛋白质复合体(12)的蛋白质。
[0834]
含有所述元件的脂质体或小泡通常可以通过在本发明装置的相关元件的存在下形成脂质体或小泡来提供,使得所述元件被适当地并入脂质体或小泡中。这通常可以通过本身已知的用于形成脂质体或小泡的方法和技术进行,优选在合适的水性缓冲液或另一种合适的水性介质中。此类方法还可包括以下步骤:将其中适当且可操作地包括本发明所需装置的元件的脂质体或小泡,与不包含装置的所有所需元件的小泡或脂质体和/或其中元件不形成本发明的可操作装置的小泡或脂质体进行分离。可以以本身已知的方式提供并入脂质体或小泡中的装置元件,例如通过重组表达合适的宿主细胞或宿主生物,然后分离和纯化由此获得的被表达的元件。
[0835]
通常,在其中第二配体不形成第二融合蛋白一部分的脂质体或小泡中进行的本发明方面中,应提供足够量的第二配体并将其适当地包含在小泡或脂质体中。
[0836]
脂质体或小泡可以是适用于本发明的方法和装置的任何脂质体或小泡,包括但不限于基于1,2-二油酰-sn-甘油-3-磷酸胆碱(dopc)、二油酰磷脂酰乙醇胺(dioleoylphosphatidylethanolamine)(dope)或1-棕榈酰-2-油酰-sn-甘油-3-磷酸胆碱(popc)的脂质体。脂质体和小泡也可以是包含和/或基于(例如重构自)一种或多种膜级分(fraction)的脂质体或小泡,所述膜级分从表达本发明的装置的所需元件的细胞获得。
[0837]
因此,在另一方面,本发明涉及包含融合蛋白的脂质体或小泡,所述融合蛋白包含直接或通过合适的接头与作为结合对的第一结合成员的结合结构域或结合单元融合的本发明的嵌合gpcr(如本文所述),所述结合对至少包含作为第一结合成员的所述结合结构域或结合单元和作为第二结合成员的另一结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得它们在彼此接触或彼此紧密接近时能够产生可检测的信号。本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将此类融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0838]
如本文进一步描述的,所述脂质体或小泡优选地使得嵌合gpcr被锚定或以其他方式适当地并入脂质体或小泡的壁或膜并跨越所述壁或膜,更优选使得嵌合gpcr的氨基酸序列的至少一部分(特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至脂质体
或小泡外面的环境内,并且嵌合gpcr的氨基酸序列的其他部分的至少一个(并且特别是至少一个ecl,并且优选所有ecl)延伸出(如本文所定义)至脂质体或小泡内的环境内。更优选地,结合对的第一结合成员存在于(如本文定义的)脂质体或小泡内的环境中。
[0839]
在另一方面,本发明涉及包含融合蛋白的脂质体或小泡,所述融合蛋白包含可结合(直接或间接,如本文所述的)本发明的嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头与作为结合对的结合成员的结合结构域或结合单元融合,所述结合对至少包含第一结合成员和作为第二结合成员的所述结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得它们在彼此接触或彼此紧密接近时能够产生可检测的信号。本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将此类融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0840]
存在于所述融合蛋白中并且可以结合本发明的嵌合gpcr的蛋白质优选地如本文针对可以存在于第二融合蛋白中的蛋白质进一步描述的那样。此外,结合对的成员和使用的任何接头可以如本文进一步描述的。也如本文所述,所述蛋白质可直接(如本文所述)或间接(如本文所述)结合本发明的嵌合gpcr。
[0841]
如本文所述,当存在于所述融合蛋白中的蛋白质直接结合本发明的嵌合gpcr时,优选地是使得它特异性结合嵌合gpcr的一个或多个功能性、活性和/或可成药构象,使得它诱导形成和/或稳定嵌合gpcr的一个或多个功能性、活性和/或可成药构象(和/或使嵌合gpcr的构象平衡向一个或多个此类构象转移);和/或使得它诱导形成和/或稳定所述蛋白质、嵌合gpcr和跨层蛋白的其他配体的复合体(所有如本文进一步所述)。此外,当存在于所述融合蛋白中的蛋白质直接与嵌合gpcr结合时,该蛋白质优选地使得,当第二gpcr处于其天然环境中时,该蛋白质可以与对应于所述第二gpcr(即本发明的嵌合gpcr中的icl所源自的第二gpcr)上细胞内结合位点的嵌合gpcr上的结合位点结合。当使用细胞或脂质体进行本发明的方法时,嵌合gpcr上的所述结合位点也优选分别存在于(如本文定义的)细胞的细胞内环境或所述脂质体或小泡内的环境中。
[0842]
此外,当存在于所述融合蛋白中的蛋白质直接结合本发明的嵌合gpcr时,它优选是vhh结构域或源自vhh结构域的结合结构域或结合单元,并且尤其是confobody(如本文所述)。
[0843]
还如本文所述,当存在于所述融合蛋白中的蛋白质与跨层蛋白(即,本发明的嵌合gpcr)间接结合时,优选使得其可以与可结合跨层蛋白的配体结合。所述配体可以如本文针对“第二配体”(当所述第二配体不形成第二融合蛋白的一部分时)所述。此外,所述配体优选使得它特异性结合跨层蛋白的一个或多个功能性、活性和/或可成药构象,使得它诱导形成和/或稳定跨层蛋白的一个或多个功能性、活性和/或可成药构象(和/或使跨层蛋白的构象平衡向一个或多个此类构象转移);和/或使得它诱导形成和/或稳定所述配体、跨层蛋白和跨层蛋白的其他配体的复合体(所有如本文进一步所述)。此外,所述配体优选地使得它可以结合嵌合gpcr上的结合位点,该结合位点对应于衍生icl的第二gpcr上的细胞内结合位点(即,当所述第二gpcr处于其天然环境中时)。此外,如本文所述,所述配体还可以是可以与跨层蛋白结合的蛋白质复合体的一部分,在这种情况下,融合蛋白中存在的蛋白质也可以与所述蛋白质复合体结合。
[0844]
此外,当存在于所述融合蛋白中的蛋白质与跨层蛋白(即与本发明的嵌合gpcr)间
接结合时,其优选为vhh结构域或衍生自vhh结构域的结合结构域或结合单元。此外,在优选的方面,当存在于所述融合蛋白中的蛋白质间接结合跨层蛋白,并且所述跨层蛋白是gpcr时,与gpcr结合的配体是g蛋白,并且存在于所述融合蛋白中的该蛋白质能够特异性结合所述g-蛋白或g-蛋白复合体(例如包含g-α亚基、g-β亚基和g-γ亚基的g-蛋白三聚体)。
[0845]
不管存在于所述融合蛋白中的蛋白质是直接还是间接结合本发明的嵌合gpcr,所述融合蛋白优选存在于(如本文定义的)脂质体或小泡内的环境中。此外,当第二配体不形成所述融合蛋白的一部分时,脂质体或小泡内的环境也将含有适量的第二配体。
[0846]
在另一方面,本发明涉及包含第一融合蛋白和第二融合蛋白的脂质体或小泡,其中:
[0847]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0848]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0849]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)本发明的嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员。
[0850]
本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将所述融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0851]
本发明特别地涉及包含第一融合蛋白和第二融合蛋白的脂质体或小泡,其中:
[0852]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0853]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0854]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)本发明的所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0855]-当第二融合蛋白与形成第一融合蛋白一部分的本发明的嵌合gpcr结合(直接或间接,如本文所述)时,结合对的第一和第二结合成员可以彼此接触或紧密接近。
[0856]
再次,本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将所述融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0857]
本发明还涉及包含第一融合蛋白和第二融合蛋白的脂质体或小泡,其中:
[0858]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0859]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0860]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)本发明的所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0861]-结合对的第一和第二结合成员存在于(如本文定义的)脂质体或小泡内的环境中。
[0862]
再次,本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将所述融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0863]
本发明进一步涉及包含第一融合蛋白和第二融合蛋白的脂质体或小泡,其中:
[0864]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0865]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0866]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)本发明的所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0867]-当第二融合蛋白结合(直接或间接,如本文所述)形成第一融合蛋白的一部分的本发明的嵌合gpcr时,所述脂质体或小泡能够产生可检测的信号(并且特别是由结合对的第一和第二结合成员产生的可检测的信号)。
[0868]
再次,本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将所述融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0869]
本发明进一步涉及包含第一融合蛋白和第二融合蛋白的脂质体或小泡,其中:
[0870]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产生可检测的信号;和
[0871]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0872]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)本发明的所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0873]-当存在于脂质体或小泡外面的环境中的本发明嵌合gpcr的配体与本发明嵌合gpcr结合时,所述脂质体或小泡产生可检测的信号和/或可检测的信号的变化(并且特别是由结合对的第一和第二结合成员产生的可检测的信号和/或这样的信号的变化)。
[0874]
再次,本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将所述融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0875]
在特别的方面,本发明涉及包含第一融合蛋白和第二融合蛋白的脂质体或小泡,其中:
[0876]-所述第一融合蛋白包含作为结合对的第一结合成员的结合结构域或结合单元,并且所述第二融合蛋白包含作为所述结合对的第二结合成员的结合结构域或结合单元,其中所述结合对的所述第一和第二结合成员使得当它们彼此接触或彼此紧密接近时能够产
生可检测的信号;和
[0877]-所述第一融合蛋白包含本发明的嵌合gpcr(如本文所述),所述嵌合gpcr直接或通过合适的接头融合至结合对的所述第一结合成员;和
[0878]-所述第二融合蛋白包含可以结合(直接或间接,如本文所述)本发明的所述嵌合gpcr的蛋白质,该蛋白质直接或通过合适的接头融合至所述结合对的第二结合成员;和
[0879]-当存在于脂质体或小泡外部的环境中的本发明嵌合gpcr的激动剂与本发明的嵌合gpcr结合时,所述脂质体或小泡产生可检测的信号和/或可检测的信号的变化(并且特别是由结合对的第一和第二结合成员产生的可检测的信号和/或这样的信号的变化)。
[0880]
再次,本发明还涉及提供此类脂质体或小泡的方法,该方法至少包括将所述融合蛋白并入脂质体或小泡和/或在所述融合蛋白存在下形成脂质体或小泡的步骤。
[0881]
包含此类第一和第二融合蛋白的此类脂质体或小泡可以如本文进一步描述的,并且优选使得它们具有适当锚定或以其他方式并入脂质体或小泡的壁或膜中并跨越所述壁或膜的本发明嵌合gpcr,更优选地使得本发明的嵌合gpcr的氨基酸序列的至少一部分(并且特别地,如本文定义的其细胞外结合位点)延伸出(如本文定义的)至脂质体或小泡外部的环境中和本发明的嵌合gpcr的氨基酸序列的至少一个其他部分(并且特别地,如本文定义的其细胞内结合位点)延伸出(如本文定义的)至脂质体或小泡内部的环境中。
[0882]
当第二融合蛋白与形成第一融合蛋白一部分的本发明的嵌合gpcr结合(直接或间接,如本文所述)时,所述脂质体或小泡还优选地使得结合对的第一和第二结合成员可以彼此接触或紧密接近。对于技术人员将清楚的是,这通常意味着结合对的第一和第二结合成员将存在于(如本文定义的)相对于脂质体或小泡的壁或膜相同的环境中。优选地,脂质体或小泡使得结合对的第一和第二结合成员均存在于(如本文定义的)脂质体或小泡内部的环境中。
[0883]
再次,在涉及包含这样的第一和第二融合蛋白的脂质体或小泡的本发明的方面中,本发明的嵌合gpcr,可直接或间接结合本发明的嵌合gpcr的蛋白质,结合对的成员和所使用的任何接头都可以如本文进一步描述的那样。
[0884]
在进一步的方面,本发明还涉及方法,并且特别是涉及使用本文所述的脂质体或小泡的测定方法或筛选方法。如本文进一步描述的,此类测定和筛选方法可特别用于鉴定化合物和其他化学实体,该化合物和其他化学实体结合(并且特别是特异性结合)本发明的嵌合gpcr并由此结合第一gpcr(嵌合gpcr中的ecl源自所述第一gpcr),可以调节跨层蛋白和所述“第一”gpcr,和/或调节其中涉及第一gpcr、其信号传导和/或其信号传导途径的信号传导、信号传导途径和/或生物或生理活动。因此,本文所述的脂质体或小泡可用于鉴定化合物或其他化学实体的方法中,该化合物或其他化学实体可作为本发明的嵌合gpcr和第一gpcr的激动剂、拮抗剂、反向激动剂、抑制剂或调节剂(例如变构)调节剂。
[0885]
本发明还涉及本文所述的脂质体或小泡的用途,特别是在测定和筛选方法和技术中的用途。此类方法和用途可以再次如本文针对本发明的装置的方法和用途进一步描述的那样。
[0886]
同样,在所有这些方面,此类脂质体或小泡及其用途优选如本文进一步描述的。
[0887]
技术人员将清楚的是,使用本文描述的方法和技术发现、开发、产生和/或优化的化合物可用于任何合适的或期望的目的。所述目的通常与以下各项相关:筛选/生成的化合
物所针对的靶标(即存在于所使用的嵌合gpcr中的ecl所源自的gpcr),与靶标相关的信号传导、途径和/或作用机制,和/或其中涉及所述靶标、途径、信号传导和/或作用机制的生物学、生理学和/或药理学功能。通常并且优选地,本发明的化合物将是这样的,和/或将被选择为使得它以期望或预期的方式能够调节所述靶标、信号传导、途径、作用机制和/或所述生物学、生理学和/或药理学功能。如本文所述,该调节可以采取任何期望或预期的形式,包括但不限于靶标、信号传导、途径、作用机制和/或所述生物学、生理学和/或药理学功能的上调和下调。因此,本发明的化合物可以例如用作所述靶标和/或其信号传导、途径、作用机制和/或所述生物学、生理学和/或药理学功能的激动剂、拮抗剂、反向激动剂、抑制剂或另一种类型的调节剂(例如变构调节剂)。所有这些都可以使用合适的体外、细胞和/或体内测定(例如合适的功效或效力测定)和/或合适的动物模型来确定,取决于特定的靶标、信号传导、途径、作用机制和/或所涉及的所述生物学、生理学和/或药理学功能。合适的测定和模型对于技术人员将是清楚的。
[0888]
通常,当本发明的化合物是靶标的激动剂(或拮抗剂)时,它也将是其中涉及靶标的信号传导、途径、作用机制和/或所述生物学、生理学和/或药理学功能的激动剂(或拮抗剂)。然而,如技术人员清楚的那样,以下也是可能的(并且不排除在本发明的范围之外),本发明的化合物可能(例如但不限于任何种类的假设或解释)是靶标或其信号传导的激动剂(或拮抗剂),但作为靶标或其信号传导的激动剂(或拮抗剂)的作用导致在其中涉及靶标或信号传导的生物学、生理和/或药理学功能的方面作为拮抗剂(或拮抗剂)的作用。
[0889]
在本发明实践的一方面,本文所述的装置和方法将用于测试存在于环境[a]中(例如,如果本发明在细胞中进行,在细胞外环境中,或如果本发明在脂质体或小泡中进行,在脂质体或小泡外部的环境中)的化合物或配体是否能够在它与本发明的装置接触时产生可检测的信号(即以允许所述化合物或配体结合本发明的嵌合gpcr上的结合位点(8)的方式)。类似地,当本发明的方法和装置用于筛选化合物或配体的组、系列或文库时,本发明的方法和装置将用于确定来自所述组、系列或文库的哪些化合物或配体产生可检测的信号(即“命中”)。
[0890]
通常,在本发明中,所述可检测的信号将通过测量由结合对(6/7)产生(或可以)产生的信号(即当第一成员(6)和第二成员(7)彼此接触、彼此接近或以其他方式彼此关联以产生可检测的信号时所产生的信号)来测量。需要注意的是,在本发明中,通常对所述信号的变化进行测量,并且这种变化也包括在此处所用的术语“产生可检测的信号”中。
[0891]
所述变化可以是与基础水平相比信号的增加(该基础水平也可以低于用于测量信号的设备的检测极限,在这种情况下,在存在化合物或配体的情况下(其中之前基本上没有测量到信号)将检测到信号,并且这也包括在如本文所用的术语“信号的增加”内)或与基础水平相比信号的减少。
[0892]
在本发明的实践中,信号的增加将表明化合物或配体作为受体的激动剂。相反,信号的降低表明化合物或配体作为受体的反向激动剂。因此,有利地,本发明的方法和装置可以鉴定本发明的嵌合gpcr的激动剂和反向激动剂(并且由此,所述嵌合gpcr中的ecl所源自的gpcr的激动剂和拮抗剂)和/或区分激动剂与反向激动剂(或反之亦然)成为可能。
[0893]
应当指出,本发明不限于关于化合物或配体与本发明的嵌合蛋白(其上的结合位点(8))之间的接触如何导致可检测的信号的变化的任何具体机制、解释或假设。但是,假设
将涉及以下一种或多种机制。
[0894]
如本文所述,一般而言,本发明的嵌合gpcr将在不存在化合物或配体的情况下以两种或更多种构象之间的平衡存在,并且与其他构象相比,这些构象中的一些将对本发明的嵌合蛋白(上的结合位点(9))和第二配体(4)(即构象诱导的结合结构域或结合单元)之间的结合相互作用具有低(较低)的亲和力(或甚至基本上没有亲和力)。通常,在本发明中,在某个时间点(或某个时间间隔内)测量(或可以)测量的可检测信号的水平将取决于多少(即第二融合蛋白的)第二配体(4)与本发明的嵌合gpcr结合或变得结合,因为第二融合蛋白与本发明的嵌合gpcr的结合将使(更多)第二结合成员(7)接近第一结合成员(6),从而导致可检测的信号(或与可能由于“游离”第二配体与结合成员(6)结合而存在的背景信号水平相比,可检测信号的增加,该背景水平是通常不显著或低于检测限)。
[0895]
因此,一般地,在本发明中,本发明的嵌合gpcr的构象平衡从对第二配体(4)具有低(较低)或基本上没有亲和力的状态向对第二配体(4)具有结合亲和力的状态(4)和/或对所述第二配体(4)具有更好结合亲和力的状态的转移通常会导致可检测的信号的增加。
[0896]
假设在本发明中,本发明的嵌合gpcr与作为激动剂的化合物或配体的接触将使该平衡向对第二配体(4)具有结合亲和力的构象状态和/或具有更好的结合亲和力的状态转移,从而导致可检测到的信号增加。例如,这可能是因为激动性化合物或配体的存在允许形成当化合物或配体不存在时不能形成的新的构象状态(例如,包含化合物或配体、本发明的嵌合gpcr和第二配体的复合体的形成),因为激动性化合物或配体稳定(或通常有利于形成)对第二配体(4)具有高(较高)亲和力的构象状态,和/或因为激动性化合物或配体导致可以结合第二配体的新构象。任何一种或多种这些和其他机制(或它们的任何组合)都可以在任何时候涉及,但总体效果将是在某个时间(即当嵌合gpcr与激动剂化合物或配体接触时)和/或在一定时间间隔内(即在嵌合gpcr与激动剂化合物或配体接触后)与嵌合gpcr相关联的第二配体(4)的量增加,并因此增加与第一结合成员(6)接触或接近的第二结合成员(7)的量,从而增加可检测的信号。
[0897]
基于本文的进一步描述,本领域技术人员也将清楚,因为嵌合gpcr存在于具有对第二配体(2)无亲和力或低(较低)亲和力的状态与具有对第二配体(2)高(较高)亲和力的状态之间的平衡中,即使当化合物或配体不存在时,也将在任何时间点或时间段内存在一定“基础”量的与第二结合位点(9)接触的第二融合蛋白。这种结合的基础水平也将导致可检测的信号的某一基础水平,其可能低于测定的检测极限,但在本发明的一个特定方面,该基础信号是这样的,它是或可以被检测到(和/或本发明的方法以其被检测到的方式进行)。在这种情况下,与所述基础水平相比,激动剂将再次导致可检测的信号的增加,但反向激动剂也可能将构象平衡从对第二配体(4)具有高(较高)亲和力的构象向对第二配体(4)具有低(较低)亲和力的构象转移。这样做的结果将是在特定时刻和/或特定时间间隔内与嵌合gpcr结合的第二融合蛋白的量减少,这将导致可检测的信号的减少。因此,本发明的该方面和设置将使得筛选反向激动剂和/或测试化合物和配体作为反向激动剂的活性成为可能。有利地,本发明的该方面和设置也将使得筛选或测试激动剂和拮抗剂作为筛选或测定的相同运行的一部分成为可能。
[0898]
同样,本发明不限于关于化合物或配体如何作为本发明的嵌合gpcr的反向激动剂的任何特定机制、解释或假设。然而,假设反向激动剂可以稳定(或通常有利于形成)对第二
配体(4)具有低(较低)亲和力的构象状态,可以允许形成新的构象状态(当化合物或配体不存在时该新构象状态不能形成,并且基本上不能结合第二配体(4)或仅以低亲和力结合),和/或可以使嵌合gpcr更难以经历向对第二配体(4)具有更高亲和力的状态的构象变化(例如,通过增加构象变化所需的活化能)。任何一种或多种这些和其他机制(或它们的任何组合)可以在任何时候涉及,但总体影响将是在某个时间(即当嵌合gpcr与反向激动剂接触时)和/或在一定时间间隔内(即在嵌合gpcr与反向激动剂接触后),与嵌合gpcr关联的第二配体(4)的量减少,因此与第一结合成员(6)接触或接近的第二成员(7)的量减少(与不存在反向激动剂的情况相比),从而降低可检测的信号(即与不存在反向激动剂的基础信号相比)。
[0899]
通常,本发明的方法将包括提供如本文所述的装置,然后将所述装置与待筛选或测试的化合物或配体接触,即持续一段时间(其通常将选择以实现合适的或所需的测定或筛选“窗口”,并且其可以用所涉及的受体的一种或多种已知激动剂或反向激动剂针对合适窗口来衡量),并且例如以一种或多种浓度,以便设置剂量反应曲线和/或允许确定ic50或其他所需参数(同样,可以根据获得的经验使用所涉及的受体的一种或多种已知激动剂或反向激动剂来选择这些浓度)。这通常将使用本身已知的用于测定验证的技术来进行。
[0900]
本发明的方法可以在合适的介质中进行,该介质可以是水、缓冲液或另一种合适的水性介质。当使用细胞或小泡进行本发明的方法时,优选适当地选择培养基以分别确保或促进细胞的生存力或所用小泡的稳定性。
[0901]
在本发明的装置与待筛选或测试的化合物或配体接触后,在一个或多个时刻或连续地在期望的时间间隔内测量可检测的信号的水平。这可以以本身已知的任何方式执行,主要取决于正在使用的结合对(6/7)。合适的设备对技术人员来说是清楚的,并且将例如包括以下实验部分中使用的设备。获得的值也可以与参考值(例如,与在使用一种或多种已知激动剂或反向激动剂的相同测定中获得的值、针对空白或载体获得的值,和/或从以前的实验中获得的参考值)进行比较。
[0902]
基于本文的进一步公开,技术人员将能够适当地选择其他条件(例如温度)和设备来进行本发明的方法。对于一些合适但非限制性的条件,还参考本文的实验部分。
[0903]
为了筛选目的,特别是化合物或配体的文库,本发明的方法可以以高通量筛选(hts)形式进行。当使用细胞进行本发明的方法时,可以应用以hts形式进行细胞测定的合适技术。例如参考rajalingham,biotechnologia,97(3),227-234(2016)和zang等人,international journal 0f biotechnology for wellness industries,2012,1,31-51的综述文章。
[0904]
在前面的段落中,已经参照图1描述了本发明,图1显示了本发明的一个实施方案,其中选择了第二配体(4)以直接结合本发明的嵌合gpcr上的结合位点(9)。图2显示了本发明的替代实施方案,其中第二配体(4)不直接结合本发明的嵌合gpcr,而是结合另一蛋白质,该其他蛋白质反过来可以结合本发明的嵌合gpcr上的结合位点(9)。在图2中,所述其他蛋白质(为方便起见在本文中称为“信号传导蛋白”)表示为(5)——图(2)中的所有其他附图标记如本文针对图1所定义。
[0905]
图2所示实施方案的总体原理与本文针对图1描述的方法的总体原理相同,因为本发明利用两种融合蛋白,每个融合蛋白均包含结合对(6/7)的成员,并且第一配体(3)与本
发明的嵌合gpcr的结合导致所述结合对的第一结合成员(6)和第二结合成员(7)彼此接触或紧密接近,产生可检测的信号。此外,与图1一样,并且同样不受任何特定机制、假设或解释的限制,所述信号将因本发明的嵌合gpcr的构象变化和/或本发明的嵌合gpcr的构象平衡的转移而产生、增加或减少和/或以其他方式与本发明的嵌合gpcr的构象变化和/或本发明的嵌合gpcr的构象平衡的转移相关,基本上如关于图1所述。然而,在图2的实施方案中,所述构象变化或构象平衡的转移不是由第二配体(4)与本发明的嵌合gpcr的结合引起(或与之相关),而是由信号传导蛋白(5)与嵌合gpcr的结合引起的。当与嵌合gpcr结合时,第二配体(4)将与信号传导蛋白(5)结合,从而产生可检测的信号。
[0906]
在该实施方案中,同样不受任何特定机制、假设或解释的限制,信号传导蛋白(5)可能仅结合与第一配体(3)结合本发明的嵌合gpcr相关的本发明的嵌合gpcr的那些构象,因此当信号传导蛋白(5)与嵌合gpcr结合时,结合对(6/7)的第一和第二结合成员才能接触或紧密接近。也有可能信号传导蛋白(5)本身在与本发明的嵌合gpcr结合时发生构象变化,并且选择第二配体(4)使得它基本上只结合(或以较高的亲和力结合)在与本发明的嵌合gpcr结合后产生的信号传导蛋白(5)的构象。也有可能信号传导蛋白(5)在与本发明的嵌合gpcr结合时,与其他蛋白质形成复合体(或以其他方式与之关联),并且第二配体(4)结合(或以较高的亲和力结合)复合体。
[0907]
然而,尽管有上述内容,基于本文公开内容,技术人员将清楚,通常优选使用图1所示装置中的嵌合gpcr,特别是结合使用构象诱导的结合结构域或结合单元作为第二配体(然后优选形成第二融合蛋白的一部分)。
[0908]
实验部分
[0909]
在以下实施例1至3说明的本发明的装置中,使用间接结合相关受体的第二融合蛋白。在所述实施例中,第二融合蛋白包含结合g蛋白复合体的vhh结构域(ca4435)或结合g蛋白的vhh结构域(ca4427)。
[0910]
在以下实施例4至8说明的本发明的装置中,使用直接结合相关受体的第二融合蛋白。在所述实施例中,所用的第二融合蛋白各自包含结合所使用的受体上的g蛋白结合位点的vhh结构域。
[0911]
以下表1给出了一些融合蛋白、confobody和以下实施例中提及的其他元件的氨基酸序列。
[0912]
[0913]
[0914]
[0915]
[0916]
[0917]
id no:3)在c末端融合至nanoluc荧光素酶的大亚基(lgbit;seq id no:5)。ca2780(wo12/007593中的seq id no:4和本文的seq id no:20)通过c末端的柔性接头(gssggggsggggssg;seq id no:4)与nanoluc荧光素酶的小亚基(smbit;seq id no:6)融合。转染时重组mc4r pbit1.1c表达载体与ca2780 pcdna3.1表达载体的dna比率为1∶1(对应每个构建体1.5μg)。激动剂ndp-α-msh(tocris,3013)、rm-493(setmelanotide)(chemscene llc,cs-6399)和拮抗剂shu9119(tocris,3420)以不同浓度在测定中应用。样品和媒介物(vehicle)在opti-mem i减少血清(reduced)培养基中制备。
[0927]
本实施例中使用的ca2780融合体的序列在表1中作为seq id no:8给出。
[0928]
结果如图4和图5所示。可以看出,使用本实施例的测定,可以将激动剂与拮抗剂和参考(空白)区分开来,并建立其中一种激动剂的剂量反应曲线。
[0929]
实施例3:重组ox2r的筛选测定:
[0930]
使用与实施例1中描述的基本相同的受体筛选测定,不同之处在于具有来自ox2r的ecl和来自μ-阿片样物质受体的icl的重组人ox2r受体(seq id no:18)在pcdna3.1载体而不是pbit1.1c中表达。重组ox2r表达载体具有源自流感病毒的可切割血凝素(ha)蛋白信号肽(mktiialsyifclvfa;seq id no:1)后跟flag标签序列(dykddddk;seq id no:2)并通过柔性接头(gaqgns-gssggggsgggggssg;seq id no:3)在c末端融合到nanoluc荧光素酶的大亚基(lgbit)。xa8633通过c末端的柔性接头(gssggggsggggssg;seq id no:4)融合到nanoluc荧光素酶的小亚基(smbit;seq id no:6)。转染时重组ox2r表达载体与xa8633表达载体的dna比率为1:30(对应50ng重组ox2r表达载体和1.5μgxa8633表达载体)。激动剂orexin(食欲肽)b(tocris,1456),tak-925(enamine),cs-5456(chemscene llc)和ynt-185(enamine)以及拮抗剂empa(tocris,4558)以不同浓度在测定中应用。在含有最终1%dmso和0.0015%吐温20的opti-mem i减少血清培养基中制备样品和媒介物。
[0931]
本实施例中使用的xa8633融合体的序列在表1中作为seq id no:7给出。作为参考,人截短的(残基6-360)μ-阿片样物质受体(uniprot p35372-1)的氨基酸序列在表1中作为seq id no:19给出。
[0932]
结果如图6至图10所示。可以看出,使用本实施例的测定,可以将激动剂与拮抗剂区分开来,并建立激动剂的剂量反应曲线。
[0933]
实施例4:重组apj受体的筛选测定。
[0934]
使用实施例1中描述的受体筛选测定。嵌合gpcr是apelin/μ-阿片样物质受体嵌合体,具有来自apelin的ecl和来自μ-阿片样物质受体的icl。其完整序列如seq id no:15所示。编码重组人apj受体的pcdna3.1表达载体具有源自流感病毒的可切割血凝素(ha)蛋白信号肽(mktiialsyifclvfa;seq id no:1)后跟flag标签序列(dykdddda;seq id no:2)并通过柔性接头(gaqgns-gssggggsgggggssg;seq id no:3)在c末端融合到nanoluc荧光素酶的大亚基(lgbit;seq id no:5)。xa8633通过c末端的柔性接头(gssggggsggggssg;seq id no:4)融合到nanoluc荧光素酶的小亚基(smbit)。所得融合蛋白的序列作为seq id no:16给出。转染时重组apj受体表达pcdna3.1载体与xa8633表达pcdna3.1载体的dna比率为1∶150(对应10ng重组apj受体表达载体和1.5μg xa8633表达载体)。激动剂[pyr1]-apelin-13(tocris,2420)、ela-14(tocris,6293)、cmf-019(aobious,aob8242)和拮抗剂mm 54(tocris,5992)在测定中以一种或两种浓度应用。在含有最终1%dmso和0.0015%吐温20的
opti-mem i减少血清培养基中制备样品和媒介物。
[0935]
本实施例中使用的xa8633融合体的序列在表1中作为seq id no:7给出。
[0936]
结果如图11a所示。可以看出,使用本实施例的测定,可以将强激动剂与弱激动剂以及拮抗剂和参考(空白)区分开来。
[0937]
在单独的实验中,代替apelin-μ-阿片样物质受体嵌合体,在本发明的测定中使用具有来自apelin受体的ecl和来自β-2ar受体的icl的apelin-β-2ar受体嵌合体。使用的其他融合蛋白是ca2780-smbit融合体。结果如图11b所示。除了激动剂[pyr1]-apelin-13(tocris,2420)、ela-14(tocris,6293)、cmf-019(aobious,aob8242)和拮抗剂mm-54(tocris,5992)之外,对另一种已知的apj激动剂(mm-07,tocris,7053)进行了测试。可以看出,同样在本发明的测定中使用这种其他嵌合体时,即使测定窗口是与图11中使用的测定的测定窗口不完全相同,仍可以将apelin受体的强激动剂与较弱的激动剂以及拮抗剂和参考(空白)区分开来。
[0938]
实施例5:化合物文库的筛选。
[0939]
使用基本上在实施例3中描述的测定来筛选80种化合物的文库(排列在具有16个参考的96孔板上)。将细胞悬浮在opti-mem中并且将化合物加入加0.0015%吐温的opti-mem中。让细胞在室温下稳定1小时,然后加入nanoglo(室温下30分钟),然后加入待测化合物(30或60分钟)。
[0940]
筛选结果显示在图12(对照板)和13(筛选板)中。来自对照板的数据证实该测定可以将ox2r的已知激动剂(tak925)与参考(空白)区分开来。筛选板的数据表明,筛选测定还能够从关于ox2r的未知活性的化合物的文库中识别命中。
[0941]
使用相同的测定对不同的80种化合物的文库(再次,排列在具有16个参考的96孔板上)进行第二次筛选运行。结果显示在图14(对照板)和15(筛选板)中。
[0942]
实施例6:单点放射性配体测定。
[0943]
在针对一系列化学化合物(在图18中的x轴上表示为“a2”到“f11”)的单点放射性配体测定中对mc4r-b2ar嵌合体(seq id no:11,还参见图16和7)和野生型mc4r(seq id no:13)进行测试。
[0944]
使用perkin-elmer microbeta酶标仪在96孔平底板中进行放射性配体测定。每个样品的总体积为100μl。对于野生型mc4r,样品具有以下组成:10μg mc4r蛋白,作为20μl放射性标记的膜提取物添加到样品中;20μl放射性配体溶液([125i]-shu-9119),以使样品中放射性配体的终浓度为0.1nm;60μl测定缓冲液(25mm hepes、100mm nacl、0.20%bsa、50微摩尔gtpgs,ph 7.4);并且测试化合物的缓冲溶液1μl,以得到样品中化合物的终浓度为10微摩尔。对于嵌合体,样品具有以下组成:5μl嵌合蛋白,作为20μl放射性标记的膜提取物添加到样品中;在样品中放射性配体终浓度为0.1nm的20μl放射性配体溶液([125i]-shu-9119);60μl测定缓冲液(25mm hepes、0.1mm mgcl2、1mm cacl2、0.20%bsa、50微摩尔gtpgs,ph 7.4);并且测试化合物的缓冲溶液1μl,以得到样品中化合物的终浓度为10微摩尔。板中还包括非特异性结合的参考样品和阳性对照。
[0945]
每个样品在室温下温育60分钟,然后通过在玻璃纤维过滤器上快速真空过滤来终止反应。cpm使用闪烁计数器进行计数。
[0946]
结果在图18中示意性显示。对于每个化合物,相对于野生型的位移用点表示,相对
于嵌合体的位移用正方形表示,允许直接比较每个化合物的野生型和嵌合体的位移。
[0947]
从图18可以看出:
[0948]-一些测试的化合物(例如a2、c3和g2)导致野生型和嵌合体两者的配体的位移。在某些情况下(例如c2、b5和c5),提供的位移基本上相似;
[0949]-其他测试的化合物(例如a4、e4和h4)基本上不会导致野生型和嵌合体两者的配体的位移(或位移基本上低于放射性配体测定的截止值)。
[0950]
这些结果证实嵌合体在放射性配体测定中是功能性的,并且其功能与野生型的功能相当并代表野生型的功能。然而,图18也展示了在此设置中使用嵌合体的优势。即,对于某些化合物(例如h2、a3、c9、d9和e9),嵌合体上配体的位移比野生型上的配体位移大得多。在该实施例6中使用的设置中,这将所述化合物鉴定为潜在的激动剂(即对于嵌合体并因此对于野生型的功能性状态)。此外,在该测定中,一些化合物(如c2、b5和c5)为嵌合体和野生型二者提供了基本相似的位移(即高于截止值)。这将此类化合物鉴定为潜在的拮抗剂。
[0951]
实施例7:在使用野生型受体的细胞测定中使用嵌合体鉴定的命中构象。
[0952]
在根据实施例1设置的测定和放射性配体测定中测试了一系列化合物的活性
[0953]
结果显示在图19中,其中对于每种化合物(在图19中用点表示),从放射性配体测定中获得的值沿y轴(“conforatio@10微摩尔”)绘制,而来自实施例1的测定的结果沿x轴(“confosensor比率”)列出。结果显示,实施例1的测定设置中的阳性信号(“confosensor比率”》1.2)指示放射性配体中的正值(“confo-比率”>6)。
[0954]
基于这些结果,在标准camp细胞测定中测试了许多化合物(在图19中表示为a到i)以确认它们是否是野生型mc4r的激动剂。α-msh作为阳性对照被包括在内。结果显示在图20和21(显示两个独立实验的结果)中。
[0955]
可以看出,使用嵌合体鉴定的许多化合物可以确认为野生型mc4r的激动剂。结果还表明化合物h(在放射性配体或实施例1的设置中均未给出阳性信号)在所用条件下基本上不显示激动剂活性。
[0956]
实施例8:比较使用gpcr嵌合体测定和camp测定(htrf)
[0957]
比较了用于测试针对mc4r的化合物的两种测定:(i)常规的均相时间分辨荧光(htrf)环amp测定法;(ii)使用gpcr-lgbit融合体(其中gpcr是本发明的重组gpcr,该本发明的重组gpcr基本上具有来自mc4r的ecl和tm以及β-2ar的icl)和ca2780-smbit融合体的测定。
[0958]
使用这些测定,确定了5种已知调节mc4r的化合物以及a-msh(参考)的ic50(对于camp htrf测定)和ec50值(使用本发明的嵌合体的测定)。结果列于表2中,在camp测定中表现最好的两种化合物在使用本发明嵌合体的测定中也表现最好,而在camp测定中表现较差的化合物在使用本发明的嵌合体的测定中也表现较差。
[0959]
测定如下进行:根据制造商建议,使用ultra camp试剂盒(perkin elmer)测量稳定表达人wt mc4r的完整cho细胞中3
′
,5
′‑
环磷酸腺苷(camp)的积累。使用envision酶标仪进行信号的测量。
[0960]
对于使用重组mc4r-lgbit融合体的测定,使用与实施例2中相同的过程。编码重组mc4r的pcdna3.1表达载体具有源自流感病毒的可切割血凝素(ha)蛋白信号肽(mktiialsyifclvfa;seq id no:1)后跟flag标签序列(dykdddda;seq id no:2)并通过柔
性接头(gaqgns-gssggggsgggggssg;seq id no:3)在c末端融合到nanoluc荧光素酶的大亚基(lgbit;seq id no:5)。ca2780(wo 12/007593中的seq id no:4和本文中的seq id no:20)通过c末端的柔性接头(gssggggsggggssg;seq id no:4)融合到nanoluc荧光素酶的小亚基(smbit;seq id no:6)。转染时重组mc4r pcdna3.1表达载体与ca2780 pcdna3.1表达载体的dna比率为1∶100(对应于0.015μg重组mc4r表达载体和1.5μg ca2780表达载体)。
[0961]
激动剂d-msh(tocris,2584)和5种已知调节mc4r的化合物在两种测定中以不同的浓度应用。在含有最终1%dmso和0.00022%吐温20的opti-mem i减少血清培养基中制备样品和媒介物。使细胞在室温下稳定1小时,然后加入nanoglo(室温下30分钟),然后加入待测化合物(30或45分钟)。在envision酶标仪上测量发光。
[0962]
表2:比较使用本发明嵌合体的测定和camp测定的结果。
[0963]
化合物camp(ic50)嵌合体(ec50)2-a8.00e-078.38e-092-b5.44e-073.26e-09a-msh1.61e-071.48e-082-c4.45e-065.46e-082-d3.43e-068.30e-082-e1.17e-051.32e-07
[0964]
实施例9:化合物文库的筛选。
[0965]
在使用与lgbit融合的重组ox2r-mor嵌合体(seq id no:18)和与smbit融合的xa8633(seq id no:21)(参见实施例3)的本发明的测定中和在市售的ox2 ip-one测定中,筛选小化学化合物的板(片段文库)。
[0966]
结果绘制在图23中,x轴代表在本发明的测定中获得的数据,y轴代表在ip-one测定中获得的数据,每个点代表单一化合物的结果。可以看出,在使用本发明的测定获得的结果与在ip-one测定中获得的结果之间存在合理程度的相关度。当将使用本发明的相同测定获得的结果与在ox2放射性配体测定中获得的结果进行比较时,观察到相似程度的相关度(数据未显示)。
[0967]
实施例10:大化合物文库的筛选。
[0968]
在使用与lgbit融合的重组ox2r-mor嵌合体(seq id no:18)和与smbit融合的xa8633(seq id no:21)(参见实施例3)的本发明的测定中筛选11378种化合物的文库。
[0969]
结果绘制在图24a(在30μm下测试的化合物)和图24b(在200μm下测试的化合物)中,x轴代表测试化合物(“样品”)获得的信号与载体溶剂(“空白”)给出的信号之比,并且每个点代表对单个化合物获得的结果。
[0970]
从这些图中可以看出,使用本发明的测定筛选大化合物文库提供了多个命中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1