一种肝素结合蛋白检测试剂盒、制备方法及用途与流程
1.本发明属于免疫检测领域,具体涉及一种肝素结合蛋白检测试剂盒、制备方法及用途。
背景技术:
2.肝素结合蛋白(heparin-binding protein,hbp):是中性粒细胞来源的颗粒蛋白,其结构包含222个氨基酸的单链蛋白,含有8个半胱氨酸残基,在第100、114或145位天冬氨酸残基上具有糖基化位点。它于1984年由shafer等首次分离和鉴定。hbp自身带有较强的正电荷,这导致其具有显著的杀菌能力和肝素结合能力。同时,hbp所带的较强的正电荷也会使其产生趋化活性,可用于激活单核细胞和巨噬细胞,并诱发血管渗透和组织水肿。有研究表明,高浓度的hbp会导致严重的血管渗透,从而引起低血压甚至休克,部分临床数据显示严重的脓毒症患者在发展为低血压前,血浆中可以检测到较高浓度的hbp。
3.一般正常人群的血样中,hbp的含量不超过10ng/ml。当hbp的浓度达到20~30ng/ml时,为一般性感染。而当hbp浓度超过100ng/ml甚至高达1000ng/ml时,即为严重感染。一旦hbp浓度超过1000ng/ml时,病人会处于极度危险中,随时可能面临死亡。
4.目前,临床上将hbp≥15ng/ml作为严重败血症的标志,其敏感性、特异性、阳性预测值和阴性预测值分别可达到87.1%、95.1%、88.4%和94.5%。在纳入监测范围的病人中87%的研究对象的hbp水平都超过15ng/ml。同时,hbp可能是重症患者严重脓毒症/脓毒性休克早期诊断的有效指标。hbp作为诊断脓毒症的敏感性0.80(95%ci 0.76-0.84)、特异性0.81(95%ci 0.77-0.84)。在满足重度脓毒症的临床诊断标准之前长达72h,在患者中就可以观察到hbp浓度升高。另外,hbp还可以用于急性细菌性脑膜炎、儿童尿道感染、感染致休克的发生等的预测,以及用于icu病房监控、指导抗生素使用和预后评价等。
5.目前,肝素结合蛋白的免疫检测方法主要是酶联免疫吸附法(elisa)、胶体金免疫层析法、胶乳颗粒增强比浊法(letia)、荧光免疫层析法等,暂无化学发光法相关产品。
6.酶联免疫吸附法(elisa)的检测原理,以双抗体夹心法为例,是在固相载体上包被一种特异性抗体,加入待测样本后,再加入酶标记的另一种抗体,形成双抗体夹心复合物,再通过发光底物的显色作用,使仪器可以定量检测出的免疫反应。但酶联免疫吸附法存在着操作繁琐、易受人为因素和环境因素的影响、灵敏度低、线性范围窄和检测周期长等缺点。而急性感染和败血症等的发展过程中,准确快速的检验结果,对于病情的预判和病人的诊治,尤其对于急诊病人的诊治是及其重要的,而这也进一步限制了elisa的使用。胶体金免疫层析法和荧光免疫层析法作为poct检验的一种方法,具有上样量少、简便快速的优点,适用于床旁检验。但由于该法试剂系统变异较大,定量不够准确,灵敏度相对差,进一步限制了其在肝素结合蛋白临床检测上的应用。胶乳增强免疫比浊法试剂可在生化仪上实现全自动模式操作,系统误差小,精密度好,试剂稳定性好,但现有试剂的检测灵敏度不够好、线性范围不够宽,如cn108152512a公开了肝素结合蛋白的检测试剂盒,其为胶乳增强免疫比浊检测试剂,分析灵敏度只能达到ng/ml级别,另外胶乳免疫增强比浊检测试剂盒所需的原
材料(包括抗原、抗体)的量相对大,因此原材料使用率也相对低。
7.目前,市面上常见的检测肝素结合蛋白的试剂盒为axis-shield公司的酶联免疫检测试剂盒,其在检测空白限仅只能达到ng/ml级别。检测空白限的级别还有待提升。另外,该酶联免疫试剂盒的操作过程主要包括以下几个步骤:1)预稀释样本和质控品;2)加样并室温孵育60min;3)清洗后,添加酶结合物并室温孵育60min;4)清洗后,添加底物并室温孵育10min;5)添加终止液后再在450nm波长下读数。此试剂盒的检测时间往往需要2小时以上,而且样本需要使用稀释液预先稀释,由于操作繁琐容易引入较多的人为误差,同时,该试剂盒还存在着批间差较大的缺点。
8.化学发光法作为近年来逐渐兴起的一种免疫检测技术,是将免疫反应系统和化学发光技术紧密结合的产物。化学发光技术是利用发光物质,如吖啶酯等,经氧化剂氧化和催化剂催化后,形成一个激发态的中间体,再利用相应的测量仪器测量该中间体在回到基态时产生的光量子产额的检测手段。而免疫反应系统是将发光标记物质标记在抗原或抗体上,再通过形成抗原-抗体复合物进行检测。因而,化学发光法具有特异性强、灵敏度高、精密度好、线性范围宽、高通量和易于实现自动化等众多优点。但是其在原料筛选和工艺参数选择方面需要耗时摸索,另外因肝素结合蛋白在炎症检测、病情诊断和指导抗生素的使用等方面的应用刚刚兴起,关于该抗原的检测方法的研究相对较少,因此目前尚无基于化学发光法的肝素结合蛋白检测试剂盒。
技术实现要素:
9.发明要解决的问题
10.为了解决现有技术存在的问题,本发明的目的在于,提供一种肝素结合蛋白检测试剂盒,该试剂盒具有更优的灵敏度和特异性,线性范围宽,能够快速的得到检测结果。
11.本发明的另一目的在于,提供一种前述肝素结合蛋白检测试剂盒的制备方法。
12.本发明的另一目的在于,提供一种前述肝素结合蛋白检测试剂盒的用途。
13.用于解决问题的方案
14.具体来说,本发明记载了如下技术方案。
15.【1】一种肝素结合蛋白检测试剂盒,其中,所述试剂盒包括:包被于磁性微球的第一株抗体、标记有示踪标记物的第二株抗体;所述第一株抗体和所述第二株抗体所识别的肝素结合蛋白的特异性结合位点不同。
16.【2】根据【1】所述的肝素结合蛋白检测试剂盒,其中,所述第一株抗体所识别的肝素结合蛋白的氨基酸位点的序列为如seq id no:1所示的序列、seq id no:2所示的序列或seq id no:4所示的序列,所述第二株抗体所识别的肝素结合蛋白的氨基酸位点的序列为如seq id no:1所示的序列或如seq id no:4所示的序列。
17.【3】根据【1】或【2】所述的肝素结合蛋白检测试剂盒,其中,所述磁性微球和第一株抗体的质量比为100:1.3~2。
18.【4】根据【1】-【3】任一项所述的肝素结合蛋白检测试剂盒,其中,所述示踪标记物和第二株抗体的摩尔比为12~18:1。
19.【5】根据【1】-【4】任一项所述的肝素结合蛋白检测试剂盒,其中,所述试剂盒还包括液态校准品;优选地,所述液态校准品包括含牛血清白蛋白的pbs缓冲液。
20.【6】根据【1】-【5】任一项所述的肝素结合蛋白检测试剂盒,其中,所述示踪标记物选自由鲁米诺、碱性磷酸酶、辣根过氧化物酶、吖啶酯和金刚烷所组成的组中的一种或多种;优选的,所述示踪标记物为吖啶酯。
21.【7】根据【1】-【6】任一项所述的肝素结合蛋白检测试剂盒的制备方法,其中,所述制备方法包括:
22.磁性微球包被步骤:将所述第一株抗体包被于所述磁性微球上;
23.示踪标记物标记步骤:将所述示踪标记物标记于所述第二株抗体上;
24.配制校准品步骤。
25.【8】根据【7】所述的制备方法,其特征在于,在所述示踪标记物标记步骤中第二株抗体和示踪标记物的标记时间为1.5~2.5小时。
26.【9】根据【7】或【8】所述的制备方法,其特征在于,在所述示踪标记物标记步骤中在4-羟乙基哌嗪乙磺酸(hepes)缓冲液中对第二株抗体进行透析。
27.【10】根据【1】-【6】任一项所述的肝素结合蛋白检测试剂盒在制备用于诊断炎症如败血症或脓毒症的试剂中的应用。
28.发明的效果
29.使用本发明的试剂盒可将空白限的检测降低到pg/ml级别,本发明中检测空白限可达到12.0pg/ml,能够以极高的灵敏度快速检测出样本的hbp的浓度,批间差小,配合本技术人化学发光免疫分析仪(曜旋风系列产品),10分钟即可完成加样和检测等操作,并得到检测结果,可以实现全自动、快速、灵敏、定量检测样本的hbp的浓度。本发明的试剂盒能够用于尽早准确的诊断出脓毒症及一些严重感染性疾病,并为这些疾病的治疗提供充足的时间,有效的评价预后效果。在另一个实施方式中,本发明所提供的试剂盒中的校准品为液态,热稳定性较好。
30.在另一个实施方式中,本发明的待测样本可以是直接获得血浆或者通过抽取人体血样进行分离得到的样本,使用本试剂盒检测时,无需使用稀释液预稀释,使用更为简便,减少人为误差。
31.在另一个实施方式中,本发明所需的原材料(包括抗原、抗体)的量是极少的,极大地提高了原材料的使用率。
32.在另一个实施方式中,本发明试剂制备过程更简单,线性范围更宽,本发明的线性范围高值为250ng/ml,抗原浓度达到2000ng/ml时未见hook效应。这表明即使当患者体内的hbp抗原含量极高时,也不会出现误诊的可能。
附图说明
33.图1示出了本发明实施例2的四组抗体配组符合率曲线图;
34.图2示出了本发明实施例11的hbp抗原的hook效应图;
35.图3出了本发明的线性相关图;
36.图4示出了本发明的样本符合率图。
具体实施方式
37.为了更好地说明本发明,在下文的具体实施方式中给出了众多的具体细节。本领
域技术人员应当理解,没有某些具体细节,本发明同样可以实施。在另外一些实例中,对于本领域技术人员熟知的方法、手段、器材和步骤未作详细描述,以便于凸显本发明的主旨。
38.需要说明的是:
39.本说明书中,术语“磁性微球”与“磁珠”具有相同的含义,是指具有细小粒径的超顺磁微球,一般具有超强的顺磁性。其表面可包被上特异性抗体、受体等,用于分离纯化样品中的靶体。磁珠已被广泛应用于免疫分析、核酸分离提取、细胞分选、酶的固定等多个领域。
40.本说明书中,所提及的“一些具体/优选的实施方案”、“另一些具体/优选的实施方案”、“实施方案”等是指所描述的与该实施方案有关的特定要素(例如,特征、性质和/或特性)包括在此处所述的至少一种实施方案中,并且可存在于其它实施方案中或者可不存在于其它实施方案中。另外,应理解,所述要素可以任何合适的方式组合在各种实施方案中。
41.本说明书中,使用“可以”表示的含义包括了进行某种处理以及不进行某种处理两方面的含义。本说明书中,“任选的”或“任选地”是指接下来描述的事件或情况可发生或可不发生,并且该描述包括该事件发生的情况和该事件不发生的情况。
42.在描述本发明的上下文中(尤其在所附权利要求的上下文中),术语“一个”、“一种”和“该(所述,the)”和类似的语言将被解释为覆盖单数和复数,除非本文另外指示或与上下文明显矛盾。
43.本说明书中,使用“数值a~数值b”或“数值a-数值b”表示的数值范围是指包含端点数值a、b的范围。
44.本发明的说明书和权利要求书中的术语“包括”以及它们任何变形,意图在于覆盖不排他的包含。例如包含一系列步骤或单元的过程、方法或系统、产品或设备没有限定于已列出的步骤或单元,而是可选地还包括没有列出的步骤或单元,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤或单元。
45.《第一方面》
46.本发明提供了一种肝素结合蛋白(hbp)检测试剂盒,其中,所述试剂盒包括:包被于磁性微球的第一株抗体、标记有示踪标记物的第二株抗体和校准品;所述第一株抗体和所述第二株抗体所识别的肝素结合蛋白的特异性结合位点不同。
47.本发明采用双抗体夹心法,该法主要是使用两株不同的特异性抗体,其中被标记于示踪标记物的抗体的结合位点与包被于磁性微球上的抗体结合位点不同。选择这些结合位点不仅有利于示踪物的标记或磁性微球的包被,也不会阻碍抗体与抗原结合形成夹心复合物,因此,提高了反应的特异性和灵敏度。
48.在本发明的一些具体实施方式中,本发明中的第一株抗体和第二株抗体均为抗hbp的单克隆抗体。在一个技术方案中,为了提高检测样品的信号值和检测样本的符合率,优选地,本发明所述第一株抗体所识别的肝素结合蛋白的氨基酸位点的序列为如seq id no:1所示的序列、seq id no:2所示的序列或seq id no:4所示的序列,所述第二株抗体所识别的肝素结合蛋白的氨基酸位点的序列为如seq id no:1所示的序列或如seq id no:4所示的序列。进一步地,为了获得更好的信号值且测值分布更为均匀,优选地,本发明所述第一株抗体所识别的肝素结合蛋白的氨基酸位点的序列为如seq id no:4所示的序列,所述第二株抗体所识别的肝素结合蛋白的氨基酸位点的序列为如seq id no:1所示的序列。
49.本发明对于适用于本发明的示踪标记物的种类不作特定限定。举例而言,所述示踪标记物可以是鲁米诺、碱性磷酸酶、辣根过氧化物酶、吖啶酯和金刚烷等。作为优选,所述示踪标记物为吖啶酯,相对而言将其应用于化学发光检测背景发光低、信噪比高、光释放快速集中、发光效率高、发光强度大,易于与蛋白质联结且联结后光子产率不减少,标记物稳定(在2-8℃下可保存数月之久),另外吖啶酯在水中溶解性好,稳定且不易水解。
50.本发明对于适用于本发明的磁性微球的种类不作特定限定,可以是本领域常用的磁珠。作为本发明实施方式之一,本发明所使用的磁珠为纳米级fe2o3和fe3o4的磁性微粒与高分子材料进行复合后形成的具有顺磁性和极大蛋白吸附量的微米级固相微球,该磁性微球可以在外加磁场的作用下迅速磁化,在磁场消失后剩磁为零。在本发明中对与其复合所用的高分子材料的种类没有特定限定。
51.作为本发明实施方案之一,本发明所使用的磁珠平均粒径为1-5μm,上述磁珠可以通过表面改性而添加多个活性基团,本发明中的活性基团的种类包括但不限于-oh和-cooh。
52.在本发明的一些具体实施方式中,为了提高检测样品信号,所述磁性微球和第一株抗体的质量比为100:1.3~2,为了操作的稳定性和便捷性,进一步优选的,所述磁性微球与第一株抗体的质量比为100:1.3~1.8。
53.在本发明的另一些具体实施方式中,所述示踪标记物和第二株抗体的摩尔比为12~18:1,如果低于12:1该值时会影响检测信号。
54.在本发明的一些具体实施方案中,试剂盒使用时将第一株抗体包被磁性微球按磁性微球使用浓度稀释到0.03~0.08mg/ml,将示踪标记物标记第二株抗体稀释到0.5~2μg/ml,优选1μg/ml。
55.本发明中,所述的试剂盒还包括液态校准品。该校准品在37℃或4℃条件下均能稳定保存,具有良好的热稳定性。在一个具体实施方式中,所述液态校准品包括含牛血清白蛋白的磷酸缓冲盐溶液(即pbs缓冲液)。使用pbs缓冲液相对与其他种类的缓冲液而言,所获得的校准品稳定性高。进一步地,牛血清白蛋白占pbs缓冲液的质量百分数为0.5~1.5wt%,有助于进一步提高稳定性。在本发明的另一些实施方案中,本发明使用含1%的牛血清白蛋白的0.02m pbs溶液来稀释hbp工作液获得校准品。
56.进一步地,本发明的校准品是指将hbp工作液使用含牛血清白蛋白的pbs溶液稀释得到。在本发明的一个具体实施方式中,校准品的制备包括取hbp工作液,使用含1%牛血清白蛋白的0.02m pbs溶液分别稀释至350ng/ml(s5)、150ng/ml(s4)、50ng/ml(s3)、20ng/ml(s2)、10ng/ml(s1)、0ng/ml(s0)、14ng/ml(qcl)和95ng/ml(qch)。
57.在本发明中,所述试剂盒还包括:清洗液、化学发光激发液。
58.本发明中的清洗液为磷酸盐吐温缓冲液(pbst),在本发明的一些具体实施方式中,pbst的ph为7~9,浓度为0.01~0.03mol/l,进一步地,其包括0.5wt%的吐温20。可选地,所述清洗液中还包括防腐剂,本发明所适用的防腐剂可以是本领域常用的防腐剂,例如山梨酸钾、苯甲酸钠、亚硝酸钠、叠氮钠、proclin-300(主要活性成分为2-甲基-4-异噻唑啉-3酮和5-氯-2-甲基-4-异噻唑啉-3酮)和抗生素中的一种或多种。
59.本发明使用的化学发光激发液包括底物液a和底物液b两种,需按照每个样本各添加100ul的底物液a和底物液b来配合使用:底物液a是将h2o2和hno3进行混合,其中h2o2质量
分数为0.01-5.0%,hno3浓度为0.01-1.0mol/l,在本发明的一个具体实施方式中,h2o2质量分数为0.1%,hno3浓度为0.05mol/l;底物液b是将聚乙二醇辛基苯基醚(triton x-100)和naoh进行混合,其中triton x-100的质量分数为0.01-2.0%,naoh的浓度为0.05-1mol/l,在本发明的一个具体实施方式中,triton x-100质量分数为0.1%,naoh浓度为0.5mol/l。
60.《第二方面》
61.本发明还提供了一种根据《第一方面》所述的hbp检测试剂盒的制备方法,其中,所述制备方法包括:
62.磁性微球包被步骤:将所述第一株抗体包被于所述磁性微球上;
63.示踪标记物标记步骤:将所述示踪标记物标记于所述第二株抗体上;
64.配制校准品步骤。
65.本发明发现在磁珠微球包被步骤中,第一株抗体和磁性微球的偶联时间对于检测信号和样本符合率影响不大,偶联时间可以为0.5~1.5小时,为了节省时间,优选偶联时间为0.5小时。
66.作为本发明的实施方案之一,在第一株抗体包被磁性微球步骤中在2-(n-吗啉代)乙磺酸(mes)缓冲液中进行偶联,mes相比于其他缓冲液如pbs、4-羟乙基哌嗪乙磺酸(hepes)而言,检测信号和样本符合率更好。
67.作为本发明的实施方案之一,在第一株抗体包被磁性微球步骤中还使用封闭液,进一步优选地,为了获得更高的检测信号和样本符合率,所述封闭液为含酪蛋白(casein)的磷酸盐缓冲液(pbs)。封闭试剂的浓度范围优选0.01~0.05m,封闭试剂的用量为100~300μl。
68.作为本发明的实施方案之一,在封闭后的磁珠混悬液中,加入少量可以增加磁珠稳定性的发光恢复液,所述发光恢复液的制备方法包括取一定量的牛血清白蛋白用tris-hcl缓冲液溶解,然后加入吐温80以及新生牛血清。
69.在本发明的一个具体实施方式,所述磁性微球包被步骤包括:
70.(1)量取磁性微球,并混悬于0.1m的mes缓冲液中,磁铁吸附5~10min后,弃去上清后,重复上述清洗步骤3~5次,加上述缓冲液(0.1m mes缓冲液),涡旋混匀。
71.(2)加入第一株hbp单克隆抗体,使磁性微球与抗体的质量比为100:1.5,涡旋混匀,37℃孵育30min。
72.(3)加10mg/ml的1-(3-二甲氨基丙基)-3-乙基二亚胺盐酸盐(edc),涡旋混匀,37℃孵育1.5h。
73.(4)取100~300μl含1%casein的pbs溶液(0.02m)进行封闭,封闭2h。
74.(5)向封闭后的磁珠混悬液中添加1ml发光恢复液(5g的牛血清白蛋白+400ml的0.025m的tris-hcl缓冲液溶解+0.1-2
‰
的tween-80+100ml新生牛血清),磁铁吸附,去上清后,重复上述清洗步骤3~5次。
75.(6)将上述制备好的磁珠置于1ml的发光恢复液中,2~8℃保存。
76.作为本发明的实施方案之一,示踪标记物标记步骤中使用的抗体偶联缓冲液选自hepes缓冲液,hepes相比于其他缓冲液如碳酸盐缓冲液(cb)、n-三(羟甲基)甲基-3-氨基丙磺酸(taps)而言,检测信号和样本符合率更好。
77.作为本发明的实施方案之一,示踪标记物标记第二株抗体的标记时间(即室温避
光反应的时间)为1.5~2.5小时,在本发明的一个具体实施方式中,所述第二株抗体标记示踪标记物的标记时间为2小时。
78.在本发明的一个具体实施方式,所述示踪标记物标记步骤包括:
79.(1)将第二株hbp单克隆抗体置于透析袋中,使用不少于2l的0.05m hepes缓冲液(ph=8.5)透析24h,中途换液四次。透析完成后将抗体加入millipore amicon ultra超滤离心管进行浓缩,使抗体浓度大于5mg/ml。
80.(2)将经过浓缩的hbp单克隆抗体置于离心管内,加入溶于dmf的5mg/ml吖啶酯酸-nhs酯溶液(nsp-sa-nhs),使nsp-sa-nhs与hbp单克隆抗体摩尔比为15:1,混匀后,室温避光反应2h,加入浓度为100mg/ml赖氨酸溶液,反应30min,终止反应。
81.(3)将标记物置于透析袋中,用不少于2l的柠檬酸-柠檬酸钠缓冲液(0.01mol/l,ph=4.5)透析24h,中间换液四次,分离游离的nsp-sa-nhs。
82.(4)收集透析过后的标记物,加入5%bsa溶液使bsa终浓度为1%,然后等体积加入甘油,-20℃保存。
83.作为本发明的实施方案之一,配制校准品的步骤包括取含有本发明所述肝素结合蛋白抗原a的工作液,使用含1%牛血清白蛋白的pbs溶液稀释得到标准品溶液。
84.作为本发明的实施方案之一,本发明试剂盒的制备方法还包括配制化学发光激发液和清洗液。称取规定量的各组分按照常规方法配制即可。
85.《第三方面》
86.本发明还提供了一种根据《第一方面》所述的hbp检测试剂盒在制备用于诊断炎症尤其是败血症或脓毒症的试剂中的应用。
87.hbp作为一种新型炎症标志物,具有较高的灵敏度和特异度,明显优于传统的标志物,在临床应用中具有对病情的早期评估、预后评价、疗效观察等价值,同时指导抗生素的应用,减少抗生素的滥用,减少耐药性的发生。本发明的hbp检测试剂盒与适配的全自动化学发光分析仪(曜旋风系列)配套使用能快速有效检测待测样本中hbp水平,有助于临床判断患者是否存在炎症,尤其适合诊断败血症、脓毒症等,另外也可以用于脑细菌性脑膜炎、尿路感染、肾炎等诊断。
88.本发明的待测样本为直接获得血浆和全血,也可以是通过抽取人体血样进行分离得到的样本。
89.具体检测过程包括:将试剂盒中第一株抗体包被磁性微球和示踪标记物标记第二株抗体分别进行稀释,在本发明的一些具体实施方式中,第一株抗体包被磁性微球按磁性微球使用浓度稀释到0.03~0.08mg/ml,将示踪标记物标记第二株抗体稀释到0.5~2μg/ml;在反应杯中依次加入稀释后的试剂以及待测样本或/和校准品,整个加样过程约0.5分钟;将反应杯中溶液充分混匀后,37℃温育6分钟;之后将反应杯置于磁性条件下,使用磁性微球清洗液清洗三次,整个过程需要2分钟;向反应杯中加入化学发光激发液并检测光子值;根据反应杯中检测的光强度,仪器自动计算待测样本中hbp的浓度,检验计算过程需要1分钟。由此可见,使用本发明提供的试剂盒在10分钟即可得到检测结果。
90.检测原理是基于化学发光免疫法,第一株抗体包被磁性微球、吖啶酯标记抗体以及待测抗原在反应杯充分混匀后可获得磁性微球(即磁微粒)-抗体-抗原-吖啶酯复合物。之后经过清洗、加入化学发光激发液,检测光信号强度,从而获得样本中的hbp浓度。
91.使用本发明提供的试剂盒能够以极高的灵敏度检测样本的hbp浓度,本发明的空白限可达12.0pg/ml,这对炎症患者的诊断、用药及预后等具有极大的意义。本发明的天内精密度可保持在6%左右,回收试验结果可达到99.88%,准确度良好,与axis-shield公司的酶联免疫检测试剂盒有较好的相关性。本发明在2000ng/ml的高浓度下,抗hook能力依旧能够满足使用要求。
92.使用本发明提供的试剂盒检测样本中的hbp浓度,总检测时间短,仅需约10分钟即可得到检测结果,可以实现全自动、快速检测样本的hbp的浓度,便于尽早准确的诊断出感染性疾病。
93.实施例
94.实施例1
95.本实施例提供了一种hbp检测试剂盒的制备方法和人血液中hbp检测方法。
96.制备1:第一株抗体包被磁性微球
97.(1)量取10mg磁性微球(平均粒径1.5μm,采购于bangs laboratories公司,固含量2.54%),并混悬于1ml 0.1m的mes缓冲液中,磁铁吸附5~10min后,弃去上清后,重复上述清洗步骤3~5次,加入1ml上述缓冲液(0.1m mes缓冲液),涡旋混匀。
98.(2)加入150μg第一株hbp单克隆抗体(第一株抗体所识别的hbp的氨基酸位点的序列为如seq id no:4所示的序列),使磁性微球与抗体的质量比为100:1.5,涡旋混匀,37℃孵育30min。
99.(3)加入10μl 10mg/ml的1-(3-二甲氨基丙基)-3-乙基二亚胺盐酸盐(edc),涡旋混匀,37℃孵育1.5h。
100.(4)取200μl含1%casein的pbs溶液(0.02m)进行封闭,封闭2h。
101.(5)向封闭后的磁珠混悬液中添加1ml发光恢复液(5g的牛血清白蛋白+400ml的0.025m的tris-hcl缓冲液溶解+0.1-2
‰
的tween-80+100ml新生牛血清),磁铁吸附,去上清后,重复上述清洗步骤3~5次。
102.(6)将上述制备好的磁珠置于1ml的发光恢复液中,2~8℃保存。
103.制备2:标记吖啶酯的hbp单抗溶液的制备
104.(1)将1mg第二株hbp单克隆抗体(第二株抗体所识别的hbp的氨基酸位点的序列为如seq id no:1所示的序列)置于透析袋中,使用不少于2l的0.05m hepes缓冲液(ph=8.5)透析24h,中途换液四次。透析完成后将抗体加入millipore amicon ultra超滤离心管进行浓缩,使抗体浓度大于5mg/ml。
105.(2)将经过浓缩的hbp单克隆抗体置于0.5ml的离心管内,加入100μl溶于dmf的5mg/ml吖啶酯酸-nhs酯溶液(nsp-sa-nhs),使nsp-sa-nhs与hbp单克隆抗体摩尔比为15:1,混匀后,室温避光反应2h,加入100μl浓度为100mg/ml赖氨酸溶液,反应30min,终止反应。
106.(3)将标记物置于透析袋中,用不少于2l的柠檬酸-柠檬酸钠缓冲液(0.01mol/l,ph=4.5)透析24h,中间换液四次,分离游离的nsp-sa-nhs。
107.(4)收集透析过后的标记物,加入5%bsa溶液使bsa终浓度为1%,然后等体积加入甘油,-20℃保存。
108.制备3:校准品的制备
109.取hbp工作液(自制),使用含1%牛血清白蛋白的0.02m pbs溶液分别稀释至
350ng/ml(s5)、150ng/ml(s4)、50ng/ml(s3)、20ng/ml(s2)、10ng/ml(s1)、0ng/ml(s0)、14ng/ml(qcl)和95ng/ml(qch)。
110.制备4:化学发光底物液的配制
111.化学发光底物液a为h2o2和hno3的混合液,其中h2o2质量分数为0.1%,hno3浓度为0.05mol/l。
112.化学发光底物液b为triton x-100和naoh的混合液,其中triton x-100的质量分数为0.1%,naoh浓度为0.5mol/l。
113.制备5:清洗液的配制
114.本发明所述清洗液为ph值7.4、浓度为0.02mol/l的pbst溶液,其中含质量分数为0.5%的tween-20。
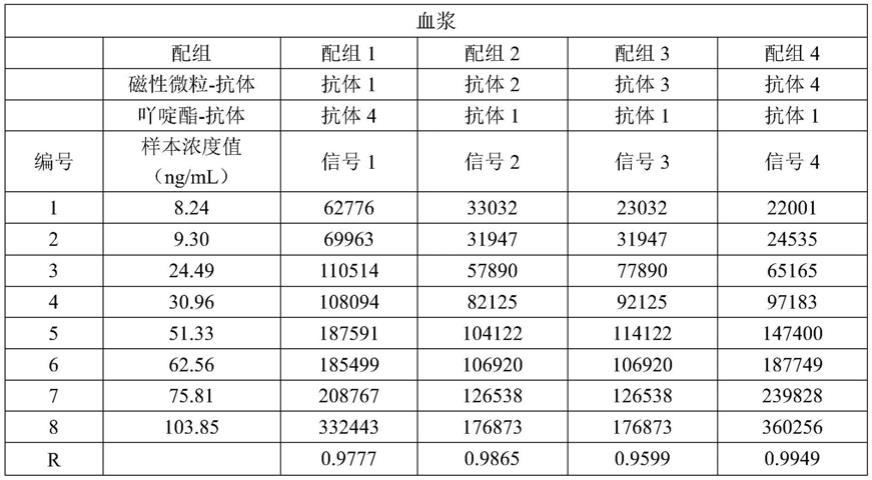
115.使用制备1中得到的第一株抗体包被磁性微球,制备2得到的第二株抗体标记吖啶酯,制备3的校准品、制备4的化学发光底物液和制备5的清洗液制备hbp检测试剂盒。
116.使用该试剂盒与全自动化学发光分析仪(曜旋风系列),检测样本中的hbp浓度。
117.具体的,按照如下步骤使用全自动化学发光分析仪器测量待测样本中的hbp浓度:
118.1.将制备1中制备的第一株抗体包被磁性微球按磁性微球使用浓度稀释到0.05mg/ml(试剂1),将制备2制备的吖啶酯标记第二株抗体稀释到1μg/ml(试剂2);
119.2.反应杯中依次加入50μl的试剂1和50μl的试剂2;
120.3.将5μl的待测样本或/和校准品加入反应杯中,整个加样过程需要0.5分钟;
121.4.反应杯中溶液充分混匀后,37℃温育6分钟;
122.5.置于磁性条件下,使用磁性微球清洗液清洗三次,整个过程需要2分钟;
123.6.向反应杯中加入100μl的化学发光底物液a后,再加入100μl的化学发光底物液b,并立即检测光子值;
124.7.根据反应杯中检测的光强度,仪器自动计算待测样本中hbp的浓度,整个检验,计算过程需要1分钟。
125.实施例2
126.hbp检测试剂盒中使用的抗体的配组筛选
127.本实施例制备1和制备2过程中hbp单克隆抗体有四种:抗体1识别氨基酸位点的序列为如seq id no:1所示的序列,抗体2识别氨基酸位点的序列为如seq id no:2所示的序列,抗体3识别氨基酸位点的序列为如seq id no:3所示的序列,抗体4识别氨基酸位点的序列为如seq id no:4所示的序列。
128.将抗体1、2、3和4分别包被于磁性微球上,形成抗体1-磁性微球混悬液、抗体2-磁性微球混悬液、抗体3-磁性微球混悬液和抗体4-磁性微球混悬液,将抗体1和抗体4分别标记于吖啶酯上,获得抗体1-吖啶酯,抗体4-吖啶酯。上述抗体进行配组,获得配组1(磁性微球-抗体1和吖啶酯-抗体4)、配组2(磁性微球-抗体2和吖啶酯-抗体1)、配组3(磁性微球-抗体3和吖啶酯-抗体1)和配组4(磁性微球-抗体4和吖啶酯-抗体1),其检测血浆结果见表1及图1。其中信号1、信号2、信号3、信号4指的是光强度。
129.表1结果显示,除配组3外,其余三个配组检测血浆样本的符合率(r值)相近,配组4(磁性微球-抗体4和吖啶酯-抗体1)的信号更高,测值分布较均匀。因此,本发明试剂盒所使用的抗体为配组4(磁性微球-抗体4和吖啶酯-抗体1)。
130.表1试剂盒抗体配组筛选8例血浆样本结果
[0131][0132]
实施例3
[0133]
本实施例提供了第一株抗体包被磁性微球的制备过程中第一株hbp单克隆抗体和磁性微球偶联时间的筛选过程。
[0134]
实施例3采用与实施例1基本相同的制备1过程。与实施例1的制备1过程相比,实施例3主要改变制备1中步骤(2)的孵育时间。实施例3在制备1的步骤(2)中分别采用30min或1h或1.5h作为孵育时间。将实施例3中制备所得的三种第一株抗体包被磁性微球,分别和实施例1制备2所得的第二株抗体标记吖啶酯组合,获得三种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表2。
[0135]
结果显示,第一株抗体和磁珠的偶联时间对于检测信号和样本符合率影响不大。因而,在后期试剂盒的磁性微球制备的过程中,可选择0.5h、1h和1.5h,为节省时间,优选的偶联时间为0.5h。
[0136]
表2第一株hbp单克隆抗体和磁性微球偶联时间的筛选结果
[0137]
偶联时间30min1h1.5hs5(350ng/ml)613577618751.5597104.5s4(150ng/ml)332152.5318908291269.5s3(50ng/ml)127211128612108669s2(20ng/ml)45708.54592644035s1(10ng/ml)24852.52869426396s0(0ng/ml)110150.51578.24ng/ml24166222572439716.79ng/ml42363405533819130.96ng/ml84977889527941547.24ng/ml1100011063989515226.51ng/ml66321618406035456.58ng/ml137642129254126161
70.47ng/ml154760146086147527整体符合率0.99350.98560.9996
[0138]
实施例4
[0139]
本实施例提供了第一株抗体包被磁性微球制备过程中抗体包被比例的筛选过程。
[0140]
实施例4采用与实施例1基本相同的制备1过程。与实施例1的制备1过程相比,实施例4主要改变制备1中步骤(2)的磁性微球与抗体的质量比。实施例4在制备1的步骤(2)中分别采用100:0.5、100:1、100:1.5或100:2,作为磁性微球与抗体的质量比。将实施例4中制备所得的四种第一株抗体包被磁性微球,分别和实施例1制备2所得的第二株抗体标记吖啶酯组合,获得四种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表3。
[0141]
由表3的结果显示,筛选磁性微球与抗体的质量比为100:1.5时,检测信号有大幅提升,样本符合率也较好。而当质量比为100:2时检测信号与质量比为100:1.5时的信号几无差异,抗体在质量比为100:1.5时已达到了饱和。因而,在后期试剂盒中磁性微球制备的过程中,优选地包被比例为100:1.5。
[0142]
表3磁性微球与第一株抗体的质量比的筛选结果
[0143]
包被比例100:0.5100:1100:1.5100:2s5(350ng/ml)274624.5389001522069.5542392.5s4(150ng/ml)150740186777172086.5272019.5s3(50ng/ml)4931870761107051.5101090s2(20ng/ml)176942409135381.534873.5s1(10ng/ml)9643.5137501822218462s0(0ng/ml)156.5147.5103988.24ng/ml1538115665202052219216.79ng/ml2238425646314523405630.96ng/ml4913155953666497287047.24ng/ml6316973704822369147026.51ng/ml3616240857501405646556.58ng/ml784229272011483111951670.47ng/ml88671111154132998133307整体符合率0.99220.99620.99180.9918
[0144]
实施例5
[0145]
本实施例提供了第一株抗体包被磁性微球制备过程中缓冲液的筛选过程。
[0146]
实施例5采用与实施例1基本相同的制备1过程。与实施例1的制备1过程相比,实施例5主要改变制备1中步骤(1)的缓冲液。实施例5在制备1的步骤(1)中分别采用a)0.1m的mes缓冲液、b)0.02m pbs缓冲液或c)0.05m hepes缓冲液。将实施例5中制备所得的三种第一株抗体包被磁性微球,分别和实施例1制备2所得的第二株抗体标记吖啶酯组合,获得三种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表4。
[0147]
由表4的结果显示,使用mes稀释液时,检测信号较高,样本符合率也较好。
[0148]
表4磁性微球与第一株抗体偶联的缓冲液筛选结果
[0149]
偶联缓冲液mespbshepes
s5(350ng/ml)771840.5175943.5139051s4(150ng/ml)388098.581429.560492s3(50ng/ml)15228432676.525191s2(20ng/ml)56920.51285010102.5s1(10ng/ml)3742550375213.5s0(0ng/ml)1251024308.24ng/ml294858196748016.79ng/ml49623154891627824.49ng/ml64802188642140532.7ng/ml92038189771945730.96ng/ml111065349873879637.82ng/ml123625343544010351.33ng/ml148406221022088262.56ng/ml143020377784140975.81ng/ml199976555365676326.11ng/ml64105180001807080.23ng/ml18187565146747119.3ng/ml33533102261091556.58ng/ml168174464405699370.98ng/ml173416536765075870.47ng/ml1711493923235912整体符合率0.97020.91380.8574
[0150]
实施例6
[0151]
本实施例提供了第一株抗体包被磁性微球制备过程中封闭条件的筛选过程。
[0152]
实施例6采用与实施例1基本相同的制备1过程。与实施例1的制备1过程相比,实施例6主要改变制备1中步骤(4)的缓冲液。实施例6在制备1的步骤(4)中分别采用a)200μl含5%bsa的pbs溶液(0.02m);b)200μl含1%casein的pbs溶液(0.02m)。将实施例6中制备所得的两种第一株抗体包被磁性微球,分别和实施例1制备2所得的第二株抗体标记吖啶酯组合,获得两种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表5。
[0153]
表5磁性微球与第一株抗体偶联的封闭条件筛选结果
[0154]
封闭条件1%casein5%bsas5(350ng/ml)890841821429.5s4(150ng/ml)471845.5387532.5s3(50ng/ml)215840.5162160.5s2(20ng/ml)7626653029s1(10ng/ml)2948224788s0(0ng/ml)120.51268.24ng/ml397053517916.79ng/ml6636455856
30.96ng/ml11657813396847.24ng/ml18390616630326.51ng/ml11024810240356.58ng/ml23372821903170.47ng/ml263383263756整体符合率0.99590.9936
[0155]
由表5的结果显示,使用1%casein作为封闭剂时,检测信号较高,样本符合率也较好。
[0156]
实施例7
[0157]
本实施例提供了第二株抗体标记吖啶酯制备过程中缓冲液的筛选过程。
[0158]
实施例7采用与实施例1基本相同的制备2过程。与实施例1的制备2过程相比,实施例7主要改变制备2的步骤(1)的缓冲液种类。实施例7在制备2的步骤(1)中分别采用:a)0.05m taps缓冲液(ph=7.5)、b)0.05m hepes缓冲液(ph=8.5)或c)0.05m cb缓冲液(ph=9.6)。将实施例7中制备所得的三种第二株抗体标记吖啶酯,分别和实施例1制备1所得的第一株抗体包被磁性微球组合,获得三种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表6。
[0159]
由表6的结果显示,使用0.05m hepes稀释液作为偶联缓冲液时,检测信号较高,样本符合率也较好。
[0160]
表6第二株抗体标记吖啶酯制备过程中缓冲液的筛选结果
[0161]
偶联缓冲液taps(ph=7.5)hepes(ph=8.5)cb(ph=9.6)s5(350ng/ml)2844741171745.5487945s4(150ng/ml)152155.5430578.5275500s3(50ng/ml)60829.5203869.5115062s2(20ng/ml)2233671784.565332s1(10ng/ml)116462607031103s0(0ng/ml)10519523016.79ng/ml26544602343023424.49ng/ml33706829705124632.7ng/ml471241178944521451.33ng/ml1088382148458658262.56ng/ml1060812137288375075.81ng/ml1278452507931472309.3ng/ml22710477442785116.79ng/ml265446023430234整体符合率0.97370.98260.9445
[0162]
实施例8
[0163]
本实施例提供了第二株抗体标记吖啶酯制备过程中标记时间的筛选过程。
[0164]
实施例8采用与实施例1基本相同的制备2过程。与实施例1的制备2过程相比,实施例8主要改变制备2的步骤(2)的室温避光反应时间。实施例8在制备2的步骤(2)中的室温避
光反应时间分别为1h、1.5h、2h。将实施例8中制备所得的三种第二株抗体标记吖啶酯,分别和实施例1制备1所得的第一株抗体包被磁性微球组合,获得三种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表7。
[0165]
表7第二株抗体标记吖啶酯制备过程中标记时间的筛选结果
[0166][0167][0168]
由表7的结果显示,偶联时间为2h时,检测信号有大幅的提升,样本符合率也较好。
[0169]
实施例9
[0170]
本实施例提供了第二株抗体标记吖啶酯制备过程中标记比例的筛选过程。
[0171]
实施例9采用与实施例1基本相同的制备2过程。与实施例1的制备2过程相比,实施例9主要改变制备2的步骤(2)的nsp-sa-nhs与hbp单克隆抗体的摩尔比。实施例9在制备2的步骤(2)中的nsp-sa-nhs与hbp单克隆抗体的摩尔比分别为15:1、12:1、10:1。将实施例9中制备所得的三种第二株抗体标记吖啶酯,分别和实施例1制备1所得的第一株抗体包被磁性微球组合,获得三种试剂盒,再分别配合全自动化学发光分析仪进行检测,其检测结果见表8。
[0172]
表8第二株抗体标记吖啶酯制备过程中标记比例的筛选结果
[0173]
抗体:吖啶酯15:112:110:1s5(350ng/ml)590329.5450012567554.5s4(150ng/ml)242616.5211940.5270319s3(50ng/ml)997016843381458s2(20ng/ml)269762051727804.5s1(10ng/ml)125451118412396s0(0ng/ml)721211038.24ng/ml23323241251521816.79ng/ml32182328052229226.51ng/ml59235544823850130.96ng/ml74162729935553947.24ng/ml9556410034169906
56.58ng/ml1337871185349322970.47ng/ml172556172141112369整体符合率0.99030.98180.9927
[0174]
由表8的结果显示,抗体和吖啶酯的摩尔比为15:1时,检测信号有大幅的提升,样本符合率也较好。
[0175]
实施例10
[0176]
本实施例提供了校准品的热稳定性试验结果。
[0177]
将实施例1的校准品分别放置于37℃恒温培养箱盒或4℃冰箱中7天后,进行检测,检测结果见表9。
[0178][0179]
结果显示,液态校准品的热稳定性较好,各点的信号偏差均低于10%。
[0180]
实施例11
[0181]
本实施例提供了本试剂盒抗hook能力的评价结果。检测所使用的样本为meridian厂商生产的抗原,该抗原在使用前经过比对试剂盒(axis-shield公司的酶联免疫检测试剂盒)重新赋值后的浓度为2000ng/ml。该抗原使用1%bsa依次倍比稀释至7.8125ng/ml后,进行检测,检测结果见图2。由图2可见当抗原浓度达到2000ng/ml,尚未见较明显的hook效应,这表明即使当患者体内的hbp抗原含量极高时,也不会出现误诊的可能。
[0182]
实施例12
[0183]
本发明实施例1获得的试剂盒的性能测试
[0184]
(1)空白限的检测
[0185]
其检测方法参考国家食品药品监督管理总局发布的yy/t 1233-2014《心肌肌钙蛋白-i定量测定试剂(盒)(化学发光免疫分析法)》的试验方法进行。
[0186]
重复检测空白样本(样本稀释液)20次,再根据检测结果,利用公式计算空白限,结果见表10。
[0187]
表10初始校准曲线的检测结果
[0188] rlu浓度(ng/ml)s0960.00s137742.515.48s26998830.64s314050070.23s4279318136.19s5615191.5277.08
[0189]
表11空白限的检测结果
[0190][0191]
根据零浓度校准品(s0)和相邻的校准品(s1)之间的浓度-化学发光(rlu)值的结果进行两点回归拟合得出一次方程,再将20孔空白样本(s0)检测获得的mean+2sd所对应的rlu值代入上述方程,所获得的浓度值,即为分析灵敏度,本发明的空白限可达到12.0pg/ml,这对于炎症患者的诊断、用药及预后等具有极大的意义。
[0192]
(2)检出限的检测
[0193]
其检测方法参考国家食品药品监督管理总局发布的yy/t 1588-2018《降钙素原测定试剂盒》的试验方法进行。
[0194]
对5份浓度近似检出限(5.8ng/ml)的低值样本进行检测,每份样本检测5次,检测结果按照大小进行排序,结果应符合以下要求:小于空白限的检测结果数量应小于或等于三个,结果见表12,其中空白限的检测结果见表11。
[0195]
表12检出限的检测结果
[0196] 信号1信号2信号3信号4信号55.9ng/ml14007140231402213978139676ng/ml14485145021452614575145935.91ng/ml14253142221426714268142485.97ng/ml14359143101428714262142525.86ng/ml1411514117141371416914161
[0197]
需要说明的是,此处检出限参考酶联免疫试剂盒进行了验证,试剂实际检出限应远小于该值。
[0198]
(3)定量限的检测
[0199]
本实施例提供定量限(loq)的检测结果。本实施例的样本是将试剂盒中的校准品s1进行梯度稀释后,获得样本1(1/2s1)、样本2(1/4s1)、样本3(1/8s1)。将这三个样本重复检测五天,每天重复检测4天,分别计算总体的cv,要求cv最接近20%的样本点为定量限的点。检测结果见表13。
[0200]
表13定量限(loq)的检测结果
[0201][0202]
结果显示,本试剂盒的定量限(loq)可达到3.83ng/ml。
[0203]
(4)天内精密度的检测
[0204]
重复检测高、低标准品各10次,再根据检测结果,计算cv,结果见表14。
[0205]
表14天内精密度的检测结果
[0206][0207]
本发明的天内精密度可达到6.36%和6.06%,这对于诊断的准确性具有极大的意义。
[0208]
(5)线性相关性的检测
[0209]
复孔检测线性样本,并计算各点的理论值和实测值的线性相关系数,结果见表15及图3。
[0210]
表15线性相关性的检测结果
[0211] 浓度1(ng/ml)浓度2(ng/ml)实测值(ng/ml)理论值(ng/ml)样本1265.23259.45262.34262.34样本2224.11228.15226.13236.11样本3203198.56200.78209.87样本4170.44180.52175.48183.64样本5128.36116.34122.35131.17样本672.5579.2375.8978.70样本748.4451.8850.1652.47样本831.7628.5630.1626.23样本90.00120.00180.00150.0015线性相关性
ꢀꢀꢀ
0.9991
[0212]
本发明的线性相关性r》0.990。复孔检测线性样本(9点),并计算各点的理论值和实测值的线性相关系数。其中,理论浓度为未利用校准曲线计算所得的浓度,而实测值为利用比对试剂盒(axis-shield公司的酶联免疫检测试剂盒)检测后的样本值。图3表明线性相关性良好。
[0213]
(6)准确度的检测
[0214]
其检测方法参考国家食品药品监督管理总局发布的yy/t 1588-2018《降钙素原测定试剂盒》的试验方法进行,血清添加比例按照1:7、1:9和1:11稀释后检测。
[0215]
采取回收试验检测试剂盒的准确度,检测结果见表16。
[0216]
表16回收试验的检测结果
[0217]
添加比例浓度1(ng/ml)浓度2(ng/ml)浓度均值(ng/ml)回收率1:728.6526.3127.4896.03%1:923.6424.5324.08599.88%1:1120.9522.3721.66102.60%血清样本a186.24184.90185.57 血清样本b6.105.966.03 [0218]
回收试验结果可达到99.88%,准确度良好。
[0219]
(7)方法学比对
[0220]
使用axis-shield公司的酶联免疫检测试剂盒检测血浆样本后,使用本发明的试剂盒检测上述样本,检测结果见图4。使用本发明的试剂盒检测100例elisa赋值的样本,将axis-shield公司的酶联免疫检测试剂盒检测的的浓度值(ng/ml)与本发明试剂盒的检测信号值做散点图,发现符合率较好,整体符合率r值可达0.9907。可见,本发明的试剂盒与国内外公认的axis-shield公司的酶联免疫检测试剂盒有较好的相关性,能较为准确地从健康人群中筛查出患病个体。
[0221]
(8)参考值
[0222]
本发明的参考值是建立在100份来源于正常人的样本的基础上的,检测数据见表
17。
[0223]
表17正常人检测结果
[0224][0225][0226]
本发明的上述实施例仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1