一种外泌体检测方法与流程
1.本技术涉及生物检测技术领域,尤其涉及一种外泌体检测方法。
背景技术:
2.外泌体是由活细胞分泌大小约为30
–
150nm的囊泡小体。外泌体中含有多种重要物质,包括蛋白质、rna、脂质等,携带了原始细胞上丰富的分子信息,在多种生理和病理过程中发挥重要作用。肿瘤相关来源的外泌体是调控肿瘤发生发展的重要机制,被认为是早期肿瘤诊断的潜在标志物。因此,开发肿瘤外泌体灵敏和特异性的检测是至关重要的。
3.目前,许多方法被用于检测外泌体,如动态光散射(dls)、纳米颗粒跟踪仪(nta)、表面等离子体共振(spr)、纳米流式仪等。以上检测方法需要依赖昂贵的大型仪器,而且检测步骤复杂。
4.此外,外泌体检测方法是还包括酶联免疫分析法和免疫印迹分析法,尽管酶联免疫分析方法和免疫印迹分析法均不需要依赖昂贵的大型仪器,且灵敏度也较高,但二者仍然存在问题,即抗体蛋白容易受到ph值、温度等环境因素的影响而变形,而且整个检测过程操作步骤比较复杂,就酶联免疫法而言,需经过8次洗涤工作,且每步反应时间长达30min。
技术实现要素:
5.本技术提供的一种外泌体检测方法,包括如下步骤:磁珠活化步骤:对羧基化磁珠进行活化;适配体探针生成步骤:采用携带氨基的核酸适配体与携带生物素的探针进行互补,从而生成适配体探针;磁珠与适配体探针结合步骤:将所述羧基化磁珠和适配体探针进行结合,得到磁珠-适配体探针;辅助剂结合步骤:采用辅助剂与磁珠-适配体探针结合,得到磁珠-适配体探针-辅助剂;外泌体结合步骤:将外泌体与磁珠-适配体探针-辅助剂结合,得到磁珠-适配体-外泌体和探针-辅助剂;显色剂参与步骤:采用显色剂,所述探针-辅助剂与显色剂反应生成荧光物质;荧光检测步骤:对所述显色剂参与步骤中获得的荧光物质进行荧光检测。
6.通过采用上述技术方案,在活化过程中,nhs作为催化剂,edc作为羧基活化试剂,羧基化磁珠中的-cooh与edc中的-nh2结合,-cooh中-co的o在诱导作用下吸收电子,使-cooh中—oh氧电负性减弱,对h的束缚能力变弱;之后适配体探针共价偶联到磁珠表面,得到的产物与辅助剂和外泌体进行相应的取代反应,反应过程简单,反应步骤简便;辅助剂与显色剂发生催化反应得到荧光物质,采用荧光检测法不仅灵敏度高,而且测定过程不易受到外界影响,最后得到测定的荧光值也较为准确。
7.可选的,所述磁珠活化步骤中采用缓冲液对所述羧基化磁珠进行洗涤,调节ph值
为6.5-8.5,加入nhs和edc活化羧基化磁珠。
8.通过采用上述技术方案,调节溶液ph值为6.5-8.5以提供接近中性环境,在ph值为中性环境下,磁珠活化性能最强,能够使核苷酸等生物配体共价偶联到磁珠表面。
9.可选的,将非离子型表面活性剂加入所述缓冲液中,所述非离子型表面活性剂的添加量为缓冲液含量的0.01%-0.03%。
10.通过采用上述技术方案,非离子型表面活性剂带有羧酸、磺酸、硫酸、氨基或胺基及其盐,羟基、酰胺基、醚键等极性亲水基团,容易溶解于亲水性溶液中,在缓冲液中加入非离子型表面活性剂,使得表面活性剂的亲水基团溶解于亲水性磁珠溶液中,使磁珠聚集,增强磁珠的特异性。
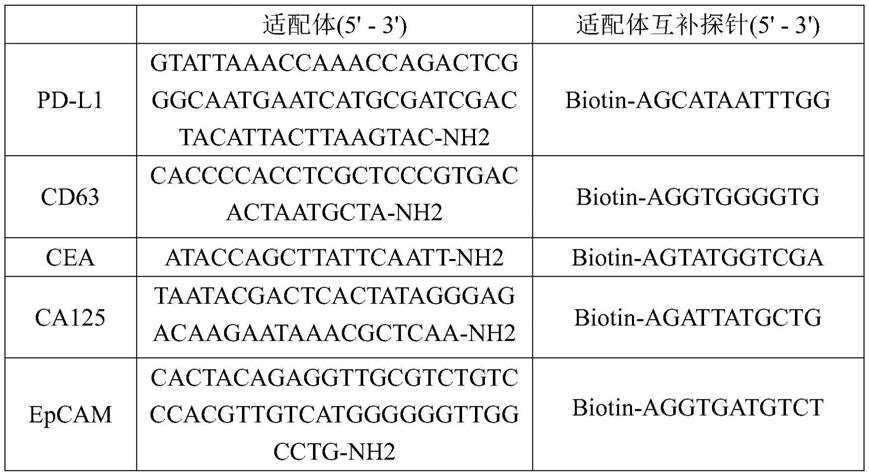
11.可选的,所述适配体探针生成步骤中核酸适配体的靶标选自pd-l1、cn63、cea、ca125、epcam中的至少一种。
12.通过采用上述技术方案,适配体靶标有多种,在互补结合后,均能供价偶联到磁珠表面。
13.可选的,所述磁珠与适配体探针结合步骤中羧基化磁珠和适配体探针结合时,采用缓冲液进行洗涤,调节ph值为6.5-8.5。
14.通过采用上述技术方案,采用缓冲液进行洗涤以调节溶液的ph值为6.5-8.5,以保证磁珠的活化性能。
15.可选的,所述磁珠与适配体探针结合步骤中,在所述磁珠-适配体探针中加入磁珠封闭液和磁珠保存液以维持磁珠活性。
16.通过采用上述技术方案,磁珠与适配体探针结合后的产物放置一定时间后活性和稳定性会逐渐降低,磁珠封闭液作为磁珠偶联抗体封闭试剂,能够将磁珠表面的活性基团短时间内封闭,且对磁珠表面包被的适配体探针没有任何影响和物理性屏蔽,提高后续使用过程中的稳定性;磁珠保存液。
17.可选的,所述辅助剂结合步骤中辅助剂为链霉亲和素-辣根过氧化物酶。
18.通过采用上述技术方案,采用链霉亲和素-辣根过氧化物酶,其中链霉亲和素与携带生物素的互补探针中的生物素发生特异性结合,而辣根过氧化物酶被共价偶联至磁珠表面,生成磁珠-适配体探针-过氧化物酶。
19.可选的,所述外泌体结合步骤中外泌体通过离心式微流控芯片富集得到,所述外泌体结合步骤的反应时间为25min-35min。
20.通过采用上述技术方案,微流控芯片中液体流动可控制,分析速度快、能够在线实现样品预处理和分析,通过微流控芯片使外泌体与磁珠-适配体探针-过氧化物酶充分结合,通过外泌体与探针竞争性结合,生成磁珠-适配体-外泌体和探针-过氧化物酶。
21.可选的,所述显色剂参与步骤中显色剂为过氧化氢和荧光红染料。
22.通过采用上述技术方案,采用过氧化氢和荧光红染料作为显色剂,其中,辅助剂中的过氧化物酶作为过氧化氢反应的催化剂,在过氧化物酶的催化下,荧光红与过氧化氢反应生成红色荧光物质试卤灵。
23.可选的,所述荧光检测步骤中激发波长为535nm。
24.通过采用上述技术方案,荧光红染料在激发波长下,能够激发出红色的荧光。
25.综上所述,本技术包括以下至少一种有益技术效果:
1.通过利用羧基化磁珠、核酸适配体与互补探针、辅助剂、显色剂与物流控芯片中的外泌体的结合,在无需大型仪器设备的情况下直接快速简便测出外泌体的浓度,不需要第三方检测机构的参与,而且荧光分析法中只有待测物质能够发出制定波长的光,通过荧光检测发法得到的荧光强度值更高,即灵敏度更高;2.在反应的过程中加入缓冲液,其中缓冲溶液不会与反应物发生相对作用,一方面调节溶液ph值,提供反应所需的ph值环境,提高反应物以及产物的活性和稳定性;另一方面,利用缓冲溶液洗去上一步骤的残留物。
附图说明
26.图1是本技术实施例的荧光检测原理图。
27.图2是本技术实施例的细胞上清液的不同细胞提取外泌体荧光结果与elisa检测结果对比图。
28.图3是本技术实施例的外泌体nat图。
29.图4是本技术实施例的外泌体透射电镜图。
30.图5是本技术实施例的荧光检测与elisa检测结果对比图。
31.图6是本技术实施例的不同浓度外泌体荧光检测图。
具体实施方式
32.外泌体是调控肿瘤发生发展的重要机制,被认为是早期肿瘤诊断的潜在标志物。因此,通过检测外泌体是否存在从而确定细胞是否病变为肿瘤细胞,如今市面上外泌体的检测方法要么检测步骤复杂,要么使用的原料容易受到环境因素的影响。为了解决该问题,本技术人寻求一种外泌体检测方法,要求检测步骤简单且原料不易受环境影响。通过查阅大量资料,发现核酸适配体能够与多种目标物质高特异性、高选择性地结合,近些年被广泛应用于生物检测技术领域。
33.因此,本技术先将核酸适配体与其互补探针结合,得到适配体探针,之后尝试将外泌体与适配体探针结合,在结合过程中发现还缺少介质,而羧基化磁珠表面含有各种官能团,经活化后可与生物配体的氨基共价配合,而且对环境变化不敏感,因此将羧基化磁珠与携带有氨基的适配体探针相结合,特别的,为了获取较高的灵敏度值,本技术计划采用荧光检测法,所以在反应中尝试了加入多种助剂及对应的显色剂,最终发现采用链霉亲和素-过氧化物酶作为助剂,荧光红染料和过氧化氢作为显色剂时,具有较好的显色效果,能够得到高灵敏度的数值;尤其是当反应在微控流芯片进行时,能够轻易将外泌体与探针进行膜分离,无需多余步骤便能够直接得到结果。本技术正是基于上述手段做出的。
34.本技术实施例公开一种外泌体检测方法。
35.参照图1,对羧基化磁珠(mb-cooh)进行活化,活化后的mb-cooh与适配体探针(aptamer-probe)结合,之后加入辅助剂,本技术中辅助剂为链霉亲和素(streptavidin)-辣根过氧化物酶(hrp),streptavidin与hrp发生特异性结合,核酸适配体上的基团被hrp取代,生成磁珠-适配体探针-辣根过氧化物酶(mb-aptamer-probe-hrp),在mb-aptamer-probe-hrp中加入外泌体(exosome)进行反应,通过pbs缓冲液重复调节反应的ph值,接着进行相应的磁分离和离心,最后生成磁珠-适配体-外泌体(mb-aptamer-exosome)和探针-辣
根过氧化物酶(probe-hrp),通过对probe-hrp加入荧光红染料(amplex red)和过氧化氢(h2o2),使得在hrp的催化下,amplex red和h2o2反应生成红色荧光物质,通过检测红色荧光物质的荧光强度得到检测结果。
36.具体的,首先,外泌体的检测方法包括对羧基化磁珠进行活化,其中,称取25ug羧基化磁珠(mb-cooh);其中,mb-cooh为标准品,即粒径为2μm;浓度为50mg/ml;羧基密度大于1000μmol/g,利用磁力架对其进行磁分离(以下磁分离步骤均采用磁力架进行),通过磁分离,使mb-cooh富集在一起,便于进行活化;之后加入缓冲溶液调节ph值至7.4进行三次洗涤,缓冲溶液包括但不限于弱酸及其盐溶液、弱碱及其盐溶液,本技术用咪唑-盐酸作为缓冲溶液,当采用ph值为7.4的0.1m的咪唑-盐酸时,mb-cooh的稳定性最强。在其他实施例中,ph值也可以是6.5或8.5,使ph值保持6.5-8.5即可。
37.更多的,在咪唑-盐酸溶液中加入0.02%非离子型表面活性剂进一步使mb-cooh聚集,增强磁珠的特异性。其中,非离子表面活性剂包括烷基酚的聚氧乙烯醚、脂肪醇聚氧乙烯醚等,本技术选用0.02%含有聚氧乙烯醚基团的吐温-20作为非离子型表面活性剂。在其他实施例中,非离子表面活性剂含量可以是0.01%或0.03%,只要在0.01%-0.03%即可。之后加入含有10mg nhs和20mg edc进行活化,其中,nhs即n-羟基琥珀酰亚胺,在活化过程中充当催化剂,edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)作为活化试剂,使mb-cooh活化;为了确保mb-cooh活化性能达到最优,在nhs和edc的活化液中加入0.1m咪唑-盐酸溶液以保证整个活化过程ph值为中性。
38.在适配体探针步骤生成过程中,携带氨基(-nh2)的核酸适配体包括但不限于pd-l1、cd63、cea、ca125、epcam,携带生物素(-biotin)的互补探针包括但不限于pd-l1、cn63、cea、ca125、epcam,由于pd-l1对外泌体膜上与癌症早期诊断有关的蛋白具有特异性,因此,本实施例采用pd-l1-nh2适配体链和pd-l1-biotin适配体互补探针链作为核酸适配体靶标,其核酸序列参照表1。将pd-l1-nh2适配体与pd-l1-biotin适配体互补探针(c:c=1:1)在95℃中反应5min,使pd-l1-nh2适配体链与pd-l1-biotin适配体互补探针链充分打开,再逐渐冷却至室温,使pd-l1-nh2适配体与pd-l1-biotin适配体互补探针结合,生成适配体探针(aptamer-probe)。
39.接着将aptamer-probe加入活化后的羧基化磁珠溶液中,在室温下反应过夜,使mb-cooh与pd-l1-nh2中的-nh2结合生成酰胺,产物为磁珠-适配体探针(mb-aptamer-probe);通过磁分离,将未参与反应的mb-cooh去除,之后加入ph值为7.4的0.1m咪唑-盐酸缓冲液进行三次洗涤,除去其余杂质;如果出现非现配现用的情况,通过采用磁珠封闭液和磁珠保存液将产物mb-aptamer-probe进行稳定保存。
40.具体的,将mb-aptamer-probe重悬于磁珠封闭液中,在室温下封闭1.5h,将磁珠上的活性基团封闭,提高后续检测时的信号值和稳定性,之后进行磁分离,使非特异性结合适配体的磁珠洗去,同时确保磁珠分散在溶液中;之后借助磁珠保存液进行水洗,加入10ul的磁珠保存液,以维持磁珠活性,延长磁珠保存期,更多的,为了防止磁珠在保存液中聚集,在4℃下进行低温保存。
41.当mb-aptamer-probe从磁珠保存液中取出进行实验时,为了保证活性,先进行磁分离,使磁珠聚集,接着用pbs缓冲液进行多次水洗洗去磁珠保存液,并维持一定的ph值环境,为接下来的hrp提供生存环境,之后加入辅助剂,即链霉亲和素(streptavidin)-辣根过
氧化物酶(hrp)。其中,streptavidin和互补探针中的biotin发生了特异性结合,从而使互补探针中的biotin被hrp取代,生成磁珠-适配体探针-辣根过氧化物酶(mb-aptamer-probe-hrp)。在mb-aptamer-probe-hrp中加入200ul的pbs缓冲液使产物分散在pbs溶液中,并在低温4℃下进行保存,以防止磁珠聚集以及维持hrp的反应活性。
42.最后,在外泌体结合步骤中将10ul的mb-aptamer-probe-hrp加入微流控芯片中外泌体(exosome)反应的腔室,其中,携带外泌体的样本液来自于细胞培养物的上清液、全血、血清、血浆、腹水、分泌物或者从生物组织得到的澄清的裂解液中的一种或多种,本技术中采用的外泌体来自于人的肺癌细胞上的上清液,在细胞上清液对a549、h1299、h23、beas-2b等细胞对外泌体进行提取,用pbs作为空白对照,每次抽取100ul,并进行荧光检测,如图2所示,其中还包括了对样本液进行nat(nanoparticle tracking analysis)追踪外泌体,如图3所示,在粒径112nm时,外泌体浓度为每毫升3.4
×
106个。对样本液进行电子显微镜检测(sem),如图4所示为外泌体电镜图。
43.通过振动25-35min,即exosome与mb-aptamer结合形成磁珠-适配体-外泌体(mb-aptamer-exosome)和探针-辣根过氧化物酶(probe-hrp),probe-hrp被游离后即可停止振荡,接着在微流控芯片中进行离心,使得相对分子量较大的mb-aptamer-exosome被微流控芯片上的滤膜截留在外,而probe-hrp在离心力的作用下透过滤膜进入检测孔,之后加入显色剂,本技术中,显色剂采用10ul的过氧化氢(1mm)和10ul的荧光红染料(10um);其中,过氧化氢(h2o2)作为辅助剂中的hrp的反应底物,荧光红染料(amplex red)用于hrp和h2o2检测最灵敏最稳定的探针,在hrp的催化下,h2o2与amplex red在避光下反应25min后,生成红色荧光物质试卤灵,该红色荧光物质在酶标仪下进行荧光检测,通过激发波长535nm,在选择发射波长时,使用本发明针对不同浓度的外泌体在检测的荧光曲线如图5所示,当波长为584nm时,外泌体的荧光强度达到最高,同时也能区分出不同浓度的外泌体,因此,本技术选择发射波长584nm,最终得到荧光检测结果,并将该结果与酶联免疫法(elisa)进行荧光强度的对比,如图6所示。
44.相比起dls、nta、spr等方法过程步骤复杂,需要依赖第三方检测机构设备而言,本技术中,磁珠进行前处理以及与适配体探针、辅助剂等结合以及对外泌体的检测过程中,没有使用大型仪器设备,能够在一般实验室开展相应实验室,而且过程步骤简单,最重要的是通过荧光检测法得到的灵敏度比elisa更高。
45.以上均为本技术的较佳实施例,并非依此限制本技术的保护范围,故:凡依本技术的结构、形状、原理所做的等效变化,均应涵盖于本技术的保护范围之内。表1核酸适配体及其互补探针的核酸序列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1