新型冠状病毒抗原和总抗体联合检测试剂盒及检测方法与流程
1.本发明属于生物医药领域,具体涉及一种新型冠状病毒抗原和总抗体联合检测试剂盒及检测方法。
背景技术:
2.新型冠状病毒(2019-ncov,亦被称为sars-cov-2、hcov-19)是一种直径为60-140nm的圆形或椭圆形,且具有典型的冠状病毒基因组结构,属于β-cov的病毒。其基因组大小为29891个核苷酸,包括两端非编码区序列和一个完整的开放阅读框基因(open reading frame,orf),可编码9860个氨基酸。其中orf1a编码木瓜蛋白酶样蛋白酶和3c样蛋白酶,orf1b编码多聚蛋白酶。木瓜蛋白酶样蛋白酶和3c样蛋白酶切割多聚蛋白酶后产生依赖性 rna聚合酶和解螺旋酶,以参与病毒的转录和复制,病毒的结构相关蛋白包括刺突蛋白(s)、膜蛋白(m)、包膜蛋白(e)和核衣壳蛋白(n)。n蛋白基因在冠状病毒内相对保守,会和其他病毒基因有交叉,而orf1ab基因具有较好的特异性,使用荧光pcr法同时检测两个基因能有效避免误诊。新型冠状病毒的n蛋白、e蛋白和s蛋白等抗原,可作为免疫原,在病毒感染人体后,刺激浆细胞产生特异性抗体。n蛋白与病毒基因组rna相互缠绕形成病毒核衣壳,在病毒rna的合成过程中发挥着重要的作用。同时,n蛋白相对保守,在病毒的结构蛋白中所占比例最大,感染早期机体就能产生抗n蛋白的高水平抗体,可以利用n蛋白建立快速检测新冠病毒血清抗体方法。
3.针对新冠病毒的实验室检测主要包括核酸、抗原和抗体三类。核酸检测通过检测新冠病毒的rna序列判断是否发生感染,是确诊新冠肺炎的“金标准”,目前使用最广泛的是实时荧光定量rt-pcr技术。标本类型主要为呼吸道样本,包括鼻拭子、咽拭子、鼻咽拭子、痰液、支气管灌洗液、肺泡灌洗液等。抗原检测主要是应用新冠病毒特异性抗体直接检测样本中的新冠病毒抗原,其结果可以作为早期确认感染的直接证据,所检测的抗原主要是新冠病毒的n蛋白和s蛋白,使用的样本类型一般为呼吸道样本,包括鼻咽拭子和肺泡灌洗液等。抗体检测多以新冠病毒的 n蛋白和s蛋白作为捕获抗原,主要检测血清中的新冠病毒特异性igm和igg 抗体。一般认为新型冠状病毒肺炎发病7天后,首先感染者首先出现igm抗体,然后是igg抗体。当igg抗体出现后,其浓度会持续升高,会存在较长的一段时间;而igm抗体则持续降低,直至消失。抗原及抗体的常用检测方法包括化学发光法、胶体金法和荧光免疫层析法。目前还没有能够同时检测血清中的新冠病毒抗原和抗体的诊断产品上市。
4.自新型冠状病毒疫情发生以来,病原学诊断的主要采用rt-pcr方法检测呼吸道样本中的病毒rna,检测结果为阳性可确诊新冠病毒感染,但核酸检测结果受到患者病程、标本采集、检测试剂质量,检测人员技术等因素的影响。由于采样不当、标本保存不当、采用不同类型的标本以及使用不同厂家试剂都可能造成核酸检测结果“假阴性”而出现漏诊,阳性检出率仅为30-50%;同时在采集标本时,采样人员会与病原体接触,存在感染和传播病毒的可能性。核酸检测在样本的保存、运输等方面都有较高的标准,实验过程操作不当则会导致交叉污染,因此对实验人员的水平也有很高的要求,难以做到简单、方便、自动化的操作。
5.胶体金抗体检测方法是以胶体金为示踪标志物,应用于抗原抗体检测的一种免疫标记技术,其优势是使用方便快速、成本低、操作简单、环境条件要求少,能够快速出具结果,突破了现有检测技术对人员、场所的限制;但其缺点也很明显:1)只能进行定性检测,2)通量低,3)检测结果准确性高度依赖于抗体的质量,如果抗体质量不好,容易引起交叉反应,造成假阳性结果,4) 胶体金检测试剂盒针对的抗体检测主要为igm和igg抗体,较核酸检测的窗口期长。
6.化学发光免疫分析检测也广泛应用于新型冠状病毒的检测。目前市面上的化学发光类的产品,主要是针对新冠病毒特异性igm抗体和igg抗体,也尚未有同时检测新冠病毒抗原和抗体的试剂。化学发光免疫分析检测具有自动化程度高,通量大的特点,其主要问题包括:1)血清抗体检测窗口期长,无法用于早期诊断。2)无法判断受检样本中抗体是感染造成的免疫应答反应,还是接种新冠疫苗的结果。3)易出现假阳性。检测结果容易受到内源性或外源性干扰物质的影响,造成假阳结果;内源性干扰物质一般包括类风湿因子、嗜异性抗体、补体、溶菌酶等;外源性干扰物质一般包括标本溶血、标本被污染、标本存储时间过长、标本凝固不全等。4)不同试剂盒的检测灵敏度差异大,可能出现假阴性结果。
7.新型冠状病毒抗原检测一般是检测呼吸道样本中的新型冠状病毒抗原,优点是快速、高通量,常采用双抗体夹心法,以两种抗原特异性抗体去识别和结合一个靶抗原的不同表位,可以降低交叉反应的几率,有效提高其特异性。缺点包括1)患者感染后只是一段时间内通过呼吸道排毒,感染时间较长抗原水平下降,检测结果明显受检测时机的影响。2)呼吸道样本排毒不稳定,由于新型冠状病毒主要侵犯肺泡等下呼吸道,从鼻咽、口咽等上呼吸道取样,不一定能取到病原体,或者取样中病毒含量很少,可造成假阴性;3)无症状患者排毒较少,容易造成漏检。
8.鉴于现有的新型冠状病毒检测试剂盒和检测方法均存在着这样或那样的缺陷,因此迫切需要开发能够克服现有检测试剂盒中存在的缺陷,或者可以作为现有检测试剂盒和检测方法的补充的新型检测试剂盒和检测方法,。
技术实现要素:
9.本发明提供了一种新型冠状病毒抗原和总抗体联合检测试剂盒及检测方法,所述试剂盒和检测方法采用直接化学发光一步法,形成双抗夹心免疫复合物,一次性检测受检者血清、血浆中的新型冠状病毒抗原及抗体,并能区分新型冠状病毒抗原和抗体的检测结果。该方法提供了一种新型冠状病毒感染的辅助诊断方法,可以将其作为新型冠状病毒核酸检测疑似病例的补充检测指标或者在疑似病例诊断中与核酸检测协同使用,可提示病程的早晚,但不能单独作为新型冠状病毒的确认和排除依据。
10.具体地,通过以下几个方面的技术方案实现了本发明:
11.在第一个方面中,本发明提供了一种新型冠状病毒抗原和总抗体联合检测试剂盒,由r1磁珠、r2吖啶、r3吖啶和r4样本处理液组成,使得在一个试剂盒中分别测定新冠病毒抗原及抗体两个靶标;
12.所述r1磁珠由抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白 s1亚基重组蛋白包被的顺磁微粒以及磁珠稀释液组成;
13.所述r2吖啶为吖啶标记的新冠病毒rbd蛋白;
14.所述r3吖啶为吖啶标记的抗新冠病毒n蛋白鼠源性单克隆抗体;
15.所述r4样本处理液的组成成分为80mm trizma base、50mm trizma hydrochloride、15mm尿素、10mm edta、0.15%tween-20和0.15% proclin-300,
16.所述r4样本处理液的ph为4.5;
17.其中,所述抗新冠病毒n蛋白鼠源性单克隆抗体的氨基酸序列和核苷酸序列分别如seq id no:1和seq id no:2所示;
18.所述新冠病毒刺突蛋白s1亚基重组蛋白的氨基酸序列和核苷酸序列分别如seq id no:3和seq id no:4所示;
19.所述新冠病毒rbd蛋白的氨基酸序列和核苷酸序列分别如seq id no:5 和seq id no:6所示。
20.作为可选的方式,在上述试剂盒中,所述抗新冠病毒n蛋白鼠源性单克隆抗体来源于小鼠腹水提取或杂交瘤细胞体外培养。
21.作为可选的方式,在上述试剂盒中,抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1亚基重组蛋白包被的顺磁微粒和磁珠优选浓度均为 0.2mg/ml,和/或,所述吖啶的浓度为5ug/ml-25ug/ml。
22.作为可选的方式,在上述试剂盒中,所述样本为受检者的血清、血浆、鼻咽拭子或胸水。
23.作为可选的方式,在上述试剂盒中,
24.所述联合检测试剂盒的靶标组合选自以下:抗新冠病毒n蛋白鼠源性单克隆抗体表位74-105aa与抗新冠病毒n蛋白鼠源性单克隆抗体表位 gly44-glu174,s1蛋白表位val16-arg685和rbd蛋白表位319-541aa;
25.优选地,所述抗新冠病毒n蛋白鼠源性单克隆抗体表位74-105aa的氨基酸序列和核苷酸序列分别如seq id no:7和seq id no:8所示;
26.所述抗新冠病毒n蛋白鼠源性单克隆抗体表位gly44-glu174的氨基酸序列和核苷酸序列分别如seq id no:9和seq id no:10所示;
27.所述s1蛋白表位val16-arg685的氨基酸序列和核苷酸序列分别如seq id no:11和seq id no:12所示;
28.所述rbd蛋白表位319-541aa的氨基酸序列和核苷酸序列分别如seqid no:13和seq id no:14所示。
29.在第二个方面中,本发明提供了一种新型冠状病毒抗原和总抗体联合检测方法,使用上述第一个方面所述的试剂盒,所述检测方法为直接化学发光一步法,在一个试剂盒中分别测定新冠病毒抗原及抗体两个靶标,并分别报告所述抗原及所述抗体两个检测结果。
30.作为可选的方式,在上述检测方法中,包括以下步骤:
31.s1、吸取样本,分别吸取10ul-150ul的样本于第一反应杯和第二反应杯进行试验;
32.s2、在步骤s1中添加磁珠和吖啶:按设定程序自动向第一反应杯中添加 50ul r1试剂组分和50ul r2试剂组分,同时向第二反应杯中添加50ul r1 试剂组分和50ul r3试剂组分;
33.s3、温度在37℃孵育20分钟,第一反应杯中,样本中的新冠病毒总抗体,如果存在,
分别与包被于磁珠上s1蛋白抗原和吖啶标记的rbd蛋白抗原结合形成夹心免疫复合物;第二反应杯中,样本中的新冠病毒n蛋白抗原,如果存在,与包被于磁珠上的抗n蛋白鼠源单克隆抗体和吖啶标记的抗n蛋白鼠源单克隆抗体结合形成夹心免疫复合物;
34.s4、清洗::在磁场强度为3000gs磁力作用下,磁颗粒吸附在反应杯壁上,未结合的物质通过洗涤缓冲液冲洗掉;
35.s5、激发和读数:在反应复合物中加入预激发液和激发液,测试结果以相对发光强度(rlu)表示。
36.作为可选的方式,在上述检测方法中,抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1亚基重组蛋白包被的顺磁微粒和磁珠优选浓度均为 0.2mg/ml,和/或,所述吖啶的浓度为5ug/ml-25ug/ml,和/或,磁珠稀释液的组成成分为50mm mes、0.15%bsa、0.15%tween-20和0.5% proclin-300,ph为7.0,和/或,吖啶稀释液的组成成分为30mm pbs、0.15% bsa、0.1%g-anti-h igg、0.15%tween-20和0.5%proclin-300,ph为7.0;所述样本为受检者的血清、血浆、鼻咽拭子或胸水。
37.作为可选的方式,在上述检测方法中,
38.所述洗涤缓冲液包含:0.2%na2hpo4、0.1%nah2po4和0.5%triton x-405,ph7.5;
39.所述预激发液包含:0.5%-1.32%h2o2和1%硝酸,ph 1.10-2.0;
40.所述激发液包含:0.25m-0.35m naoh和1%proclin-300,ph 12.5-13.5。
41.在第三个方面中,本发明提供了上述第一个方面所述的试剂盒在制备新型冠状病毒检测试剂盒中的用途。
42.优选地,所述新型冠状病毒检测试剂盒用于新型冠状病毒感染的辅助诊断,以及将其作为新型冠状病毒核酸检测疑似病例的补充检测指标或者在疑似病例诊断中与核酸检测协同使用,可提示病程的早晚。
43.本发明相对于现有技术,具有以下有益效果:
44.(1)本发明提供了一种新型冠状病毒抗原抗体联合检测的试剂盒及其检测方法。所述试剂盒和检测方法采用直接化学发光免疫检测的一步竞争免疫检测方法,一次性检测受检者血清、血浆中的新型冠状病毒抗原及抗体,并能区分新型冠状病毒抗原和抗体的检测结果。
45.(2)该方法提供了一种新型冠状病毒感染的辅助诊断方法,可以将其作为新型冠状病毒核酸检测疑似病例的补充检测指标或者在疑似病例诊断中与核酸检测协同使用,可提示病程的早晚,但不能单独作为新型冠状病毒的确认和排除依据。
46.(3)本发明中检测的靶标分别选择新冠病毒n抗原及针对新冠病毒刺突蛋白s1亚基受体结合域(receptor binding domian,rbd)的抗体,二者联合应用能够有效避免试剂在检测过程中发生交叉反应;采用化学发光法,搭配使用配套的全自动化学发光测定仪,能够显著提高检测结果的灵敏度,并在检测过程中采用抗原和抗体分杯检测,可分别给出二者的检测结果。
具体实施方式
47.为使本发明实施目的、技术方案和优点更加清楚明白,下面将详细叙述清楚说明本发明所揭示内容的精神,任何所属技术领域技术人员在了解本发明内容的实施例后,当
可由本发明内容所教示的技术,加以改变及修饰,其并不脱离本发明内容的精神与范围。
48.本发明的示意性实施例及其说明用于解释本发明,但并不作为对本发明的限定。另外,在实施方式中所使用相同或类似标号的元件/构件是用来代表相同或类似部分。
49.关于本文中所使用的“第一”、“第二”、
…
等,并非特别指称次序或顺位的意思,也非用以限定本发明,其仅为了区别以相同技术用语描述的元件或操作。
50.关于本文中所使用的方向用语,例如:上、下、左、右、前或后等,因此,使用的方向用语是用来说明并非用来限制本创作。
51.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
52.关于本文中所使用的“及/或”,包括所述事物的任一或全部组合。
53.关于本文中所使用的用语“大致”、“约”等,用以修饰任何可以微变化的数量或误差,但这些微变化或误差并不会改变其本质。一般而言,此类用语所修饰的微变化或误差的范围在部分实施例中可为20%,在部分实施例中可为10%,在部分实施例中可为5%或是其他数值。本领域技术人员应当了解,前述提及的数值可依实际需求而调整,并不以此为限。
54.某些用以描述本技术的用词将于下或在此说明书的别处讨论,以提供本领域技术人员在有关本技术的描述上额外的引导。
55.下面参照具体的实施例对本发明做进一步说明。应当理解,此处所描述的具体实施例仅用于解释本发明,并不用于限定本发明的范围。
56.实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道购买得到的常规产品。
57.下面实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为市售产品。
58.实施例
59.本发明试剂盒的组成
60.本发明试剂盒由r1磁珠、r2吖啶、r3吖啶和r4样本处理液组成,r1 磁珠由抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1亚基重组蛋白包被的顺磁微粒以及磁珠稀释液组成;r2吖啶为吖啶标记的新冠病毒 rbd蛋白;r3吖啶为吖啶标记的抗新冠病毒n蛋白鼠源性单克隆抗体;r4 样本处理液的组成成分为80mm trizma base、50mm trizma hydrochloride、 15mm尿素、10mm edta、0.15%tween-20、0.15%proclin-300,其中, r4样本处理液的ph为4.5。
61.其中,所述抗新冠病毒n蛋白鼠源性单克隆抗体的氨基酸序列和核苷酸序列分别如seq id no:1和seq id no:2所示;
62.所述新冠病毒刺突蛋白s1亚基重组蛋白的氨基酸序列和核苷酸序列分别如seq id no:3和seq id no:4所示;
63.所述新冠病毒rbd蛋白的氨基酸序列和核苷酸序列分别如seq id no:5 和seq id no:6所示。
64.在具体实施方式中,所述抗新冠病毒n蛋白鼠源性单克隆抗体来源于小鼠腹水提取或杂交瘤细胞体外培养。
65.其中,所述抗新冠病毒n蛋白鼠源性单克隆抗体的制备方法包括以下步骤: 1.细胞株的制备:
66.1)将购买的基因工程表达的重组新型冠状病毒n蛋白和弗氏佐剂混合,研磨成乳糜状,初次免疫腹腔注射入balb/c小鼠。
67.2))初免两周时无菌采鼠尾血,采用elisa法鉴定免疫效果,抗体水平极低者为免疫失败,弃去不用。
68.3)对初次免疫鉴定合格的小鼠二次加强免疫,剂量方法同初次免疫,佐剂为福氏不完全佐剂,二免后三周,采取同样方法检测抗体水平。
69.4))若前后两次加强免疫的抗体效价一直在增高,则要继续加强免疫,剂量方法同二次免疫;若抗体效价没有升高,表明抗体水平已达到最高点,必须终止加强免疫。
70.5)当抗体效价稳定在最高水平后,腹腔注射抗原,加强免疫后于第四天无菌取免疫鼠脾细胞与处于对数生长期的sp2/0小鼠骨髓瘤细胞在 50%peg2000作用下融合,融合细胞置于含饲养细胞的96孔细胞培养板中在一定环境下培养。
71.6)融合一周后,elisa检测上清液抗体水平,检出阳性孔,次日对阳性孔复检,对于抗体水平呈上升趋势的阳性孔采用有限稀释法作单克隆化和3-4 次亚克隆化,直至整个细胞培养板的克隆孔均为阳性为止,即为筛选出单克隆株。
72.7)单克隆细胞株经过扩大培养,在体外连续传代4周后冻存,选择在体外连续传代培养四周和冻存3个月后复苏培养,都能稳定分泌抗体的细胞株。
73.2.单抗腹水的制备:
74.1)腹腔注射液体石蜡于balb/c小鼠,一周后注射上述符合条件的细胞株至小鼠腹腔,接种小鼠7-10天后可产生腹水,密切观察小鼠健康状况与腹水征象,待腹水尽可能多,小鼠濒临死亡之前,采集腹水。
75.2)腹水采集后,离心,弃去上层油脂和下层细胞,冷冻保存。
76.3.单抗的纯化:
77.1)取上述腹水调高转速再度离心去除杂质,加入3倍体积的醋酸盐缓冲液和辛酸,混匀,离心过滤留上清液。
78.2)用氢氧化钠调整ph至7.2,加入硫酸铵混匀后离心,弃上清液,取沉淀加入pbs缓冲液透析后离心,保留离心后的上清液加入等体积甘油。
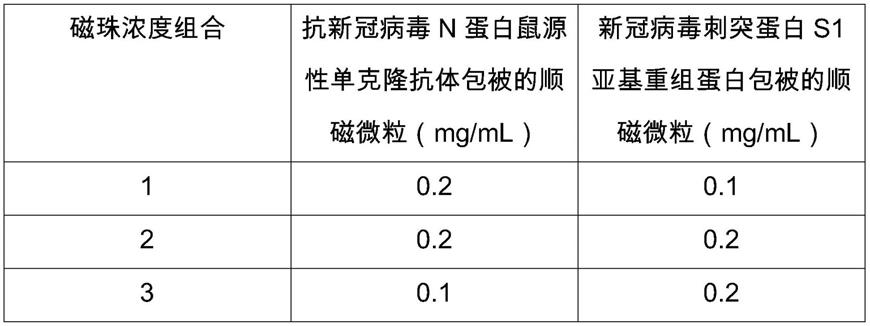
79.上述经过初步纯化的单抗,进一步用deae-纤维素层析法纯化即得单克隆抗体,采用紫外分光光度计测定纯化后的蛋白含量。
80.所述吖啶的标记方法如下所示:
81.取100ug待标记物与10ug吖啶酯于4m的pbs缓冲液中至混合液总体积为100ul时混合均匀,避光反应3-5h;后加入含有0.05%-0.1%bsa的4m 的pbs缓冲液100ul,混合均匀后继续避光反应3-5h;于2-8℃保存。
82.所述rbd的制备方法如下所示:
83.1)将合成的dna序列所示的新冠病毒rbd融合蛋白基因构建进大肠杆菌质粒中;2)将所述新冠病毒rbd蛋白表达质粒转化进大肠杆菌感受态细胞中培养,并挑选单菌落诱导表达后,离心;3)将得到的菌体在缓冲液中超声破碎,离心后再在缓冲溶液中漂洗两次,离心得到沉淀包涵体;4)将沉淀包涵体溶解、超声破碎、离心后得到的上清液使用层析柱纯化
洗脱,收集洗脱液; 5)将洗脱液加入还原剂后装入透析袋进行透析,得到的透析液经离心收集上清,则得到重组新型冠状病毒rbd蛋白。
84.进一步,抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1亚基重组蛋白包被的顺磁微粒和磁珠优选浓度均为0.2mg/ml。
85.另外,需要说明的是,吖啶的浓度为5ug/ml-25ug/ml。
86.通过检测样本信噪比确定抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1亚基重组蛋白包被的顺磁微粒磁珠优选浓度均为0.2mg/ml(如表一所示),磁珠稀释液组成成分如表二所示,通过检测样本信噪比确定优选结果为含有50mm mes、0.15%bsa、0.15%tween-20、0.5%proclin-300 组成的稀释液,ph为7.0。
87.吖啶浓度为5ug/ml-25ug/ml,最终优选结果为10ug/ml。吖啶稀释液组成成分如表三所示,通过检测样本信噪比确定优选结果为含有30mm pbs、0.15% bsa、0.1%g-anti-h igg、0.15%tween-20、0.5%proclin-300组成的稀释液,ph为7.0。
88.表一:
[0089][0090]
表二:
[0091][0092]
表三:
[0093][0094]
本发明的检测方法
[0095]
本发明的试剂盒需与ic-2000、ic-6000系列化学发光测定仪配套使用,除去测定仪默认的清洗液、预激发液、激发液以及相应的清洗和发光读数步骤外,其余步骤均由人工在测定仪上处理完成。
[0096]
其中,所述洗涤缓冲液包含:0.2%na2hpo4、0.1%nah2po4和0.5% triton x-405,ph7.5;
[0097]
所述预激发液包含:0.5%-1.32%h2o2和1%硝酸,ph 1.10-2.0;
[0098]
所述激发液包含:0.25m-0.35m naoh和1%proclin-300,ph 12.5-13.5。
[0099]
一种新型冠状病毒抗原和总抗体联合检测方法,包括以下步骤:
[0100]
s1、吸取样本,分别吸取10ul-150ul的样本于第一反应杯和第二反应杯进行试验;
[0101]
s2、在步骤s1中添加磁珠和吖啶:按设定程序自动向第一反应杯中添加 50ul r1试剂组分和50ul r2试剂组分,同时向第二反应杯中添加50ul r1 试剂组分和50ul r3试剂组分;
[0102]
s3、温度在37℃孵育20分钟,第一反应杯中,样本中的新冠病毒总抗体,如果存在,分别与包被于磁珠上s1蛋白抗原和吖啶标记的rbd蛋白抗原结合形成夹心免疫复合物;第二反应杯中,样本中的新冠病毒n蛋白抗原,如果存在,与包被于磁珠上的抗n蛋白鼠源单克隆抗体和吖啶标记的抗n蛋白鼠源单克隆抗体结合形成夹心免疫复合物;
[0103]
s4、清洗:在磁场强度为3000gs磁力作用下,磁颗粒吸附在反应杯壁上,未结合的物质通过洗涤缓冲液冲洗掉;
[0104]
s5、激发和读数:在反应结合物中加入含有过氧化氢的预激发液,酸性的环境可防止能量过早释放,同时将吖啶酯从反应复合物中脱离下来;然后加入含氢氧化钠的激发液,脱离下来的吖啶酯在碱性溶液中发生氧化反应,n-甲基吖啶酮形成释放能量,返回基态;光路系统读取其释放的能量,测量其发光强度(rlu),通过发光强度计算分析物浓度。
[0105]
在具体实施方式中,抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1亚基重组蛋白包被的顺磁微粒和磁珠优选浓度均为0.2mg/ml,和/或,所述吖啶的浓度为5ug/ml-25ug/ml,和/或,磁珠稀释液的组成成分为50mmmes、0.15%bsa、0.15%tween-20和0.5%proclin-300,ph为7.0,和/ 或,吖啶稀释液的组成成分为30mm pbs、0.15%bsa、0.1%g-anti-h igg、 0.15%tween-20和0.5%proclin-300,ph为7.0;所述样本为受检者的血清、血浆、鼻咽拭子或胸水。
[0106]
样本中新型冠状病毒抗原或抗体的数量与测定仪光学系统检测到的相对发光强度(rlu)有直接关系。结果通过标定曲线确定,主曲线由试剂二维码提供。
[0107]
本发明的测试结果
[0108]
以新型冠状病毒抗原测试信噪比和新型冠状病毒总抗体测试信噪比作为检测指标,对本发明试剂盒和检测方法中所涉及的各种试剂组分的用量,以及各种参数进行筛选。
[0109]
表四:表一中不同磁珠浓度组合的测试结果
[0110][0111]
表五:采用不同浓度的吖啶酯的测试结果
[0112][0113]
表六:表二中不同磁珠稀释液成分的测试结果
[0114][0115]
表七:表三中不同吖啶稀释液成分的测试结果
[0116]
[0117]
表八:不同吸样量的信噪比测试结果
[0118][0119]
通过以上各表中的结果可得知:抗新冠病毒n蛋白鼠源性单克隆抗体及新冠病毒刺突蛋白s1重组蛋白包被的顺磁微粒磁珠优选浓度均为0.2mg/ml;吖啶酯浓度优选结果为10ug/ml;磁珠稀释液组成成分优选结果为含有50mm mes、0.15%bsa、0.15%tween-20、0.5%proclin-300组成的稀释液,ph 为7.0;吖啶稀释液组成成分优选结果为含有30mm pbs、0.15%bsa、0.1% g-anti-h igg、0.15%tween-20、0.5%proclin-300组成的稀释液,ph为7.0;吸样量的优选结果为新型冠状病毒抗原测试样本为100ul,而新型冠状病毒总抗体的样本为20ul。
[0120]
选取3种磁珠组合与吖啶组合检测新型冠状病毒抗原和总抗体测试5个样本的浓度。
[0121]
其中,作为对照的常规抗新冠病毒n蛋白鼠源性单克隆抗体购自菲鹏生物股份有限公司,商品名为cov19-ps-mab107(标记);cov19-ps-mab30 (包被)。
[0122]
表九:不同磁珠和吖啶组合的测试结果
[0123][0124]
结果如表九所示,本发明所选用的特定的抗新冠病毒n蛋白鼠源性单克隆抗体和新冠病毒刺突蛋白s1亚基重组蛋白包被磁珠,吖啶分别使用特定的抗新冠病毒n蛋白鼠源性单克隆抗体和新冠病毒rbd蛋白做为标记抗体,检测结果更为优异。
[0125]
将5个样本均为3份,以不添加任何干扰性物质的样本做为空白对照,另外两组分别加入1500iu/ml类风湿因子和20mg/dl胆红素,采用本发明对其进行测试,得到检测结果。
[0126]
表十:不同干扰物的测试结果
[0127][0128]
结果如表十所示,本发明测试并未受到干扰物质的影响,特异性好,检测结果优异。
[0129]
分别准备一个测试新冠总抗体的阳性样本和一个测试新冠抗原的阳性样本,并将它们按比例稀释;同时准备elisa新冠总抗体检测试剂盒和elisa 新冠抗原检测试剂盒与本发明同步测试样本。
[0130]
其中,elisa新冠总抗原检测试剂盒为新型冠状病毒n蛋白检测试剂盒,购自海泰生物制药有限公司。
[0131]
elisa新冠总抗体检测试剂盒为sars-cov-2(2019-ncov)总抗体检测 elisa试剂盒,购自北京博奥森生物科技有限公司。
[0132]
表十一:本发明与elisa类型试剂测试的比对结果
[0133][0134][0135]
结果如表十一所示,同一样本按照比例稀释后,本发明可准确检测低端浓度样本,明显地elisa在低端灵敏度不如本发明检测方法,本发明可提高测试结果的灵敏度。
[0136]
综合以上结果说明本发明的的检测方法可同时获得新冠病毒抗原及总抗体两种目标物的检测结果,避免了患者多次采集标本;弥补了抗体检测窗口期长,特异性不高,无法区分接种疫苗还是感染病毒,核酸检测及呼吸道标本单纯抗原检测结果不稳定的问题。
[0137]
本发明的试剂盒及检测方法具有准确度高、特异性好,可以半定量、简单易操作、检测时间短,自动化程度高,可高通量检测;能够突破核酸检测对人员技术、场所条件的限制,更适用于新冠肺炎的早期筛查、辅助诊断及监测临床患者的情况。
[0138]
值得注意的是,新冠病毒的核酸与抗体/抗原检测各有侧重,不能相互替代。通过多种检测方法联合应用,互为补充,发挥各自优势,有助于提高新冠病毒实验室检测的灵敏度与特异性,可有效缩短检测窗口期,提高阳性检出率,为感染者诊断、病情监控及新冠疫,情防控提供实验室支持。
[0139]
本发明中采用化学发光免疫分析法,在一个试剂盒中分别测定新冠病毒抗原及抗体两个靶标,并分别报告抗原及抗体两个检测结果的设计思路需要保护;本发明中新冠病毒n抗原与抗rbd抗体检测具体靶点组合的选择需要保护。
[0140]
以上所述仅为本发明示意性的具体实施方式,在不脱离本发明的构思和原则的前提下,任何本领域的技术人员所做出的等同变化与修改,均应属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1